磁共振弥散张量成像和波谱成像对早产儿缺血缺氧脑白质损伤的诊断价值
张福勇
磁共振弥散张量成像和波谱成像对早产儿缺血缺氧脑白质损伤的诊断价值
张福勇①
目的:探讨磁共振弥散张量成像(DTI)的表现弥散系数值(ADC)和分数各向异性(FA)值以及氢质子磁共振波谱(1H-MRS)在早期诊断早产儿缺血缺氧脑白质损伤的临床价值。方法:选取76例出生胎龄为31~35周的早产儿,将其分为观察组和对照组,每组38例。所有早产儿在出生后2周内给予常规磁共振成像(MRI)、弥散张量成像(DTI)及磁共振波谱(MRS)扫描,根据MRI诊断有无早产儿脑白质损伤,对照组为足月儿无围产期窒息史,且常规磁共振序列显示为正常。同时,分别用DTI和MRS测量观察组和对照组不同感兴趣区(ROI)弥散系数(ADC)值和FA值以及不同代谢物峰值比。结果:观察组与对照组相比:①随着胎龄增加,ADC值逐渐下降,FA值逐渐增加;②胆碱(Cho)、乳酸(Lac)、Cho/Cr及Cho/NAA指标随着脑白质损伤程度的加重而上升的,而NAA、NAA/Cho、NAA/Cr与脑白质损伤程度成明显的负相关。结论:早产儿缺血缺氧严重影响患儿脑内水的弥散、FA及代谢物的改变。DTI及MRS技术联合应用,能够早期诊断早产儿脑缺血缺氧以及对脑白质的损伤。
早产儿;脑白质损伤;磁共振弥散张量成像;磁共振波谱成像
[First-author's address]Taian City Central Hospital, Taian 271000, China.
早产儿缺氧缺血容易引起脑白质的损伤,而脑白质损伤是早产儿脑瘫及智力障碍的重要原因[1-2]。有文献报道,每年有120万新生儿缺氧缺血性脑病,100万婴儿遗留永久性神经系统功能障碍[3]。因此在脑组织出现不可逆性损害之前尽早诊断及治疗对患儿预后至关重要。
弥散张量成像(diffusion tensor imaging,DTI)是一种描述大脑结构的新方法,显示脑缺血缺氧成像技术的DTI技术中表观弥散系数(apparent diffusion coefficient,ADC)灵敏度为0.778(95%CI:0.664~0.867),特异度为0.971(95%CI:0.898~0.996);磁共振波谱(magnetic resonance spectroscopy,MRS)分析灵敏度为0.918(95%CI:0.804~0.977),而特异度为0.642(95% CI:0.515~0.75);故ADC特异度较高,MRS灵敏度较好[4]。因此,两种技术紧密结合能够及时发现早产儿脑部缺血缺氧,帮助临床制定合理的治疗方案,对减少或减轻后遗症改善预后有重要意义。本研究重点探讨DTI的ADC和分数各向异性(fractional anisotropy,FA)分数值以及氢质子磁共振波谱(1H-magnetic resonance spectroscopy,1H-MRS)在早期诊断早产儿缺血缺氧脑白质损伤的临床价值。
1 资料与方法
1.1 一般资料
选取2012年1月至2012年12月泰安市中心医院新生儿监护病房治疗的76例出生胎龄为31~35周的早产儿,将其随机分为观察组和对照组,每组38例。观察组为早产儿脑白质损伤患者,其中男性26例,女性12例,胎龄P50为34周,出生体重P50为2220 g,多具有母孕期感染、胎儿宫内窘迫及出生后窒息史,且常规磁共振序列显示为缺血缺氧性脑白质损伤。对照组中男性25例,女性13例,胎龄P50为34周,出生体重P50为2310 g,且常规磁共振序列显示为正常。
上述两组检查均在早产儿出生后2周内完成。所有被检测者均得到患儿家长同意,并经泰安市中心医院医学伦理委员会同意。两组均行DTI和MRS扫描。
1.2 MRS成像技术参数
采用Siemens Avanto 1.5 T,Philips Intera Achieva3.0 T超导型磁共振成像系统,6通道头线圈进行检查。每位受检者均行常规MRI轴位T1WI自旋回波(spin echo,SE)序列、轴位、冠状位、矢状位T2WI涡轮自旋回波(turbo spin echo,TSE)序列扫描,选用点分辨波谱(point resolved spectroscopy,PRESS)序列行三维多体素波谱采集,选用多体素的定位方法,选定额叶、基底节、背侧丘脑和放射冠为感兴趣区(region of interest,ROI)。
1.3 研究方法及观察指标
(1)早产儿脑白质损伤早期临床表现缺乏特异性,对两组病例在14 d内行常规MRI检查及DTI和MRS检查,参照Volpe[5]的诊断确定确诊条件:①早期早产儿脑白质局灶性损伤MR表现为半卵圆中心、侧脑室旁点状或线状DWI高信号,伴或不伴短Tl短T2信号;②脑白质弥漫性损伤DWI可见弥漫性高信号改变,表现为侧脑室旁白质大片状高信号,常规MRI通常无信号改变。符合其中任何一条即诊断为脑白质损伤。
(2)MRS可检测许多重要化合物的浓度,根据这些代谢物含量的多少可以分析组织代谢的改变,1H-MRS可测定12种脑代谢产物和神经递质的共振峰,即N-乙酸门冬氨酸(NAA)、肌酸(Cr)、胆碱(cho)、肌醇(MI)、谷氨酸胺(Gln)、谷氨酸盐(Glu)及乳酸(Lac)等。观察两组代谢物比较及MRS代谢比值比较以及1H-MRS所测代谢常见物之间的关系比较。
1.4 统计学方法
使用SPSS 18.0统计学软件包对数值进行分析处理,统计量描述用均数±标准差(x-±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基本资料比较
早产儿感兴趣区的组织对缺血缺氧非常敏感,极易造成脑白质的损伤,又因为此区域的组织此时正在进行髓鞘化,对缺血缺氧造成的脑白质的损伤极为敏感。两组围产期性别、生产方式基本资料相比,差异无统计学意义(x2=0.060,x2=1.370;P>0.05);两组胎龄、体重及检查日龄比较,差异无统计学意义(t=1.792,t=1.800,t=0.667;P>0.05)见表1、表2。

表1 两组基本资料比较[例]

表2 两组胎龄、体重及检查日龄比较(x-±s)
2.2 两组不同部位表观ADC值及FA值比较
两组不同部位的ADC值、FA值比较发现:额叶、基底节、背侧丘脑、内囊后肢以及放射冠的ADC值、FA值相比,差异均具有统计学意义(t=5.335,t=3.328,t=4.607,t=4.229,t=3.476;P<0.05),随着胎龄增加,ADC值逐渐下降,FA值逐渐增加,见表3、表4。

表3 两组不同部位表观ADC值比较(x-±s)(10-5mm2/S)
2.3 两组代谢物及MRS代谢比值比较
1H-MRS所测代谢常见物之间的关系比较:两组额叶、基底节、背侧丘脑、内囊后肢以及放射冠Cho、Lac、Cho/Cr及NAA/Cho等指标均随着脑白质损伤程度的加重而上升,而NAA、NAA/Cho、NAA/ Cr与脑白质损伤程度成明显的负相关。两组Cho、NAA、Lac及NAA/Cr、Cho/Cr、NAA/Cho相比,差异均有统计学意义(t=4.496,t=43.933,t=41.882,t=8.169,t=2.994;P<0.05)。两组Cr相比,差异无统计学意义(t=0.802,P>0.05),见表5、表6。
2.41H-MRS波谱图分析
(1)本研究波谱分析显示,早产儿基底节是缺氧缺血性脑损伤时最敏感的区域(34周的8例早产儿中,在34周的第7 d行MRS检查,对比早产儿的正常波谱Lac波峰有非常明显的变化。图1A与图1B对比发现,图1A中Lac峰在1.33 ppm处显示比较明显高耸波,而图1B则不明显(如图1所示)。

图1 左侧基底节区1H-MRS波谱图
(2)早产儿的正常额叶(如图2A所示)和早产儿异常额叶(34周的8例早产儿中,在生后,脑白质损伤第7 d行MRS检查(如图2B所示)对比检查可见明显的脑白质损伤的Lac波峰。图2B对比图2A发现,图2B中Lac峰在1.33 ppm处显示比较明显高耸波,图2A则不明显。

图2 左侧额叶白质区1H-MRS波谱图
3 讨论
早产儿围产期脑白质损伤好发于脑室周围大脑白质,因其是动脉供血的终末区,脑血流自动调节功能不成熟,易形成压力被动性脑循环,此时的早产儿少突胶质细胞正好处于高分化期,对损伤具有高度易感性[6-9]。因此,在这一时期可以充分利用ADC特异度较高,MRS灵敏度较好及早检测缺氧缺血对早产儿脑白质的损伤。

表4 两组不同部位FA值比较(x-±s)

表5 两组代谢物比较(x-±s)
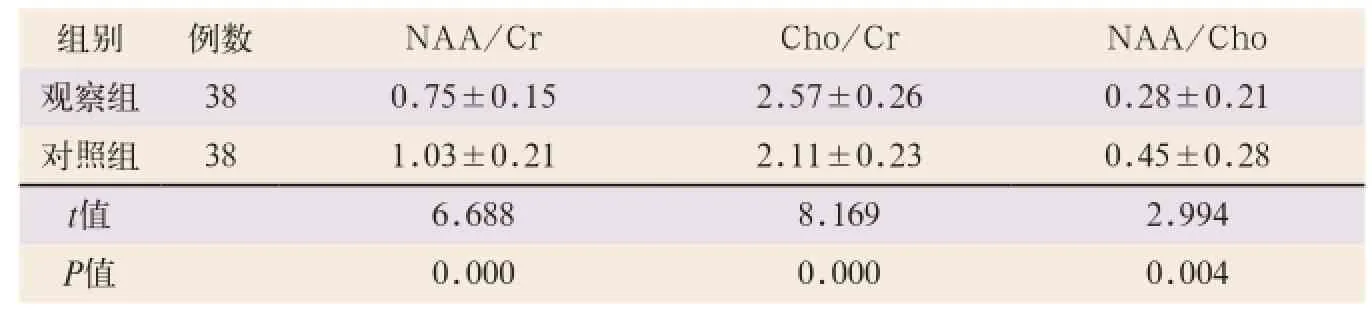
表6 两组MRS代谢比值比较(x-±s)
本研究测定不同区域ADC及FA值,整体趋势随着胎龄增加,ADC值逐渐下降,FA值逐渐增加。表明随着早产儿成熟,脑白质成熟度逐渐增加,脑含水量下降,神经髓鞘逐渐成熟。Bruine等[10]研究表明,FA值与校正胎龄成正比,而ADC值与校正胎龄成反比,与本研究的结果一致。ADC值及FA值随着胎龄增加而变化,可能是水分子弥散成熟变化,水分子运动屏障形成(轴突、树突及胶质髓鞘形成相关的屏障),脑水含量减少,ADC值随着脑发育成熟下降,神经纤维髓鞘化是各向异性的主要原因[11]。在缺氧缺血的早期,细胞膜通透性增大,细胞外的水分子扩散入细胞内,导致细胞毒性水肿,细胞肿胀,使细胞外间隙减小,由于水分子在细胞内扩散较细胞外慢, 导致ADC值降低。
早产儿由于对缺血缺氧比较敏感,对于脑白质的损伤首先表现为Lac峰、NAA峰及比值的变化。额叶、基底节、背侧丘脑、内囊后肢以及放射冠两组Cho、Lac、Cho/Cr及NAA/Cho指标均随着脑白质损伤程度的加重而上升,Augustine等[12]在对早产儿的研究中发现,孕龄与基底节、丘脑的Cho/NAA呈显著正相关,与本研究结果相一致。Cho水平的增高可能与髓鞘形成延迟或形成障碍有关,而NAA、NAA/ Cho、NAA/Cr与脑白质损伤程度成明显的负相关。当患儿扫描时间处于缺氧缺血急性期及亚急性期时,Lac峰可明显升高,是诊断脑白质损伤的可靠指标。有文献报道,缺氧缺血2 h内细胞内乳酸积聚,此时在MRS上即可显示Lac峰的升高[13]。早产儿基底节区处于髓鞘形成期,代谢活跃,对缺氧缺血损害敏感,利于进行MRS测量。本研究轻度组18例中,胎龄为34周的8例早产儿,在出生后的第7 d行基底节区的MRS检查,可见明显的Lac峰。NAA在神经元合成并释放,其含量变化反映神经元的功能状况。当脑组织缺氧缺血时,神经元内的NAA释放减少或者功能障碍,严重的会发生神经元细胞的坏死和神经胶质细胞增生。NAA峰的降低也见于大部分患儿,提示缺氧缺血后神经元的功能受到影响,严重者甚至数量减少、缺失。在MRS检查中造成NAA、NAA/Cho、NAA/Cr的降低与脑白质的损伤程度呈明显的负相关。同时NAA水平及NAA/Cho、NAA/Cr比值与远期神经运动发育存在密切相关性。文献报道,NAA/Cho、NAA/ Cr持续下降,NAA/Cho的改变与缺氧缺血损伤的病理变化相关性最好[14]。因此,提示患儿存在神经元的损伤和功能障碍,对于患儿预后有指导意义,特别是NAA/Lac含量是最为准确的预测新生儿脑病远期神经发育预后的定量标志,对早期临床管理决策及远期神经发育预后具有重要的价值[15]。
综上所述,通过ADC值和FA值的变化,以及代谢物浓度及比值的变化来确定早产儿缺血缺氧对脑白质的损伤,帮助临床及早作出诊断,为临床治疗提供有力的帮助。
[1]Chau V,Synnes A,Grunau RE,et a1.Abnormal brain maturation in preterm neonates associated with adverse developmental outcomes[J].Neurology, 2013,81(24):2082-2089.
[2]李永丽,连建敏,窦社伟,等.脑胶质瘤术后放疗后复发和放射性脑坏死磁共振弥散张量成像鉴别[J].郑州大学学报:医学版,2013,48(3):362-365.
[3]Vasiljecvic B,Maglajlic-Djukic S,Gojinic M,et al. New insights into the pathogenesis of perinatal hypoxic-ischemic brain injury[J].Pediatr Int,2011,53(4):454-462.
[4]林碧云,张鹏,程国强,等.大于35周胎龄新生儿缺氧缺血性脑病远期预后评价体系荟萃分析[J].中华医学杂志,2014,94(2):115-121.
[5]VolPe JJ.Cerebral white matter injury of the premature infant-more commonthan you think[J].Pediatrics,2003,112(1 Pt 1):176-179.
[6]王欣煜,毛健.早产儿脑白质损伤的发病机制[J].国外医学(儿科学分册),2004,31(3):132-134.
[7]林燕,熊英.早产儿脑白质的易损性[J].西部医学, 2009,21(11):1990-1992.
[8]穆靓,杨健,鱼博浪.磁共振弥散加权及张量技术在新生儿缺血缺氧性脑病中的应用[J].磁共振成像,2010, 1(1):60-64.
[9]任榕娜.早产儿脑损伤的高危因素及其对神经发育的影响[J].实用儿科临床杂志,2008,23(12):894-896.
[10]Bruine FTD,Wezel-Meijler GV,Leijser LM,et al. Tractography of developing white of the internal capsule and corpus callosum in very low preterm infants[J].Eur Radiol,2011,21(3):538-547.
[11]Lebel C,Gee M,Camicioli R,et al.Diffusion tensor imaging of white matter tract evoluting over the lifespan[J].Neuroimage,2012,60(1):340-352.
[12]Augustine EM,Spielman DM,Barnes PD,et al. Can magnetic resonance spectroscopy predict neurodevelopmental outcome in very low birth weight preterm infants?[J].J Perinatol,2008,28(9):611-618.
[13]Badve CA,Khanna PC,Ishak GE.Neonatal ischemic brain injury:every radiogist needs to know[J].Pediatr Radiol,2012,42(5):606-619.
[14]Li YK,Liu GR,Zhou XG,et al.Experimental hypoxic-ischemic encephalopathy:comparison of apparent diffusion coefficients and proton magnetic resonance spectroscopy[J].Magn Reson Imaging,2010,28(4):487-494.
[15]Thayyil s,Chandrasekaran M,Taylor A,et a1.Cerebral magnetic resonance biomarkers in neonatal encephalopathy:a meta-analysis[J]. Pediatrics,2010,125(2):382-395.
Research on diffusion tensor imaging and magnetic resonance spectroscopy imaging of brain white matter damage in hypoxic-ischemic encephalopathy of prematurity/
ZHANG Fu-yong//
China Medical Equipment,2015,12(12):107-110.
Objective:To study the clinical values of ADC and FA of DTI as well as H-MRS in early diagnosis of cerebral white matter damage.Methods:To collect the statistics of 76 premature babies stayed in NICU of Taian City Central Hospital from January, 2012 to December, 2012 whose gestational age is from 31 week to 35 week. The babies were scanned with MRI, DTI and MRS. According to the statistics of Brain White Matter Damage Based on MRI those babies are divided into case group and control group which has 38 babies respectively. 38 full-term infants, who don't have history of perinatal asphyxia, whose MRI is normal, are taken as control group. The ADC value and FA value in different ROIs and different metabolite peak ratios in two groups are tested with DTI and MRS respectively.Results:1.With the growth of gestational age the ADC value decreases while the FA value increase gradually. 2.With the deterioration of white matter damage the values of Cho, Lac, Cho/Cr, Cho/NAA rise while the values of NAA, NAA/Cho, NAA/Cr fall.Conclusion:Cerebral white matter damage can severely influence the changes of brain inner water molecular diffusion and anisotropy and metabolin. By uniting the DTI and MRS these two technologies together, people can diagnose cerebral white matter damage and white matter damage in the early period.
Prematurity; Cerebral white matter damage; Diffusion tensor imaging; Magnetic resonance spectroscopy
1672-8270(2015)12-0107-04
R445.2
A
10.3969/J.ISSN.1672-8270.2015.12.034

2015-07-11
①泰安市中心医院院务部 山东 泰安 271000
张福勇,男,(1970- ),硕士,副主任技师。泰安市中心医院院务部,从事医学影像的研究工作。

