正电子发射断层扫描和统计参数图观察肢体缺血预适应对缺血型烟雾病患者脑代谢的影响
苏玉盛,马云川,王曼,张琳瑛
正电子发射断层扫描和统计参数图观察肢体缺血预适应对缺血型烟雾病患者脑代谢的影响
苏玉盛,马云川,王曼,张琳瑛
[摘要]目的利用正电子发射断层扫描(PET)和统计参数图(SPM)观察烟雾病患者肢体缺血预适应治疗前后脑葡萄糖代谢的变化。方法门诊缺血型烟雾病患者62例,随机纳入肢体缺血预适应组(n=31)和对照组(n=31)。治疗前和治疗6个月后行PET成像检查。采用比值法和SPM法对2组患者治疗前后的脑葡萄糖代谢显像结果进行分析。结果肢体缺血预适应组好转情况明显优于对照组(P<0.01),进展情况显著轻于对照组(P<0.001)。设治疗后代谢增加,肢体缺血预适应组得到7个有统计学意义的代谢激活区,包括额叶、颞叶、顶叶,总KE=1121;对照组得到5个具有统计学意义的代谢激活区,包括额叶和顶叶,总KE=292。设治疗后代谢减低,肢体缺血预适应组得到1个具有统计学意义的代谢激活区,位于额叶;对照组得到8个具有统计学意义的代谢激活区,包括额叶、顶叶、枕叶,总KE=629。结论PET和SPM能观察到肢体缺血预适应治疗后缺血型烟雾病患者脑葡萄糖代谢的变化情况。
[关键词]烟雾病;肢体缺血预适应;正电子发射断层成像;脑葡萄糖代谢;统计参数图
[本文著录格式]苏玉盛,马云川,王曼,等.正电子发射断层扫描和统计参数图观察肢体缺血预适应对缺血型烟雾病患者脑代谢的影响[J].中国康复理论与实践, 2015, 21(9): 1064-1068.
CITED AS: Su YS, Ma YC, Wang M, et al. Effects of limb ischemic preconditioning on brain metabolism of ischemic moyamoya disease: a positron emission tomography and statistical parametric mapping study [J]. Zhongguo Kangfu Lilun Yu Shijian, 2015, 21(9): 1064-1068.
烟雾病即颅底异常血管网病,是以双侧颈内动脉末端进行性狭窄或闭塞,颅底异常血管网形成为特征的一组脑血管病。目前烟雾病的治疗主要是内科对症治疗或外科手术治疗(直接或间接血运重建术)。内科治疗疗效不确切,外科手术治疗风险高、费用贵,且可能发生缺血再灌注损伤导致脑出血、脑水肿及短暂性脑缺血发作(transient ischemic attack, TIA)频繁发作等并发症出现。
肢体缺血预适应(limb ischemic preconditioning, LIPC)通过肢体反复短暂缺血,产生内源性保护机制,能够促使远隔组织耐受后续更长时间的缺血再灌注损伤,达到保护远隔重要脏器的目的[1]。本文通过正电子发射断层扫描(positron emission tomography, PET)和统计参数图(statistical parametric mapping, SPM)分析烟雾病患者LIPC治疗前后脑葡萄糖代谢的变化,从而评价LIPC对烟雾病的疗效。
1 资料与方法
1.1一般资料
连续收集2011年~2014年宣武医院神经外科门诊患者中经血管造影或MR血管成像(MRA)诊断为烟雾病[2-3]的患者62例(缺血型),其中儿童41例,成人21例。
纳入标准:①颈内动脉末端或大脑前动脉/大脑中动脉起始部狭窄或闭塞;②脑基底出现异常血管网;③双侧受累;④病因未明;⑤签署知情同意书。
排除标准:①由于动脉粥样硬化、自身免疫性疾病、脑膜炎、脑肿瘤、脑外伤、神经纤维瘤病、镰状细胞病、唐氏综合征、放射性损伤等原因导致继发性脑血管病变引起烟雾综合征;②脑出血。
根据随机数字表将患者纳入LIPC组和对照组,每组31例。
LIPC组中,儿童21例,成人10例;年龄3~75岁,平均16岁。对照组中,儿童20例,成人11例;年龄2~71岁,平均19岁。两组Suzuki分期[4]见表1。
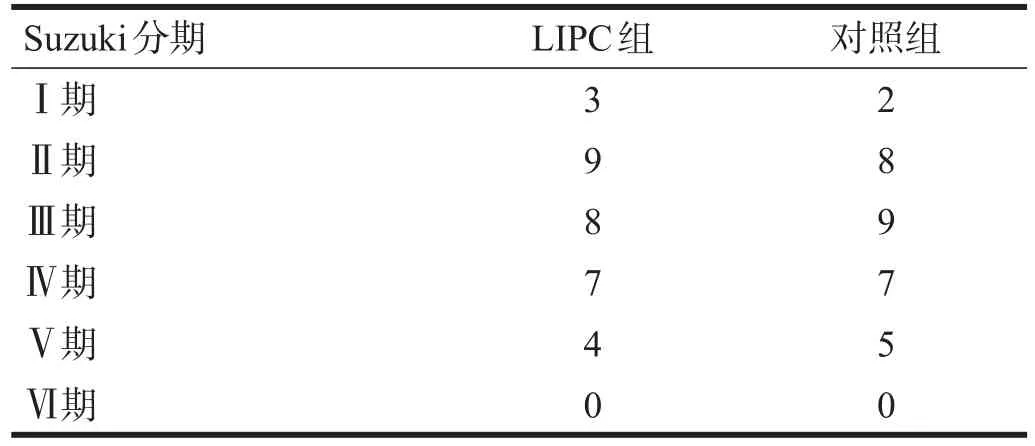
表1 两组Suzuki分期情况
1.2治疗方案
1.2.1对照组
予尼莫地平及对症治疗。尼莫地平用量:6~10岁每次10 mg,每天3次;10~18岁每次20 mg,每天3次;>18岁每次30 mg,每天3次。共30 d。
1.2.2LIPC组
在对照组基础上予LIPC。LIPC操作方法:单侧上肢上端用血压计袖带加压至200 mmHg,持续5 min,放气休息5 min,反复5轮,计为1次,每天2次。共6个月。
1.3显像方法
治疗前及治疗6个月后分别行18F-PET脑代谢显像。
采用ECAT 47 PET扫描仪,轴向视野16.2 cm,透射源68Ge。受检者禁食6 h以上,控制血糖至正常范围(4.44~6.67 mmol/L)。封闭视听30 min后肘静脉注射18F-FDG 5.55 MBq/kg。注射药物后安静休息,视听封闭,避免紧张体位,40 min后行脑3D静态采集,发射扫描采集计数9.6×107,透射扫描5 min。经计算机滤波反投影法进行图像重建,获得横断面、冠状面和矢状面断层影像。
所有患者或患者家属在检查前均签署知情同意书。
1.4数据处理
1.4.1比值分析法
由2名有经验的核医学医师通过目视法对患者治疗前后PET图像进行综合分析,连续2个或以上层面出现的放射性摄取减低或缺损视为异常。选择目视法观察到的患侧代谢减低部位,勾画感兴趣区(region of interest, ROI),采用镜像比值法计算病变区代谢减低率R,并计算治疗前后相同病变区R值的变化值P。

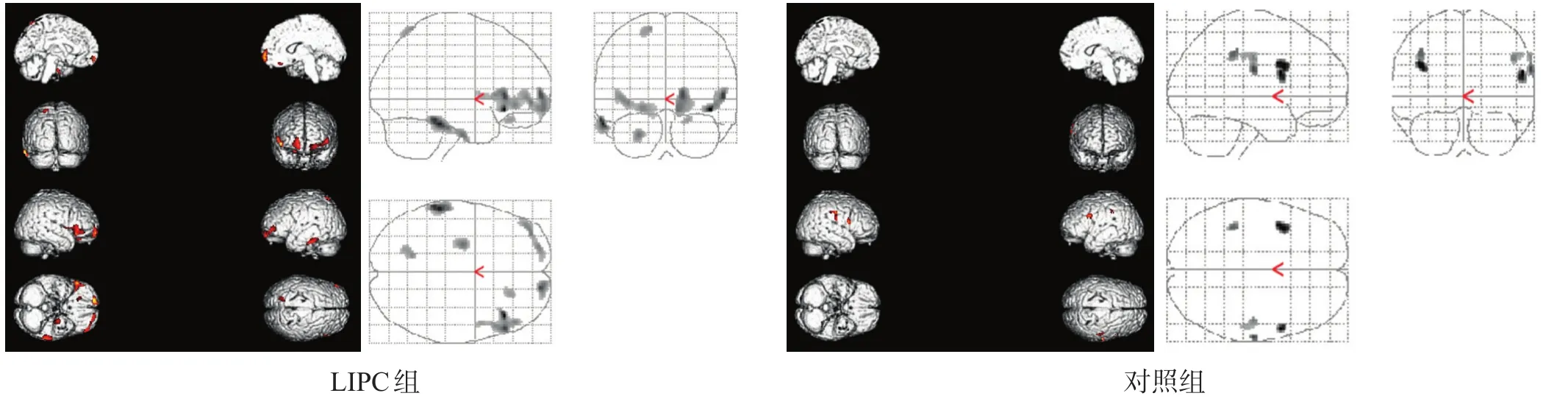
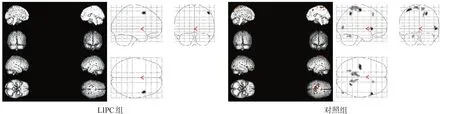
根据P值判断治疗前后代谢的变化:P≥10%,则判定治疗后代谢增加;-10% 治疗后代谢增加为好转,治疗后代谢减低为进展。 1.4.2SPM分析 在Matlab 6.5平台上,应用SPM2软件对PET原始图像每一像素数据进行分析。先对大脑图像进行标准化处理,采用线性仿射变换和非线性变换法将不同受试者PET脑图像统一投射到标准脑模板上,并将标准脑内各部位像素点对应至Talairach标准脑图谱。用9×9×9 mm高斯滤波进行平滑处理。 参数估计选用治疗前后配对t检验,以治疗前为基础,分别设定治疗后为代谢增高和代谢减低即可得到治疗后好转和进展的代谢激活区。设显著性水平α= 0.001,有差异体素阈值30个体素,即连续有显著性差异的体素达到30个以上,考虑该区域葡萄糖代谢有差异。将所得到的代谢激活区投射到三方位立体脑图像上,根据Talariach坐标值确定具体部位,KE值代表激活区范围的大小。 1.5统计学分析 应用SPSS 17.0统计软件对比值法分析结果进行χ2检验,显著性水平α=0.05。 2.1比值法 治疗后LIPC组好转23例,明显优于对照组11例,进展6例,显著低于对照组20例(χ2=12.983, P< 0.001)。 2.2SPM 2.2.1设治疗后代谢增加 LIPC组治疗前后配对t检验得到7个有显著性差异的代谢激活区,主要位于额叶、颞叶、顶叶,总KE=1121;对照组得到5个有显著性差异的代谢激活区,主要位于额叶、顶叶,总KE=292。见图1。 图1 设治疗后代谢增加激活区 2.2.2设治疗后代谢减低 LIPC组治疗前后配对t检验得到1个有显著性差异的代谢激活区,位于额叶,总KE=62;对照组得到8个有显著性差异的代谢激活区,包括额叶、顶叶和枕叶,总KE=629。见图2。 图2 设治疗后代谢减低激活区 烟雾病是以双侧颈内动脉末端进行性狭窄或闭塞,颅底异常血管网形成为特征的一组脑血管病。其病因及发病机制尚不明确,主要分布在日本和东南亚地区,以日本为主。随着影像医学的发展,我国烟雾病的检出率也有所上升。 烟雾病分为缺血型和出血型两种类型。传统的观点认为,儿童以缺血型为主,成人以出血型为主;但随着无创诊断技术,包括磁共振血管成像和经颅多普勒超声的应用,越来越多症状较轻或无症状患者得到诊断,使缺血型发病比例增加,尤其是成年人烟雾病患者中缺血型发病比例明显增加。国内的两项研究发现,无论儿童还是成人,烟雾病都以缺血型为主[5-6]。 缺血预适应(ischemic preconditioning, IPC)自1986 年Murry等首次提出[7],其应用范围、实施时间和实施方式不断被改进。研究显示,远隔缺血期适应能够减少心、脑、肾、肝、胃、肺和骨骼肌肉等脏器的缺血再灌注损伤[8-9]。 LIPC是一项用血压计袖带短时间反复多次压迫肢体形成的无创性远隔缺血预适应,操作简单易行,且无创、安全、成本低廉。LIPC对远隔脏器的具体保护机制目前尚不清楚,一种理论认为可能与LIPC产生的腺苷、缓激肽等体液物质释放到血液循环有关,其他体液因素还包括促红细胞生成素、K+-ATP通道的激活、氧化氮、阿片肽和自由基等[10-14];另一种理论认为,LIPC对远隔脏器的保护作用是神经、体液、免疫等多种机制共同参与的复杂过程[15-17]。 不管机制如何,通过肢体反复短暂性缺血,能促使远隔组织耐受后续更长时间的缺血再灌注损伤,这种保护性作用已经被大家认同[18-24]。 我们之前采用PET和SPM评价LIPC治疗缺血性脑卒中的疗效[25]。本研究通过对比分析烟雾病患者LIPC后脑葡萄糖代谢的变化,发现LIPC治疗后,烟雾病患者的脑葡萄糖代谢减低区范围缩小,代谢增高的区域扩大,说明LIPC治疗烟雾病有较好的临床效果,PET和SPM能够为临床评价LIPC对烟雾病的疗效提供客观的影像学依据。 目前还缺乏具有临床终点事件的长期研究以及LIPC长期应用后不良反应的研究;患者的年龄、服用药物、并发症是否对LIPC产生影响尚无定论。需要更多临床研究从多种角度、采用多种方法研究LIPC的安全、有效性。 SPM是由英国Hammersmith医院的Friston等学者在Matlab平台上开发的软件系统[26-27]。SPM中设有多种统计学方法,研究者可以根据自己的研究目的选择合适的统计学方法,建立数学模型进行统计分析,最后输出结果。SPM以像素为基本研究单位,直接对原始数据进行统计分析[28],具有客观、精确、可重复性强等优点。SPM不仅能发现治疗前后的总体变化趋势,而且可以通过KE值对代谢激活区的范围进行量化,通过T值对代谢激活区的程度进行量化,并可通过坐标值对代谢激活区进行准确定位。目前,SPM已成为国际上应用最普遍的脑功能成像处理分析软件[29-30],成为神经影像学临床和科研的“金标准”之一。 本研究通过SPM配对t检验对烟雾病患者治疗前后脑葡萄糖代谢变化进行整组分析,揭示了治疗前后的总体变化趋势。但对每例患者治疗前后的代谢情况则通过比值法分别进行分析比较。鉴于比值法主观性强,可重复性差,将在今后的研究中启用SPM个体分析[31]。 由于老化的影响,正常人脑葡萄糖代谢随年龄增长会出现不同程度的减低,减低的程度和范围与年龄呈正相关[32]。因此SPM个体分析的关键是要建立与受检者年龄匹配的正常对照组。本PET中心已积攒了21~87岁正常成人的数据,但是缺少其他年龄段正常人群的数据,今后会注意积攒。由于PET检查需使用放射性药物,正常儿童行PET脑扫描的可能性较小,目前国外对于如何建立可应用于儿童的正常对照组数据正在进一步研究中[33]。在今后研究中,对于年龄在21~87岁范围内,已有该年龄段正常人群的患者,我们可以使用SPM进行个体分析,为临床提供更准确可靠的数据。 [参考文献] [1] Botker HE, Kharbanda R, Schmidt MR, et al. Remote schaemic conditioning before hospital admission, as a complement to angioplasty, and effect on myocardial salvage in patients with acute myocardial infarction: a randomised trial [J]. Lancet, 2010, 375(9716): 727-734. [2] Research Committee on the Pathology and Treatment of Spontaneous occlusion of the Circle of Willis, Health Labour Sciences Research Grant for Research on Measures for Infractable Diseases. Guidelines for Diagnosis and Treatment of Moyamoya Disease (spontaneous occlusion of the circle of Willis) [J]. Neurol Med Chir (Tokyo), 2012, 52(5): 245-266. [3] Fujimura M, Tominaga T. Diagnosis of moyamoya disease: international standard and regional differences [J]. Neurol Med Chir (Tokyo), 2015, 55(3): 189-193. [4] Suzuki J, Takaku A. Cerebrovascular "moyamoya" disease. Disease showing abnormal net-like vessels in base of brain [J]. Arch Neurol, 1969, 20(3): 288-299. [5]高山,倪俊,黄家星,等.烟雾病临床特点分析[J].中华神经科杂志, 2006, 39(3): 176-179. [6]段炼,孙伟建,王芙昱,等.国人烟雾病临床特征探讨[J].中华神经外科志, 2005, 10(4): 269-271. [7] Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium [J]. Circulation, 1986, 74(5): 1124-1136. [8] Koch S, Gonzalez N. Preconditioning the human brain: proving the principle in subarachnoid hemorrhage [J]. Stroke, 2013, 44 (6): 1748-1753. [9] Kanoria S, Jalan R, Seifalian AM, et al. Protocols and mechanisms for remote ischemic preconditioning: a novel method for reducing ischemia reperfusion injury [J]. Transplantation, 2007, 84(4): 445-458. [10] Joung KW, Rhim JH, Chin JH, et al. Effect of remote ischemic preconditioning on cognitive function after off-pump coronary artery bypass graft: a pilot study [J]. Korean J Anesthesiol, 2013, 65(5): 418-424. [11] Sharma V, Cunniffe B, Verma AP, et al. Characterization ofacute ischemia-related physiological responses associated with remote ischemic preconditioning: a randomized controlled, crossover human study [J]. Physiol Rep, 2014, 2(11): e12200. [12] Hu S, Dong H, Zhang H, et al. Noninvasive limb remote ischemic preconditioning contributes neuroprotective effects via activation of adenosine A1 receptor and redox status after transient focal cerebral ischemia in rats [J]. Brain Res, 2012, 1459: 81-90. [13] Diwan V, Kant R, Jaggi AS, et al. Signal mechanism activated by erythropoietin preconditioning and remote renal preconditioning-induced cardioprotection [J]. Mol Cell Biochem, 2008, 315(1-2): 195-201. [14] Weinbrenner C, Schulze F, Sàrvàry L, et al. Remote preconditioning by infrarenal aortic occlusion is operative via delta 1-opioid receptors and free radicals in vivo in the rat heart [J]. Cardiovasc Res, 2004, 61(3): 591-599. [15] Jensen RV, Stottrup NB, Kristiansen SB, et al. Release of a humoral circulating cardioprotective factor by remote ischemic preconditioning is dependent on preserved neural pathways in diabetic patients [J]. Basic Res Cardiol, 2012, 107(5): 285. [16] Mastitskaya S, Marina N, Gourine A, et al. Cardioprotection evoked by remote ischaemic preconditioning is critically dependent on the activity of vagal pre-ganglionic neurones [J]. Cardiovasc Res, 2012, 95(4): 487-494. [17] Merlocco AC, Redington KL, Disenhouse T, et al. Transcutaneous electrical nerve stimulation as a novel method of remote preconditioning: in vitro validation in an animal model and first human observations [J]. Basic Res Cardiol, 2014, 109(3): 406. [18] Berger MM, Köhne H, Hotz L, et al. Remote ischemic preconditioning delays the onset of acute mountain sickness in normobaric hypoxia [J]. Physiol Rep, 2015, 3(3): e12325. [19] Hepponstall M, Ignjatovic V, Binos S, et al. Remote ischemic preconditioning (RIPC) modifies the plasma proteome in children undergoing repair of tetralogy of Fallot: a randomized controlled trial [J]. PLoS One, 2015, 10(3): e0122778. [20] Ropcke D, Hjortdal V, Toft G, et al. Remote ischemic preconditioning reduces thrombus formation in the rat [J]. Thromb Haemost, 2012, 10(11): 2405-2406. [21] Hu X, Lu Y, Zhang Y, et al. Remote ischemic preconditioning improves spatial learning and memory ability after focal cerebral ischemia- reperfusion in rats [J]. Perfusion, 2013, 28(6): 546-551. [22] Connolly M, Bilgin-Freiert A , Ellingson B, et al. Peripheral vascular disease as remote ischemic preconditioning for acute stroke [J]. Clin Neurol Neurosurg, 2013, 115(10): 2124-2129. [23] Zhou Y, Fathali N, Lekic T, et al. Remote limb ischemic postconditioning protectsagainst neonatal hypoxic- isehemic brain injury in ratpups bytheopioid receptor/Akt pathway [J]. Stroke, 2011, 42(2): 439-444. [24] Ren C, Gao M, Dornbos D 3rd, et al. Remote ischemic post-conditioning reduced brain damage in experimental ischemia/reperfusion injury [J]. Neurol Res, 2011, 33(5): 514-519. [25]苏玉盛,马云川,王曼,等.利用18F标记脱氧葡萄糖正电子发射断层评价肢体缺血预适应的疗效[J].中国康复理论与实践, 2013, 19(3): 217-222. [26] Friston KJ, Frith CD, Liddle PF, et al. Comparing functional (PET) images: the assessment of significant change [J]. Cereb Blood Flow Metab, 1991, 11(4): 690-699. [27] Acton PD, Friston KJ. Statistical parametric mapping in functional neuroimaging: beyond PET and fMRI activation studies [J]. Eur J Nucl Med, 1998, 25(7): 663-667. [28] Kurth F, Gaser C, Luders E. A 12-step user guide for analyzing voxel-wise gray matter asymmetries in statistical parametric mapping (SPM) [J]. Nat Protoc, 2015, 10(2): 293-304. [29]骆姚星,唐一源,伍建林,等.脑功能成像分析软件SPM使用介绍[J].中国医学影像技术, 2003, 19(7): 926-928. [30] Kim IJ, Kim SJ, Kim YK. Age- and sex-associated changes in cerebral glucose metabolism in normal healthy subjects: statistical parametric mapping analysis of F-18 fluorodeoxyglucose brain positron emission tomography [J]. Acta Radiol, 2009, 50 (10): 1169-1174. [31] Signorini M, Paulesu E, Friston K, et al. Rapid assessment of regional cerebral metabolic abnormalities in single subjects with quantitative and nonquantitative [18F] FDG PET: a clinical validation of statistical parametric mapping [J]. NeuroImage, 1999, 9(1): 63-80. [32]苏玉盛,马云川,王红艳,等.正常脑老化进程中脑局部葡萄糖代谢减低的规律[J]. CT理论与应用研究, 2009, 18(4): 75-83. [33] Archambaud F, Bouilleret V, Hertz-Pannier L, et al. Optimizing statistical parametric mapping analysis of 18F-FDG PET in children [J]. EJNMMI Res, 2013, 3(1): 2. ·临床研究· Effects of Limb Ischemic Preconditioning on Brain Metabolism of Ischemic Moyamoya Disease: A Positron Emission Tomography and Statistical Parametric Mapping Study SU Yu-sheng, MA Yun-chuan, WANG Man, ZHANG Lin-ying Abstract:Objective To observe the brain glucose metabolism after limb ischemic preconditioning (LIPC) for ischemic moyamoya disease with positron emission tomography (PET) and statistical parametric mapping (SPM). Methods 62 patients with ischemic moyamoya disease were enrolled and randomized into LIPC group (n=31) and control group (n=31). The glucose metabolism of patients was analyzed with PET before and after treatment in both groups, using the methods of radioactivity ratio and SPM. Results The glucose metabolism ratio improved more in the LIPC group than in the control group (P<0.01), and aggravated less than in the control group (P<0.001). As setting the glucose metabolism increased after treatment, there were 7 areas activated in LIPC group, including frontal, temporal and parietal lobes, and the KE=1121; while there were 5 areas activated in the control group, including frontal and parietal lobes, and the KE=292. As setting the glucose metabolism decreased after treatment, there was only frontal area activated in LIPC group, while there were 8 areas activated in the control group, including frontal, parietal, occipital lobes, and the KE=629. Conclusion LIPC may improve the brain glucose metabolism in patients with moyamoya disease, which can be observed with PET and SPM. Key words:moyamoya disease; limb ischemic preconditioning; positron emission tomography; brain glucose metabolism; statistical parametric mapping (收稿日期:2015-05-14修回日期:2015-06-27) 作者简介:作者单位:首都医科大学宣武医院核医学科,北京市100053。苏玉盛(1972-),男,北京市人,硕士,副主任医师,主要研究方向:PET的临床应用。 DOI:10.3969/j.issn.1006-9771.2015.09.017 [中图分类号]R743.4 [文献标识码]A [文章编号]1006-9771(2015)09-1064-052 结果
3 讨论
Department of Nuclear Medicine, Xuanwu Hospital, Capital Medical University, Beijing 100053, China

