RASSF1A Ala133Ser单核苷酸多态性与中国北方汉族结直肠癌的关联研究
冯凯,路浩军,贾海英,郑燕华,张军,景青萍,吴继华
无论在全球还是我国,结直肠癌(co lo recta l cancer,CRC)都是发生率与病死率最高的肿瘤之一[1],男性较女性多发,且随年龄增加发病率逐渐增高。结直肠癌是基因与环境相互作用的结果,有家族倾向,但多为散发病例,并与生活方式密切相关[2-4]。
Ras相关区域家族1A(Ras association dom ain fam ily 1A gene,RASSF1A)是一个抑癌基因[5-7],具有调节细胞周期、控制细胞凋亡、调节微管稳定性、抑制炎症等多种生理功能[8-11],其表达水平及功能发挥与肿瘤的发生、发展有密切关系[12-14]。很多实体瘤中都检测到启动子区超甲基化导致的RASSF1A基因失活[15-17],结直肠癌RASSF1A超甲基化率为31%[18]。但近来研究显示,RASSF1A基因遗传变异也能导致肿瘤发生[19]。RASSF1A基因较为保守,仅在肿瘤细胞中发现一些突变,单核苷酸多态性(SNP)数量少,其中以外显子3G/T多态性导致编码第133位氨基酸的密码子发生非同义突变(Ala/Se r)的研究最多,目前已 有针对不同肿瘤与RASSF1A Ala133Ser基因多态性遗传易感性的多项研究,包括肺腺癌、乳腺癌、肝癌、结直肠癌、头颈癌、食道癌、胃癌、肾癌、前列腺癌等[20-25],但结果并不一致,有Meta分析结果显示,除与肺癌的易感性相关较为明确外,其他肿瘤结果由于种族和样本量等原因,还需要进一步确认[26]。目前结直肠癌与RASSF1A Ala133Ser关系的研究只有一篇日本人群的小样本报道[20],中国人群尚无报道,人类单体型计划(in ternational hapMap p ro ject)数据库显示RASSF1A Ala133Ser SNP在欧洲、日本、中国汉族、非洲人群中的最小等位基因频率分布存在差异(从0.173至0.009),本研究拟以中国北方汉族人群为对象,探讨RASSF1A Ala133Ser SNP与结直肠癌易感性的关系。
1 资料与方法
1.1 研究对象 本研究共收集176例北方汉族结直肠癌患者,包括109例结肠癌(男61例,女48例,年龄64.6±14.1岁)及67 例直肠癌(男39例,女28例,年龄67.0±11.9岁),所有病例均来自2011年10月-2013年7月解放军306医院普通外科和肿瘤科收治的手术或化疗结直肠癌患者,病理组织类型均为原发腺癌,排除了转移癌和其他类型肿瘤患者;189例与病例组年龄性别比例接近的北方汉族正常对照,随机选自在解放军306医院进行健康体检的人员,为排除遗传分层因素,所有入选者均经详细问卷调查,以查明其疾病史并排除有肿瘤病史者。样本采用EDTA-K2抗凝血。本研究经解放军306医院伦理委员会批准。
1.2 研究方法
1.2.1 血细胞DNA提取 采用酚-氯仿法从结直肠癌患者及正常人外周血白细胞抽提基因组DNA,溶解于TE缓冲液,–80℃保存备用。
1.2.2 降落式聚合酶链反应 参考序列(ch r3: 50,364, 001-50, 378, 500),版本号GRCh37/hg19,采用在线Prim er 3软件(http://prim er3.ut.ee/)进行引物设计。P1引物5'-AAGGCAGTCAGTTTCCAAAGACT-3',P2引物5'-ATGAAGAGGTTGCTGTTGATCTG-3'。PCR试剂均购自TaKaRa公司,采用GeneAm p PCR System 9700型(美国PE应用生物系统公司)基因扩增仪进行PCR扩增。反应体系25μl:20ng基因组DNA,10mm o l/L dNTP,10×缓冲液、引物各5pm o l,Ex Taq DNA聚合酶1U。反应条件:94℃ 5m in;94℃30s,64℃(–0.3℃/循环)30s,72℃ 30s,16个循环;94℃ 30s,56℃ 40s,72℃ 40s,20个循环;最后72℃10m in。产物保存于4℃。
1.2.3 基因型分析 取PCR反应产物10μl进行限制性内切酶AluⅠ酶切,酶切产物行2%琼脂糖凝胶电泳。以Cham pGel全自动凝胶成像分析仪(北京赛智创业科技有限公司)观察记录电泳结果。
1.2.4 结果验证 Ala/Ser基因型和Ser/Ser基因型均进行两次以上重复分型,对Ser/Ser基因型样本PCR产物进行测序(北京三博远志生物工程公司)证实。
1.2.5 RASSF1A蛋白序列保守性分析 利用Clustlw程序(h ttp://w ww.eb i.ac.uk/Too ls/m sa/c lusta lw 2/)对大鼠、小鼠、犬、类人猿、猕猴、人类的RASSF1A蛋白序列进行比对,蛋白序列检索自NCB I的蛋白数据库,序列号分别为XP_850255(Canis fam iliaris,犬),XP_001168270(Pan trog lod y tes,类人猿),NP_001032644(Ra ttus norvegicus,大鼠),AAK21200(Mus m uscu lus,小鼠),XP_001100583(Macaca m u latta,猕猴),NP_009113(Hom o sapiens,人类)。
1.3 统计学处理 采用Fisher精确检验对对照组人群各基因型分布是否符合Hardy-Weinberg平衡进行分析,以判断所选人群是否存在基因型或等位基因的分布偏差,从而确定其对整体人群的代表性。基因-疾病关联分析采用非条 件log istic回归模型,计算共显性、显性、隐性、超显性遗传模式下的比数比(odds ratio,OR)及95%可信区间(con fiden tial in tervals,CI),并采用log istic回归模型进行基因-性别交互作用分析。所有统计均采用SNPsta ts[27]在线关联研究工具(http://bioin fo.iconco logia.net/SNPstats)进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般特征 结直肠癌组、结肠癌亚组、直肠癌亚组与对照组之间性别、年龄构成相似(P>0.05)。所有标本均成功进行了基因型分型(图1),所有重复分型结果均与原结果相符。经χ2检验,健康对照组RASSF1A Ala133Ser基因型分布符合Hardy-Weinberg平衡(P=0.75)。
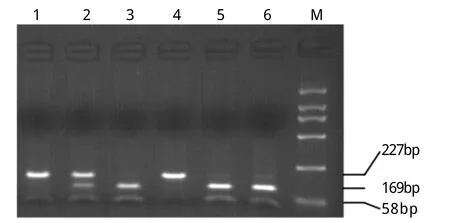
图1 RASSFA1 Ala133Ser 多态性分析Fig. 1 Po lym o rphism analysis o f RASSFA1 Ala133SerM. DL2000 DNA ladder; Lane 1 and 4. Ser/Serhom ozygous(227bp); Lane 2. Ala/Ser heterozygous (227bp, 169bp and 58bp);Lane 3 5, 6. Ala/Ala hom ozygous (169bp and 58bp)
2.2 RASSF1A Ala133Ser SNP与结直肠癌组及结、直肠癌亚组的关联研究 校正年龄、性别因素后,RASSF1A Ala133Ser SN P的Ala/Al a、Ala/Ser和Ser/Ser基因型频率在结直肠癌组与对照组之间,于各种遗传模式下差异无统计学意义(表1)。将结肠癌和直肠癌患者分成两个亚组分别与对照组进行关联分析,在四种遗传模式下差异也无统计学意义(数据未列出)。

表1 RASSF1A Ala133Ser 单核苷酸多态性与结直肠癌的关联分析(n=365)Tab. 1 Association analysis of RASSF1A Ala133Ser SNP and co lo rectal can cer (CRC) (n=365)
2.3 RASSF1A Ala133Se r SNP在结直肠癌及结、直肠癌亚组中的基因-性别交互作用 结直 肠癌及其亚组RASSF1A Ala133Ser SNP与性别存在交互作用,采用log istic回归检测显示,显性遗传C模式下,结直肠癌RASSF1A Ala133Ser SNP和性别存在交互作用,携带Ser等位基因(Ala/Ser+Ser/Ser)的女性患结直肠癌的比例比不携带 Ser等位基因的女性高(OR=3.01,95%CI 1.31~6.94,P<0.05,表2),在其他三种遗传模式下未观察到交互作用(数据未提供)。为了观察这种交互作用是否与结直肠癌亚型有关,分别进行了结、直肠癌亚组中的基因-性别交互分析,结果显示,显性遗传模式下,RASSF1A Ala133Ser SNP与性别的交互作用主要体现在直肠癌亚组(OR=3.78,95%CI 1.31~10.89,P<0.05,表3),而结肠癌组没有显著交互作用(表4),即其他条件相同的情况下携带Ser等位基因的女性更易发生直肠癌。以上分析均校正了年龄因素。
2.4 RASSF1A蛋白序列保守性分析 RASSF1A是重要的抑癌基因,突变或失活常导致肿瘤发生,特别是关键的功能区,在进化过程中应相对稳定,RASSF1A结构注释显示,其蛋白第131位为ATM酶磷酸化位点,131-134为ATM/ATR磷酸化酶识别位区。我们比对了人、犬、小鼠、大鼠、猕猴、类人猿的RASSF1A蛋白参考序列,133位均为Ala,进一步提示了该位点功能的重要性(图2)。

表2 Log istic回归分析结直肠癌基因和性别的交互作用(n=365)Tab. 2 Interaction analysis of gene-sex involved in colorectal cancer (CRC), by log istic reg ression (n=365)

表3 Log istic回归分析直肠癌基因和性别的交互作用(n=256)Tab. 3 Interaction analysis of gene-sex invo lved in rectal cancer, by log istic reg ression (n=256)
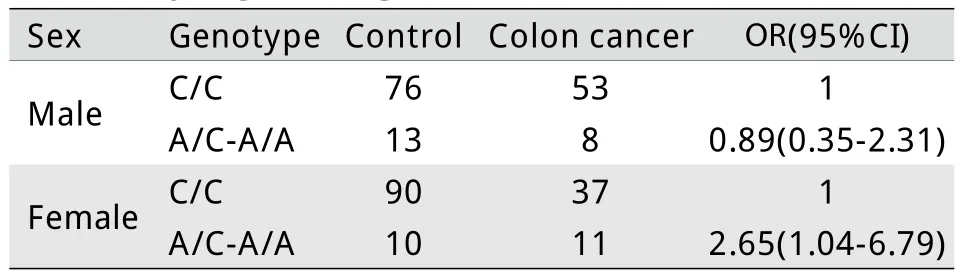
表4 Log istic回归分析结肠癌基因和性别的交互作用(n=298)Tab. 4 Interaction analysis of gene-sex invo lved in co lon can cer, by log istic reg ression (n=298)
3 讨 论
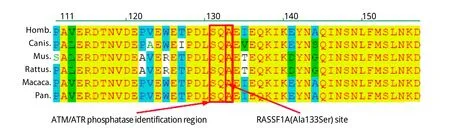
图2 不同物种RASSFA1蛋白序列比对Fig. 2 Sequences align fo r RASSFA1 p ro tein from six speciesHomo. Homo sa piens; Canis. Canis fam iliaris; Pan. Pan troglodytes; Rattus. Rattus norvegicus; Mus. Mus musculus; Macaca. Macaca mulatta; 131-134. Iden tification region of ATM/ATR phosphatase; 131. Phospho rylation site of ATM/ATR phosphatase
本研究中,RA SSF1A Ala133Ser 基因型在结直肠癌及其亚组患者中的分布与正常对照相比,其差异无统计学意义,提示Ser/Ala与Se r/Ser基因型并没有显著增加结直肠癌的发 生危险。但是,本研究在全部对照样本中只发现1例Ser/Ser纯合子,这与Hapm ap数据库提供的中国汉族人群分布频率相吻合,但在肿瘤患者中共发现4例纯合子,表现出Ser/Ser肿瘤高发的倾向,并且杂合子比例也有所增高(15.3%/11.6%),但差异无统计学意义,可能与样本量有限有关。
本研究发现RASSF1A Ala133Ser SNP与性别存在交互作用,女性携带Ser等位基因可增加患直肠癌的风险。一般研究都将结肠癌、直肠癌归为一类统称结直肠癌或大肠癌,但是这两 种肿瘤发生机制可能存在差异[28]。流行病学调查显示,结肠癌与直肠癌饮食上的风险因子不同[29]。最近Nature发表的一项研究显示,结肠癌与直肠癌有不少方面是一致的,如基因表达谱、DNA甲基化、拷贝数变化、m iroRNA变化,但二者仍然存在某些重要差别,特别是右结肠,好发由超甲基化、超突变引发的癌变[30]。另外,虽然CEA是结直肠癌早期诊断和复发的分子标记,但在结肠癌与直肠癌的表达水平明显不同[31]。目前,这方面的研究仍十分有限。本研究显示,抑癌基因RASSF1A 133Ser等位基因对于女性是一个较高的风险因素,其机制有待进一步探讨。
RASSF1A 133Ser增加肿瘤易感性,可能存在多种机制。RASSF1A蛋白可与微管结合,是调节有丝分裂[32]、防止高尔基体断裂、保持细胞极性的关键骨架蛋白[33],133Ser多态性导致RASSF1A微管结合能力下降,不能与α和γ微管结合,只能与β微管结合,这样就降低了微管的稳定性,利于肿瘤的形成[34]。
RASSF1A蛋白参与细胞周期的调节,其机制是抑制cyclin D1控制G1/S期的转换。Shivakum ar等[8]报道RASSF1A蛋白的活化依赖磷酸化,RASSF1A Ala133Ser SNP则会对其磷酸化过程产生影响,与野生型133Ala相比,RASSF1A 133Ser变体没有抗细胞增殖活性,因此133Ser可能导致细胞循环控制受损。分析表明,RASSF1A的133Ala位于ATM/ATR家族S er/th reonine激酶识别位点“SQA”的区域,为磷酸位点识别所必需[35],该位点在不同种属的哺乳动物中非常保守,本研究比较了大鼠、小鼠、犬、类人猿、猕猴和人类的RASSF1A蛋白序列,发现该位点均为Ala,进一步从进化角度证明了该位点的重要性。同时S131的磷酸化与DNA的损伤修复有关[36],133Ser破坏了这一功能[37]。
近来已有研究证实RASSF1A Ala133Ser SNP与肿瘤特别是肺腺癌的发生有关。本研究结果显示RASSF1A Ala133Ser SNP与性别在直肠癌中存在交互作用,虽然样本量较少,但为后续研究提供了重要线索。
[1] C unningham D, Atkin W, Lenz HJ, et al. Co lo rectal cancer[J].Lancet, 2010, 375(9719): 1030-1047.
[2] Bine fa G, Rod riguez-Mo ran ta F, Teu le A, et al. Co lo rectal cancer: from p revention to personalized m ed icine[J]. World J Gastroen tero l, 2014, 20(22): 6786-6808.
[3] Brenner H, Kloor M and Pox CP. Co lorectal cancer[J]. Lancet,2014, 383(9927): 1490-1502.
[4] Xin L, Bai Y, Li ZS. Advances in colorectal cancer risk factors[J].Chin J Pract Intern Med, 2014, 34(12): 1214-1218. [辛磊, 柏愚,李兆申. 结直肠癌危险因素研究进展[J]. 中国实用内科杂志, 2014, 34(12): 1214-1218.]
[5] Damm ann R, Li C, Yoon JH, et al. Epigenetic inactivation of a RAS association dom ain fam ily p rotein from the lung tum our supp ressor locus 3p21.3[J]. Nat Genet, 2000, 25(3): 315-319.
[6] Agathanggelou A, Honorio S, Macartney DP, et al. Methylation associated inactivation of RASSF1A from region 3p21.3 in lung,breast and ovarian tum ours[J]. Oncogene, 2001, 20(12): 1509-1518.
[7] Donn inge r H, Vos MD, Clark GJ. The RASSF1A tum o r supp resso r[J]. J Ce ll Sci, 2007, 120(Pt 18): 3163-3172.
[8] Shivakum ar L, M inna J, Sakam aki T, et al. The RASSF1A tum or supp ressor b locks cell cycle p rogression and inhibits cyclin D1 accum u lation[J]. Mo l Cell Bio l, 2002, 22(12): 4309-4318.
[9] Oh HJ, Lee KK, Song SJ, et al. Ro le of the tum or supp ressor RASSF1A in Mst1-m ediated apop tosis[J]. Cancer Res, 2006,66(5): 2562-2569.
[10] Rong R, Jin W, Zhang J, et al. Tum or supp ressor RASSF1A is a m icrotubu le-binding p rotein that stabilizes m icrotubu les and induces G2/M arrest[J]. Oncogene, 2004, 23(50): 8216-8230.
[11] Go rdon M, El-Kalla M, Zhao Y, et al. The Tum or Supp resso r gene, RASSF1A, is essential for p rotection against in flamm ation-induced in ju ry[J]. PLoS One, 2013, 8(10): e75483.
[12] Agathangge lou A, Cooper WN, Latif F. Ro le of the Rasassociation dom ain fam ily 1 tum or supp ressor gene in hum an cancers[J]. Cancer Res, 2005, 65(9): 3497-3508.
[13] Chen YH, Lan ZP, Hui QY, et al. Exp ression and significance of RASSF1A and p53 p rotein in gastric m ucosal lesions[J]. Med J Ch in PLA, 2012, 37(6): 664-665. [陈雅慧, 兰忠平, 惠起源,等. RASSF1A及p53蛋白在胃黏膜病变中的表达及意义[J].解放军医学杂志, 2012, 37(6): 664-665.]
[14] Wang W, Duan XR, Tan SJ, et al. Estab lishm ent of neural network m odel of lung cancer screening based on three gene prom oter m ethylation com bined with telom ere length[J]. J Zhengzhou Univ (Med Sci), 2014, 49(2): 176-179. [王威, 段晓冉, 谭善娟,等. 基于3种基因启动子甲基化联合端粒长度构建肺癌筛查神经网络模型[J]. 郑州大学学报(医学版), 2014, 49(2): 176-179.]
[15] Byun DS, Lee MG, Chae KS, et al. Frequen t ep igenetic inac tiva tion of RASSF1A b y ab e rran t p rom o te r hyperm ethylation in hum an gastric adenocarcinom a[J]. Cancer Res, 2001, 61(19): 7034-7038.
[16] Damm ann R, Yang G, Pfeifer GP. Hyperm ethylation of the cpG island of Ras association dom ain fam ily 1A (RASSF1A), a putative tum or suppressor gene from the 3p21.3 locus, occurs in a large percentage of hum an breast cancers[J]. Cancer Res, 2001,61(7): 3105-3109.
[17] Liu L, Yoon JH, Damm ann R, et al. Frequent hyperm ethylation of the RASSF1A gene in p rostate cancer[J]. Oncogene, 2002,21(44): 6835-6840.
[18] Ah lquist T, Bo ttillo I, Dan ielsen SA, et al. RAS signaling in co lo rectal carcinom as th rough alteration of RAS, RAF, NF1,and/o r RASSF1A[J]. Neop lasia, 2008, 10(7): 680-686.
[19] Go rdon M, El-Kalla M, Baksh S. RASSF1 po lym o rph ism s in cancer[J]. Mo l Bio l In t, 2012, 2012: 365213.
[20] Kanzaki H, Hanafusa H, Yam am oto H, et al. Sing le nucleotide polym orphism at codon 133 of the RASSF1 gene is preferentially associated with hum an lung adenocarcinom a risk[J]. Cancer Lett, 2006, 238(1): 128-134.
[21] Shaqdarsurenqin U, Seidel C, Ulbrich EJ, et al. A polym orphism at codon 133 of the tum or supp ressor RASS1A is associatedwith tum orous alteration of the b reast[J]. Int J Oncol, 2005, 27(1):185-191.
[22] Bayram S. RASSF1A Ala133Ser polym orphism is associated with increased suscep tibility to hepatocellular carcinom a in a Turkish popu lation[J]. Gene, 2012, 498(2): 264-269.
[23] Zhou SL, Cui J, Fan ZM, et al. Po lym o rphism of A133S and p rom oter hyperm ethylation in Ras association dom ain fam ily 1A gene (RASSF1A) is associated with risk of esophageal and gastric cardia cancers in Chinese population from high incidence area in no rthern Ch ina[J]. BMC Cancer, 2013, 13: 259.
[24] Kaw ai Y, Sakano S, Okayam a N, et al. Association of RASSF1A genotype and haplotype with the p rogression of clear cell renal cell carcinom a in Japanese patients[J]. BJU In t, 2012, 110(7):1070-1075.
[25] Meyer A, Co inac I, Bogdanova N, et al. Apop tosis gene po lym orphism s and risk of p rostate cancer: a hospital-based study of Germ an patients treated with brachytherapy[J]. Urol Onco l, 2013, 31(1): 74-81.
[26] Bay ram S. Asso ciation betw een RASSF1A A la133Se r po lym orphism and cancer suscep tibility: a m eta-analysis invo lving 8,892 sub jects[J]. Asian Pac J Cancer Prev, 2014,15(8): 3691-3698.
[27] So le X, Guino E, Valls J, et al. SNPStats: a w eb too l fo r the analysis of association studies[J]. Bioin form atics, 2006, 22(15):1928-1929.
[28] Li JN, Zhao L, Wu J, et al. Differences in gene exp ression p rofiles and carcinogenesis pathways between colon and rectal cancer[J].J Dig Dis, 2012, 13(1): 24-32.
[29] Wakai K, Hirose K, Matsuo K, et al. Dietary risk facto rs fo r co lon and rectal cancers: a com parative case-contro l study[J]. J Ep idem io l, 2006, 16(3): 125-135.
[30] Cancer Genom e Atlas Netw ork. Com p rehensive m o lecu lar characterization of hum an co lon and rectal cancer[J]. Nature,2012, 487(7407): 330-337.
[31] Ding Y, Xuan W, Chen C, et al. Differences in carcinoem b ryonic an tigen levels betw een co lon and rectal cancer[J]. Mo l Clin Onco l, 2014, 2(4): 618-622.
[32] Song MS, Song SJ, Ayad NG, et al. The tum ou r supp resso r RASSF1A regu lates m itosis by inhib iting the APC-Cd c20 com p lex[J]. Nat Ce ll Bio l, 2004, 6(2): 129-137.
[33] Arnette C, Efim ova N, Zhu X, et al. M icro tubu le segm en t stabilization by RASSF1A is required for p roper m icrotubu le dynam ics and Go lgi integ rity[J]. Mo l Bio l Cell, 2014, 25(6):800-810.
[34] Korah R, Healy JM, Kunstm an JW, et al. Epigenetic silencing of RASSF1A deregu lates cytoskeleton and p rom otes m alignant behavior of ad renocortical carcinom a[J]. Mo l Cancer, 2013, 12:87.
[35] Kim ST, Lim DS, Canm an CE, et al. Substrate specificities and identification of putative substrates of ATM kinase fam ily m em bers[J]. J Bio l Chem, 1999, 274(53): 37538-37543.
[36] Ham ilton G, Yee KS, Scrace S, et al. ATM regu lates a RASSF1A-dependen t DNA dam age response[J]. Curr Bio l, 2009, 19(23):2020-2025.
[37] Yee KS, Gro cho la L, Ham ilton G, et al. A RASSF1A po lym orphism restricts p53/p73 activation and associates with poor survival and accelerated age of onset of soft tissue sarcom a[J]. Cancer Res, 2012, 72(9): 2206-2217.

