乙型肝炎病毒反转录酶区rtI233V变异的演变及病毒学特点分析
叶晓玲,刘妍,陈容娟,许智慧,李晓东,叶海燕,唐振祥,程书权,徐东平
核苷(酸)类似物(NAs)具有强效抑制乙肝病毒(hepatitis B virus,HBV)、改善肝脏功能、延缓肝脏疾病进展以及口服方便、副反应小等特点,已广泛应用于慢性乙肝(chronic hepatitis B,CHB)的治疗,然而长期用药引起的耐药问题为临床乙肝防治带来了新的挑战。阿德福韦酯(ADV)是第一种应用于临床的核苷酸类药物,因其对HBV野生株和核苷类药物拉米夫定(LAM)耐药株均有较强的抗病毒作用而被广泛用于临床CHB患者的治疗,但长期应用仍具有较高的耐药率(5年耐药率为29%)。经典的ADV耐药变异为HBV反转录酶(RT)区rtN236T和rtA181V变异[1-2]。近年有研究报道HBV rtI233V位点变异可引起ADV耐药,但也有报道该变异仍对ADV敏感[3-9]。本研究从临床大样本患者入手,分析rt I233V变异的发生频率,并重点分析其中2例慢性HBV患者rtI233V变异的演变过程,总结变异株与野生株的表型耐药特点,明确rtI233V位点变异的病毒学特点及其临床意义。
1 资料与方法
1.1 研究对象 2010年7月-2013年8月解放军302医院收治的慢性HBV感染者9830例,均接受不同的NAs治疗。诊断标准符合《慢性乙型肝炎防治指南(2010年版)》[10],常规检查项目由解放军302医院临床检验中心完成,无重叠或混合感染,血清冻存于–20℃。
1.2 主要试剂 病毒DNA-OUT提取试剂盒(北京天恩泽公司),pGEM-Teasy载体(Prom ega公司,美国),XbaⅠ/SphⅠ内切酶及T4DNA连接酶(TaKaRa公司,日本),p TriEx-HBV(C)1.1倍载体(法国里昂大学Zou lim教授惠赠),X-trem eGENE HD 转染试剂(Roche公司,德国),胎牛血清、DMEM培养基(Gib co公司,美国),荧光定量PCR试剂盒(上海复星公司)。引物合成和克隆测序均由北京天一辉远公司完成。
1.3 方法
1.3.1 HBV RT区基因耐药变异与基因型分析 采用病毒DNA-OUT试剂提取患者血清HBV DNA,HBV RT区基因扩增采用本室建立的单管巢式PCR方法[11],对PCR产物进行DNA双向测序,并对rt80、rt84、rt169、rt173、rt180、rt181、rt184、rt202、rt204、rt233、rt236和rt250等耐药相关位点的序列峰图进行分析。用Mega 4软件进行HBV基因分型[12]。
1.3.2 HBV RT区TA基因克隆 将扩增后的PCR产物克隆至pGEM-Teasy载体中,转化JM 109感受态细胞,挑选至少20个经PCR鉴定阳性的样品送测序并分析耐药变异。
1.3.3 p TriEx-HBV 1.1倍重组载体的构建及鉴定分别提取含相关变异类型(rtI233V、rtN236T及rtI233V+rtN236T)和野生型克隆的质粒,将其RT区片段经XbaⅠ和SphⅠ双酶切后定向克隆至经同样酶切后的p TriEx-HBV(C)1.1倍表达载体上,连接产物转化JM 109感受态细胞,接种至LB固态琼脂板(含100g/m l氨苄青霉素),37℃温箱培养过夜。随机挑取克隆测序,对重组质粒进行鉴定,确定HBV表达载体构建成功。
1.3.4 细胞转染及表型耐药分析 将HepG2细胞接种于24孔板(10万/孔),18h后每孔转染0.25μg质粒;5h后,细胞用1×PBS洗2次,分别加入含倍增浓度药物的培养液培养(LAM:0、0.01、0.1、1、10、100μm o l/L;ADV:0、3.125、6.25、12.5、25、50μm o l/L;ETV:0、0.001、0.01、0.1、1、10μm o l/L;TDF:0、0.78、3.125、12.5、50、200μm o l/L),隔天换药。4d后收集细胞培养上清,用DNase消化游离DNA,37℃过夜;75℃ 10m in灭活DNase,裂解释放Dane颗粒中的DNA。采用实时荧光定量PCR法检测上清中的HBV DNA载量,计算药物半数有效浓度(EC50)及耐药倍数[即变异株与野生株EC50的比值(Fo ld)]。
1.4 统计学处理 应用SPSS 18.0软件分析数据。连续变量以±s表示,组间差异的比较根据分组分别采用t检验和方差分析,P<0.05(双侧)为差异有统计学意义。
2 结 果
2.1 临床样本资料和rtI233V变异检出分析 应用PCR产物直接测序法从9830例慢性乙肝患者血清样本中共检出rtI233V变异28例,检出率0.28%;检出经典ADV耐药变异rtA181V和(或)rtN236T 653例,检出率6.64%。进一步分析rtI233V变异类型,其中单独变异19例,与其他变异联合出现9例。28例患者中男24例,女4例,年龄34.8±12.9岁,HBV DNA载量4.6±1.5 LogU/m l,ALT 48.8±33.3U/L。检出该变异的患者均有ADV治疗史,其中16例(57.1%)接受ADV单药治疗6个月以上,其余12例(42.9%)接受包括ADV的多药序贯联合治疗1年以上。HBV基因型分析显示8例为B基因型,20例为C基因型。
2.2 两例患者rtI233V变异的临床演变 回顾性分析2例HBeAg阴性慢性乙肝患者rtI233V变异的临床演变。
患者1,男,36岁。治疗基线(S1)时仅检测到野生型病毒株,HBV DNA载量和ALT分别为5.4 Log U/m l和53U/L。首次经ADV单一抗病毒治疗1个月后未检测到HBV DNA,实现了快速病毒学应答,16个月后出现病毒学突破,血清HBV DNA载量升至3.12LogU/m l,继续服用ADV 1个月后,血清HBV DNA载量为2.8LogU/m l,ALT正常,HBV RT区克隆检出rt I233V变异(S2),该变异株占病毒准种池的6.25%。继续服用ADV治疗至45个月(S3)时,HBV DNA为3.68LogU/m l,ALT正常。此时克隆测序显示rtI233V变异株占25.0%,rtN236T变异株占62.5%,rtI233V+rtN236T变异株占6.25%,因服用ADV抑制病毒效果欠佳,换用ETV继续抗病毒治疗,HBV DNA一直处于最低检测下限(图1A、1B)。
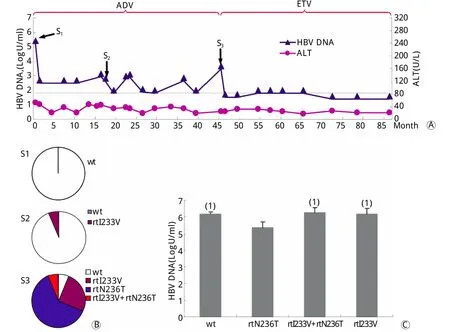
图1 患者1的临床抗病毒治疗应答、病毒学演变及体外复制力评价Fig.1 Clinical virological and biochem ical response in patient 1 during antiviral therapy (A), dynam ic evo lutions of rtI233V m utation by clonal sequencing (B) and the in vitro assessm ent of HBV natural rep lication com petence of various viral stains (C)w t. Wild type; (1)P<0.05 com pared with rtN236T m u tan t
患者2,男,49岁。治疗基线(S4)时仅检测到野生型病毒株,HBV DNA载量和ALT分别为4.57 LogU/m l和66U/L,经ADV单一抗病毒治疗3个月(S5)后,HBV DNA升至5.54LogU/m l,ALT恢复正常;HBV RT区克隆检出rtI233V变异,占病毒准种池的26.7%,换用聚乙二醇干扰素治疗5个月后,HBV DNA下降仍不理想,ALT波动,最高升至118U/L。继续ADV抗病毒治疗4个月(S6)后,HBV DNA升至5.9LogU/m l,HBV RT区克隆显示rtI233V变异占病毒准种池的86.4%,换用ETV后病毒逐渐降至最低检测下限,ALT维持正常水平(图2A、2B)。
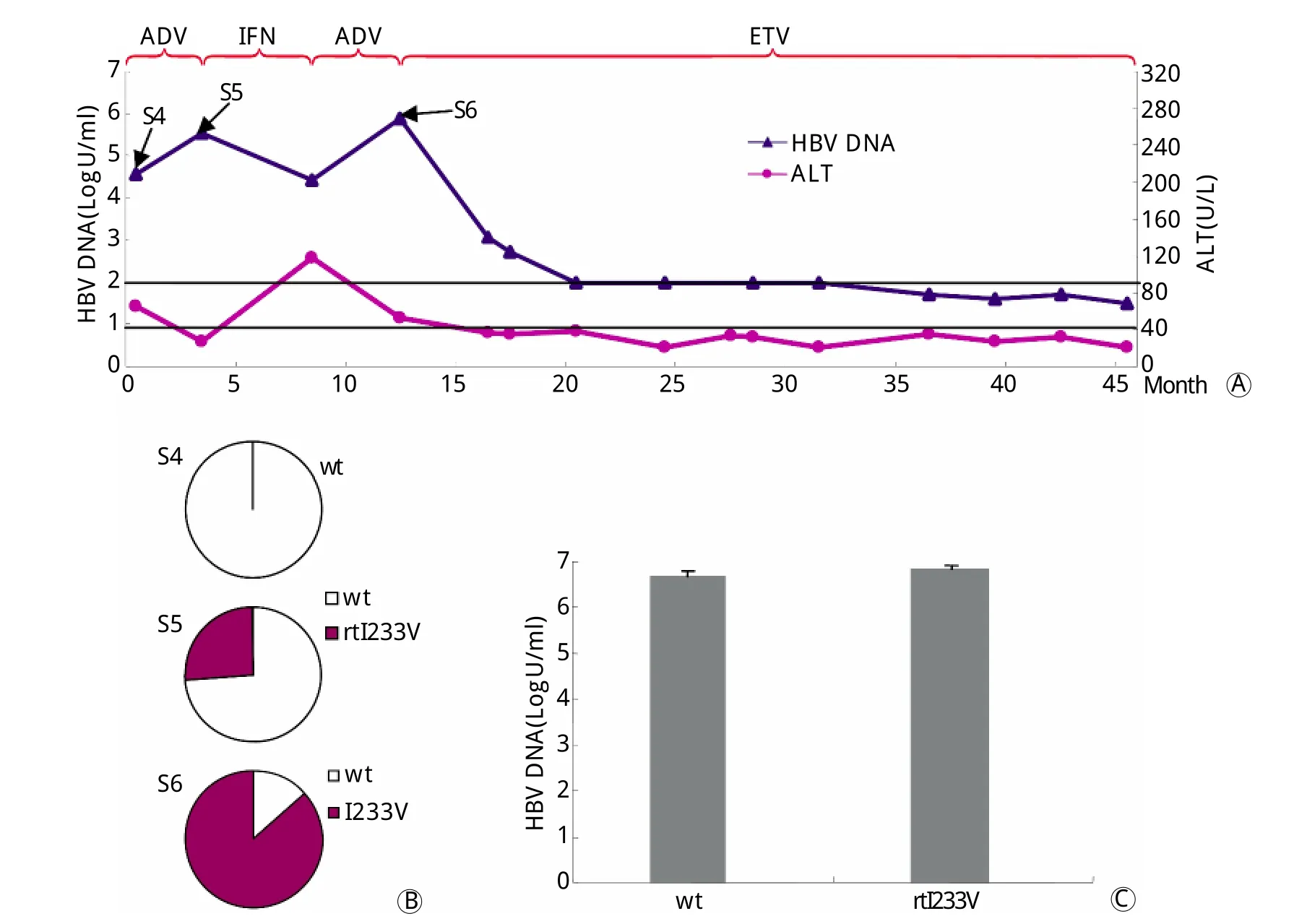
图2 患者2的临床抗病毒治疗应答、病毒学演变及体外复制力评价Fig.2 Clinical virological and biochem ical response in patient 2 during antiviral therapy (A), dynam ic evolutions of rtI233V mutation by clonal sequencing (B) and the in vitro assessment of HBV natural rep lication com petence of various viral stains (C)w t. W ild type
2.3 病毒体外复制力测定 分别将患者1的野生株和变异株(rtI233V、rtN236T、rtI233V+rtN236T)的重组载体质粒及患者2的野生株和rtI233V变异株的重组载体质粒瞬时转染Hep G2细胞,4d后测定细胞上清中HBV DNA载量即为病毒体外复制力,取3次独立实验的平均值(图1C、图2C),结果显示rtN236T单独变异株的复制力(5.38±0.31LogU/m l)低于野生株(6.20±0.1LogU/m l),差异有统计学意义(P<0.05),而rtI233V+rtN236T变异株的复制力为6.27±0.28LogU/m l,显著增加了由于rtN236T变异而受损的病毒复制力(P<0.05)。患者2的野生株病毒复制力(6.67±0.10LogU/m l)与rtI233V变异株病毒复制力(6.82±0.08 LogU/m l)比较差异无统计学意义。2.4 变异株的表型耐药分析 从2例患者分离的野生株和单独rt I233V变异株对ADV均敏感,而rtN236T和rtI233V+rtN236T变异株对ADV均显示不同程度的耐药,耐药倍数分别为6.82和5.28;此外,野生株与rtI233V、rtN236T、rtI233V+rtN236T变异株对LAM、ETV及TDF均敏感(表1)。

表1 患者1与患者2各变异类型的耐药表型分析Tab.1 Pheno typ ic assay of m u tan ts and w ild-type strain of the tw o patien ts
3 讨 论
目前NAs是临床最常用的抗HBV药物[13],其作用靶点均为HBV RT区,对HBV cccDNA并没有直接抑制作用,因此需要长期服用。长期应用NAs会导致对环境压力适应力强的变异病毒株获得适应性突变和选择性扩增,或使已存在于准种池中的极少量变异株获得选择性扩增,使耐药病毒逐渐成为优势种群,导致病毒学和生化学突破,最终导致病情恶化。ADV是继LAM之后第二种应用于临床的NAs类药物,可明显抑制HBV DNA的复制,促进乙肝患者血清转氨酶正常化,促进肝脏组织学改善,且价格适中,适用于慢性乙肝患者和对LAM耐药的患者,但长期应用后的耐药也是患者在抗病毒治疗过程中难以避免的问题。
rtN236T变异与rtA181V变异是经典的ADV耐药变异形式[1],rtI233变异位点与rtN 236变异位点相距3个碱基,是否同样可导致ADV耐药引起了学者们的广泛关注。rt I233V位点变异最早见于德国学者的报道,Schildgen等[3]于2006年首次经体外实验证实了rt I233V变异会引起ADV原发耐药,EC50是野生株的6~10倍;而同一课题组的Geipel等[6]于2014年的研究却发现,rtI233V变异并不会影响病毒对ADV的敏感性。Ism ail等[7]通过蛋白质空间结构的同源模建和分子对接方法,阐明rt I233V变异不会影响蛋白质的催化位点,认为rt I233V变异不会影响ADV的抗病毒作用。Ahn等[8]提出rtI233V变异会影响病毒复制力,并引起ADV耐药。邓俊等[9]通过定点突变及Sou thern b lo tting等实验技术证实rtI233V变异能导致HBV对ADV轻度耐药。可见,关于rtI233V变异与ADV耐药的相关性仍存较大争议。
为了进一步阐明rtI233V变异与ADV的相关性,本研究通过对大样本慢性HBV感染者的测序分析,从9830例患者样本中检出28例rtI233V位点变异(单独出现或与其他耐药变异共同存在),对其中2例服用ADV后发生病毒学突破或原发性无应答的典型病例进行随访分析,病毒复制力检测结果表明,rtI233V变异株的体外复制力与野生株相当,而常见的耐药相关变异株的病毒复制力比野生株低[14-15],这与机体免疫系统或药物的选择压力有关[16]。本研究结果显示rtI233V变异仅在有ADV用药史的患者样本中检出,且病毒准种池中的rtI233V变异随着ADV用药时间的延长而增加,说明该变异与ADV用药有关。
本研究还运用体外表型耐药分析明确了rtI233V位点变异对4种NAs耐药的影响,ADV表型耐药结果显示rtI233V、rtN236T和rtI233V+rtN236T变异株的EC50分别是野生株的1.57、6.82和5.28倍。临床通常将抗病毒药物的耐药分为3个级别:耐药倍数2~9倍为轻度耐药,10~99倍为中度耐药,大于100倍为高度耐药。但是由于受到药物临床实际暴露量、在体内代谢变化等因素的影响,不同药物引起临床耐药需要的药物敏感性下降程度(即EC50增加值)有很大差别,通常认为引起ADV耐药变异EC50与野生毒株相比需增加2.5倍以上,引起ETV和TDF耐药变异EC50需增加10倍以上,引起LAM耐药变异EC50需增加100倍以上[17]。本研究结果显示,无论是rtI233V单独变异(与野生株相比)还是与rtN236T联合变异(与rtN236T耐药株相比)对ADV的影响均不到2.5倍,说明rtI233V不是ADV原发耐药变异。但rtI233V变异可以增加rtN236T变异株受损的病毒复制力,因而该变异符合ADV耐药相关的复制力补偿变异的特点,与本课题组前期研究中发现的LAM相关的复制力补偿变异rtL229F变异类似[18]。
本研究结果表明,rt I233V位点变异对LAM、ETV、TDF 3种药物均敏感。2例患者换用ETV补救抗病毒治疗后,病毒载量降至最低检测下限,说明ADV治疗失败后换用与其无交叉耐药位点的ETV治疗有效,与相关文献报道一致[19-20]。
总之,本研究首次通过临床大样本对rt I233V变异频率、演变规律、体外复制力及表型耐药进行分析,发现rt I233V变异与ADV用药疗效不佳有关,是一种ADV耐药相关复制力补偿变异,临床换用ETV继续治疗可获得持续病毒学和生化学应答。本研究结果对深入了解ADV相关耐药变异的临床特点、优化抗HBV治疗方案具有重要意义。
[1] Segovia MC, Chacra W, Go rdon SC. Ade fovir d ip ivoxil in ch ronic hepatitis B: history and curren t uses[J]. Expert Op in Pharm aco ther, 2012, 13(2): 245-254.
[2] Wang X, Liu Y, Si LL, et al. Analysis for phenotyp ic resistan t characteristics of a novel m utation rtN236V in the reversetranscrip tase dom ain of hepatitis B virus iso lated from an adefovir dipivoxil-refractory patient with chronic hepatitis B[J].Med J Chin PLA, 2013, 38(4): 256-259. [王晓, 刘妍, 思兰兰,等. 阿德福韦酯治疗失败的慢性乙型肝炎患者HBV反转录酶区新变异rtN236V的表型耐药特点分析[J]. 解放军医学杂志, 2013, 38(4): 256-259.]
[3] Schildgen O, Sirm a H, Gerlich WH, et al. Variant of hepatitis B virus with p rim ary resistance to adefovir[J]. N Eng l J Med, 2006,354(17): 1807-1812.
[4] Curtis M, Zhu Y, Borroto-Esoda K. Hepatitis B virus containing the I233V m utation in the po lym erase reverse-transcrip tase dom ain rem ains sensitive to inhibition by adefovir[J]. J In fect Dis, 2007, 196(10): 1483-1486.
[5] Sch ildgen O, O lo tu C, Funk A, et a l. Se lection and counterselection of the rtI233V adefovir resistance m utation during antiviral therapy[J]. J Clin M icrobio l, 2010, 48(2): 631-634.
[6] Geipel A, Glebe D, Gerlich WH, et al. Hepatitis B virus rtI233V m utation and resistance to adefovir[J]. N Eng l J Med, 2014,370(17): 1667-1668.
[7] Ism ail AM, Sharm a OP, Kum ar MS, et al. Im pact of rtI233V m utation in hepatitis B virus po lym erase p rotein and adefovir efficacy: Hom ology m odeling and m olecular docking studies[J].Bioin fo rm ation, 2013, 9(3): 121-125.
[8] Ahn S, Park Y, Kim K, et al. The im pact of the hepatitis B virus polym erase rtA181T m utation on rep lication and drug resistance is potentially affected by overlapping changes in surface gene[J].J Viro l, 2014, 88(12): 6805-6818.
[9] Deng J, Yu DM, Zhang XX, et al. Im pact of 1233V m utation in the hepatitis B virus reverse transcrip tase dom ain on adefovir resistance[J]. Chin J In fect Dis, 2011, 29(3): 129-133. [邓俊,于德敏, 张欣欣, 等. 乙型肝炎病毒P基因反转录酶区I233V变异对阿德福韦酯耐药的实验研究[J]. 中华传染病杂志,2011, 29(3): 129-133.]
[10] Chinese Society of Hepato logy and Ch inese Society of In fectious Diseases, Chinese Medical Association. The guideline of p revention and treatm ent for chronic hepatitis B (2010)[J].In fect Dis In fo, 2011, 24(1): Ⅲ-ⅩⅤ. [中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 传染病信息, 2011, 24(1): Ⅲ-ⅩⅤ.]
[11] Xu DP, Liu Y, Cheng J, et al. Multip le-site analysis of HBV d rugresistant m utations in 340 patients with chronic hepatitis B[J].Chin J Hepato l, 2008, 16(10): 735-738. [徐东平, 刘妍, 成军,等. 340例慢性乙型肝炎患者乙型肝炎病毒多位点耐药相关突变分析[J]. 中华肝脏病杂志, 2008, 16(10): 735-738.]
[12] Liu Y, Zhong YW, Xu ZH, et al. Features and clinical im p lications of hepatitis B virus genotypes and m u tations in basal co re p rom oter/ p recore region in 507 Chinese patients with acute and ch ronic hepatitis B[J]. J Clin Viro l, 2010, 47(3): 243-247.
[13] Yu YQ, Zhang WH. Progress in antiviral therapy to p revent HBV recurrence in patients of post-liver transp lan tation[J]. Chin J Pract In tern Med, 2014, 34(6): 553-557. [喻一奇, 张文宏. 预防肝移植患者慢性乙型肝炎复发抗病毒治疗现状及进展[J]. 中国实用内科杂志, 2014, 34(6): 553-557.]
[14] Liu Y, Li XD, Xin SJ, et al. The rtA181S m utation of hepatitis B virus p rim arily con fers resistance to adefovir dipivoxil[J]. J Viral Hepat, 2014, 8(14): 1-7.
[15] Liu Y, Liu WH, Xu DP, et al. Screening and iden tification of a novel adefovir dipivoxil resistance associated m utation, rtN236V,of HBV from a large cohort of HBV-in fected patients[J]. Antivir Ther, 2014, 4(8): 1-8.
[16] Zhang MS, Ge GH, Yang YL, et al. Decreased an tigen icity p rofiles of imm une-escaped and d rug-resistan t hepatitis B surface antigen (HBsAg) doub le m utan ts[J]. Viro l J, 2013, 10:292.
[17] Lok AS, Zou lim F, Locarnini S, et al. An tiviral d rug-resistan t HBV:standard ization of nom enclatu re and assays and recomm endations for m anagem ent[J]. Hepatology, 2007, 46(1):254-265.
[18] Ji D, Liu Y, Xu ZH, et al. Evo lu tion and pheno typ ic analysis of rtL229 po lym erase m utations within the hepatitis B virus genom e[J]. Med J Chin PLA, 2012, 37(6): 544-547. [纪冬, 刘妍, 许智慧, 等. 乙肝病毒多聚酶区rtL229突变的演变及其表型分析[J]. 解放军医学杂志, 2012, 37(6): 544-547.]
[19] Zeng MD, Mao YM, Yao GB, et al. Five years of treatm ent with adefovir d ip ivoxil in Chinese patien ts with HBeAg-positive ch ron ic hepatitis B[J]. Liver In t, 2012, 32(1): 137-146.
[20] Yao WM, Liu Y, Si LL, et al. Inh ib ito ry e ffect of herbal concoction Suduxing on hepatitis B virus rep lication in vitro[J].Med J Chin PLA, 2014, 39(2): 121-124. [姚伟明, 刘妍, 思兰兰, 等. 新型中药制剂肃毒星对乙型肝炎病毒体外复制的抑制作用研究[J]. 解放军医学杂志, 2014, 39(2): 121-124.]

