Ebp1的表达对乳腺癌细胞增殖和侵袭的影响
刘 媛,袁 杰,张 洁,赵元元,牛瑞芳
(天津医科大学肿瘤医院肿瘤研究所,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津300060)
论著
Ebp1的表达对乳腺癌细胞增殖和侵袭的影响
刘 媛,袁 杰,张 洁,赵元元,牛瑞芳
(天津医科大学肿瘤医院肿瘤研究所,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津300060)
目的:研究降低Ebp1的基因表达水平对乳腺癌细胞T47D野生型增殖能力和侵袭能力的影响。方法:转染并筛选Ebp1降表达的单克隆细胞株clone1、clone2、clone3,阴性对照组命名为control。应用小干扰RNA(siRNA)技术降低Ebp1的表达,采用Western blotting技术检测Ebp1蛋白水平的变化,噻唑蓝(MTT)比色法和克隆形成实验观察其对T47D野生型细胞增殖能力和克隆形成能力的影响;采用Matrigel侵袭实验研究其对细胞侵袭能力的影响。结果:Western blotting检测表明siRNA干扰后T47D野生型细胞中Ebp1的蛋白表达水平明显下降,且与亲本和control组细胞比较,Ebp1降表达的细胞克隆的增殖能力和侵袭能力明显增强,差异有统计学意义(P<0.05)。结论:Ebp1表达下降可以明显促进乳腺癌细胞的增殖和侵袭能力,提示Ebp1可能是乳腺癌增殖和侵袭的抑制性因子。
Ebp1;乳腺癌;增殖;侵袭
乳腺癌是女性发病率最高的肿瘤之一,而肿瘤的浸润和转移是影响治疗效果和导致死亡的重要因素[1]。Ebp1是重组人增殖相关蛋白2G4(proliferation-associated 2G4)家族的成员之一,最早是通过酵母双杂交从生长因子表皮受体3(EGFR3)的跨膜区域分离得到,并且被鉴定为ErBb3的结合蛋白[2]。Ebp1在乳腺癌[3]、肝癌[4]、前列腺癌[5]等多种肿瘤细胞中表达异常,参与调节细胞周期和细胞分化,是肿瘤增殖抑制因子。蛋白激酶C(protein kinase C, PKC)可引起Ebp1的Ser360的磷酸化与ErbB3发生结合,而当在ErBb3配体HRG的刺激下[6],Ebp1与ErBb3分离进入细胞核,与转录抑制因子Rb[7]、组蛋白脱乙酰酶HDAC2[8]、转录抑制因子Sin3A[9]相互作用,形成转录抑制复合体,从而导致与增殖相关的蛋白如转录因子E2F1、周期蛋白Cyclin D1和Cyclin E的表达受到抑制。目前Ebp1在乳腺癌中的研究已证实其对乳腺癌细胞MCF-7和AU565增殖的抑制作用[10],但是其对乳腺癌迁移和侵袭的研究却较少。本研究利用小干扰RNA(siRNA)技术降低增殖能力和侵袭能力都较弱的乳腺癌细胞T47D野生型中的Ebp1表达,观察降表达后对T47D野生型细胞的增殖和侵袭能力的影响,探究Ebp1影响乳腺癌增殖和侵袭的分子机制。
1 材料和方法
1.1 siRNA质粒 Ebp1特异性小干扰RNA购自吉凯基因公司,干扰序列为:5′-ATGCAGGACAGAGAACCACTATTTACA-3′,对照组序列为:5′-ATGCCAGCCAGGGAGAGTACAAGGCA-3′[11],质粒的测序结果显示与定制序列一致。
1.2 细胞培养 人乳腺癌细胞T47D野生型(American Type Culture Collection细胞库)培养于含有10%FBS、100 U/mL青霉素和100 U/mL链霉素的RPMl-1640培养液,37℃、5%CO2环境中,0.25%的胰酶消化传代。
1.3 细胞系的建立
1.3.1 质粒转染 (1)取对数生长期的T47D野生型细胞以适当密度接种于6孔板内,使其24 h覆盖率达到90%~95%,37℃、5%CO2孵箱培养。(2)24 h后用1640培养液将细胞饥饿2 h,以提高转染效率。(3)将siRNA及对照质粒(序列长度与siRNA相同却无干扰意义)用Lipofectamine2000(Invitrogen公司)进行转染。取质粒10μg,转染试剂4μL分别稀释于1640培养液,静置20min后混匀,缓慢滴加到6孔板内,37℃、5%CO2孵箱培养。(4)转染6 h后更换新鲜培养液。
1.3.2 稳定克隆的筛选 (1)转染48 h后在荧光显微镜下观察细胞转染效率,并加入150mg/mL的嘌呤霉素进行筛选,期间依据细胞状态和密度进行换液或传代。(2)筛选2周后,观察细胞荧光强度,并以有限稀释的方法筛选出3珠稳定单克隆细胞,分别命名为 clone1、clone2、clone3,对照组命名为control组,嘌呤霉素浓度为筛选浓度的1/2。(3)siRNA的干扰效率以Western blotting检测。
1.4 Western blotting检测Ebp1在细胞中的表达将提取的细胞蛋白用SDS-PAGE胶电泳分离并转移至PVDF膜上。5%牛奶封闭1 h后室温孵育一抗Ebp1(1∶1 000)(Mi lipore兔抗),β-acti n(1∶2 000)(Santa Cruz鼠抗)2 h,室温孵育HRP标记的二抗(1∶5 000)(Invit rogen公司)1 h;最后用ECL化学发光试剂和胶片曝光信号检测蛋白的表达水平。
1.5 噻唑蓝(MTT)检测细胞增殖能力 取对数生长期的T47D野生型细胞、control细胞和clone1、clone2、clone3分别接种于96孔板中,贴壁后每24 h加入20μL的5mg/mLMTT,继续孵育4 h后每孔加150μL二甲基亚砜(DMSO),酶标仪测量570 nm处的吸光度(OD值),连续检测5d,每种细胞设置5个复孔,取其OD值的平均值。
1.6 克隆形成实验检测细胞克隆形成能力 取对数生长期的 T47D野生型细胞、control细胞和clone1、clone2、clone3,分别以500个/孔接种于6孔板中,37℃、5%CO2培养2周,每3~4 d更换新鲜培养液。2周后,弃去培养液,用甲醇固定10min,0.000 5%结晶紫染色30min,显微镜下观察并计数克隆形成数目,以>50个细胞为1个克隆。
1.7 Matrigel侵袭实验检测细胞的侵袭能力 将Matrige l(BD公司)在4℃缓慢解冻后与无血清的DMEM培养基以1∶4的比例稀释,加入T ranswell(24孔),50μL/孔,放入37℃温箱30min。将150μL的T47D野生型细胞、control细胞和clone1、clone2、clone 3细胞悬液加入上室,细胞浓度为5×105个/ mL,将300μL血清加入下室。37℃、5%CO2的细胞培养箱中培育24~36 h。利用三步染色试剂盒染色。在倒置显微镜下计数过膜细胞,光镜下(200×)随机选择5个视野计数取平均值。
2 结果
2.1 质粒转染效率验证 转染48 h后siRNA及对照质粒的转染效率如图1所示,siRNA及control组转染效率都在60%以上。clone1、clone2、clone3经过嘌呤霉素筛选后荧光细胞比例高达95%~100%,证明转染及筛选成功。

图1 干扰质粒及对照质粒的转染效率Fig1 The transfection efficiency of sm all interference plasm id and control
2.2 siRNA干扰T47D野生型细胞中Ebp1的表达水平 Western blotting结果显示,与T47D野生型比较,应用特异性小干扰RNA处理挑取的3个克隆细胞株中Ebp1表达量明显降低,而对照组则没有差异(图2)。

图2 W estern blotting检测Ebp1的表达Fig 2 Theexpression of Ebp1 detected by western blotting
2.3 降表达Ebp1增强T47D野生型细胞的增殖能力 用MTT法分别检测T47D野生型、control组和clone1、clone2、clone3细胞在 0、24、48、72、96 h的OD值,绘制生长曲线图(图3),结果显示稳定细胞系在72、96 h的生长速度明显高于T47D野生型和control组细胞(P<0.05),而T47D野生型和对照组细胞间的增殖差异无统计学意义(P>0.05)。证明Ebp1的蛋白水平降低对T47D野生型细胞的增殖具有明显促进作用。
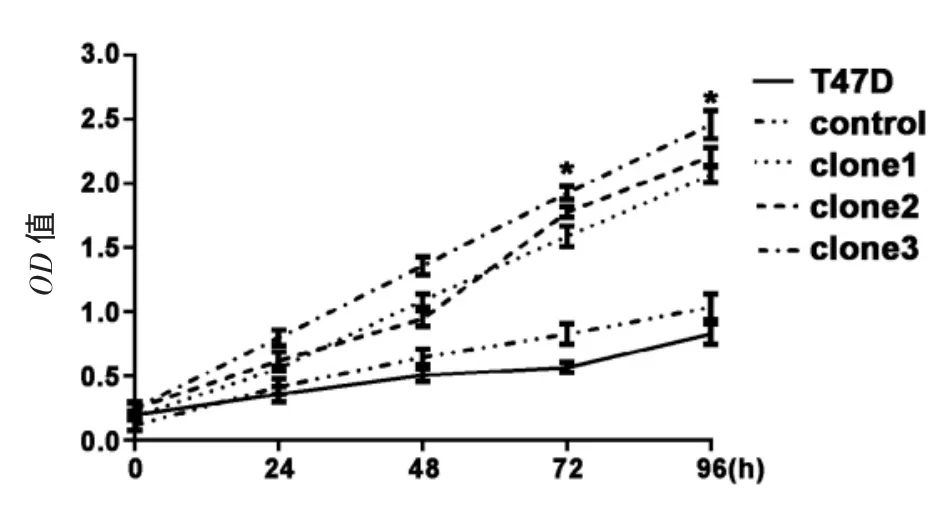
图3 实验组和对照组细胞的生长曲线Fig 3 The proliferation grow th curves of T47D wild type,control, clone1,clone2 and clone3 cells
2.4 降表达Ebp1促进T47D野生型细胞的克隆形成能力 克隆形成计数结果显示,与T47D野生型和对照组比较,clone1、clone2、clone3细胞的克隆数目明显增多(图4),且差异有统计学意义(P<0.05),而对照组与T47D野生型之间无明显差异(P>0.05),克隆直径也有明显的增加。表明降低Ebp1的蛋白表达提高了乳腺癌细胞系T47D野生型的克隆形成能

图4 各组细胞的克隆形成数目Fig 4 The colony num ber of T47D and cloneswhich down-regulated of theexpression of Ebp1
2.5 降表达Ebp1提高T47D野生型细胞的侵袭能力 T47D野生型和control组细胞穿透Matrigel的细胞数目明显低于clone1、clone2、clone3细胞,且差异有统计学意义(P<0.05)。而T47D野生型组与control组比较无明显差异(P>0.05),结果显示干扰Ebp1的基因表达明显提高了T47D野生型细胞的侵袭能力(图5)。

图5 干扰Ebp1促进T47D细胞的体外侵袭能力(×200)Fig 5 The deletion of Ebp1 result in the increaseof invasion ability of T47D cells(×200)
3 讨论
目前乳腺癌的治疗手段主要是手术、放化疗,但是预后的效果却并不理想,这主要是由于肿瘤的浸润和转移,因此研究乳腺癌浸润和转移的分子机制对于提高治疗效果意义重大[12]。此外,肿瘤细胞的恶性增殖的分子机制也是目前探究肿瘤治疗的热点。Ebp1,ErbB3结合蛋白之一,被证实是肿瘤的抑制因子,其发生核转位后与Rb、Sin3A、HDAC2形成转录抑制复合体,对肿瘤的增殖和迁移有重要的影响。研究报道,Ebp1在ErBb2/3阳性的乳腺癌细胞AU565中的表达明显增高,导致细胞G2/M期阻滞和分子分化,是乳腺癌增殖的抑制因子[10]。但是,Ebp1对乳腺癌浸润转移的影响尚不明确,因此,本研究着重研究了Ebp1对非浸润性乳腺癌细胞系T47D野生型的增殖和侵袭能力的影响。
Ebp1在肝癌、前列腺癌、乳腺癌等肿瘤组织中表达均降低,降表达后肿瘤细胞的增殖能力显著增强,本文我们特异性干扰T47D野生型细胞中Ebp1的蛋白表达量,MTT实验结果和克隆形成实验结果都表明Ebp1降表达后T47D野生型的增殖能力有明显的增强作用,说明Ebp1是乳腺癌增殖的抑制因子。但是,我们又发现,干扰Ebp1的基因表达水平后,T47D野生型细胞的侵袭能力也有明显地提高。研究报道在唾液腺样囊性癌转移病灶包括淋巴、肺和神经组织中Ebp1含量低于原发病灶,表明Ebp1与肿瘤细胞的迁移呈负相关[13],同样的结论在肝癌[14]、前列腺癌[15]等肿瘤中也得到证实。我们的研究也证明在乳腺癌中Ebp1的降表达促进肿瘤的迁移和侵袭。在腺样囊性癌中证实Ebp1与MMP-9(金属蛋白酶9)和E-cadherin的表达呈负相关[13],因此推测Ebp1影响T47D野生型细胞的迁移和侵袭可能通过MMPs的激活和上皮间质转化,但是需要进一步的研究证实。
综上所述,本研究证实Ebp1的表达量下降后导致乳腺癌细胞增殖和侵袭能力增强,而其中的分子机制尚不明确。但是,Ebp1对乳腺癌的影响为探究肿瘤的发生发展以及治疗提供了新的思路。
[1]Zheng H,LiY,Wang Y Z,etal.Downregulation ofCOX-2 and CYP 4A signaling by isoliquiritigenin inhibits human breast cancer metastasis through preventing anoikis resistance,migration and invasion[J].Toxicol ApplPharmacol,2014,280(1):10
[2] Yoo JY,Wang X W,Rishi A K,et al.Interaction of the PA2G4 (EBP1)proteinwith ErbB-3 and regulation of thisbindingby heregulin[J].Br JCancer,2000,82(3):683
[3]Lu Y,Zhou H,ChenW,etal.The ErbB3 bindingprotein EBP1 regulates ErbB2 protein levels and tamoxifen sensitivity in breast cancer cells[J].BreastCancer Res Treat,2011,126(1):27
[4] Hu B Y,Xiong Y C,Ni R Z,et al.The downregulation of ErbB3 binding protein 1(EBP1)isassociated with poor prognosisand enhanced cell proliferation in hepatocellular carcinoma[J].Mol Cell Biochem,2014,396(1/2):175
[5] Zhang Y,Linn D,Liu Z,etal.EBP1,an ErbB3-binding protein,is decreased in prostate cancer and implicated in hormone resistance [J].MolCancer Ther,2008,7(10):3176
[6] Liu ZX,Ahn JY,Liu X,etal.Ebp1 isoforms distinctively regulate cellsurvivaland differentiation[J].Proc Natl Acad SciU SA,2006, 103(29):10917
[7] Zhang Y,Woodford N,Xia X,et al.Repression of E2F1-mediated transcription by the ErbB3 binding protein Ebp1 involves histone deacetylases[J].Nucleic AcidsRes,2003,31(8):2168
[8]Akinmade D,Lee M,Zhang Y X,etal.Ebp1-mediated inhibition of cell growth requires serine 363 phosphorylation[J].Int JOncol, 2007,31(4):851
[9]Ghosh A,AwasthiS,Hamburger AW.ErbB3-binding protein EBP1 decreases ErbB2 levels via a transcriptionalmechanism[J].Oncol Rep,2013,29(3):1161
[10]Zhang Y X,Akinmade D,Hamburger AW.Inhibition of heregulin mediated MCF-7 breast cancer cell growth by the ErbB3 binding protein EBP1[J].Cancer Lett,2008,265(2):298
[11]Kim CK,Nguyen TL,Joo KM,etal.Negative regulation ofp53 by the long isoform of ErbB3 binding protein Ebp1 in brain tumors[J]. Cancer Res,2010,70(23):9730
[12]Chen JJ,Peck K,Hong TM,et al.Global analysis of gene expression in invasion by a lung cancermodel[J].Cancer Res,2001,61 (13):5223
[13]Sun J,Luo Y X,Tian Z,etal.Expression of ERBB3 binding protein 1(EBP1)in salivary adenoid cystic carcinomaand its clinicopathological relevance[J].BMCCancer,2012,12:499
[14]Zhang Y X,Ali T Z,Zhou H,et al.ErbB3 binding protein 1 repressesmetastasis-promoting gene anterior gradient protein 2 in prostate cancer[J].Cancer Res,2010,70(1):240
(2014-08-11收稿)
Influence of the expression of Ebp1 on the proliferation and invasion of breast cancer cells
LIUYuan,YUAN Jie,ZHANG Jie,ZHAOYuan-yuan,NIURui-fang
(Cancer Instituteand Hospital Tianjin Medical University,NationalCancer ClinicalMedicine Research Center,Key Laboratory of Breast Cancer Prevention and Therapy,Tianjin 300060,China)
Objective:Tostudy the influenceof theexpression ofEbp1 on theproliferation and invasion ofbreastcancer cells.Methods:Western blotting and siRNAwere applied to inspectand down-regulate the expression of Ebp1.The effectofproliferation and invasion of T47Dwild type cellswasexamined by MTT assay,colony formation assay and transwellassay respectively.Results:The proliferation and invasion of T47D wild type could be promoted by knock-down of Ebp1 as compared towild type group and control group(P<0.05).Conclusion:Down-regulation of Ebp1 facilitates the proliferation and invasion ofbreast cancer cellswhich suggest thatEbp1may be an inhibiting factor forbreastcancer.
Ebp1;breastcancer;proliferation;invasion
R737.9
A
1006-8147(2015)01-0014-04
刘媛(1987-),女,硕士在读,研究方向:乳腺癌增殖和侵袭的分子机制研究;通信作者:牛瑞芳,E-mail:niurfl982@yahoo. com.cn。

