不同时间持续缺氧对3T3-L1脂肪细胞脂肪因子基因表达的影响
论著
不同时间持续缺氧对3T3-L1脂肪细胞脂肪因子基因表达的影响
肥胖是由于能量代谢平衡失调,摄入过多和/或耗能不足致使脂肪容量增多的状态,常伴有胰岛素抵抗(IR)和高胰岛素血症、血脂异常及低度炎性状态,是发展为2型糖尿病和心血管疾病的一个最重要的危险因子。大规模流行病学调查研究显示,肥胖已经成为一个全球性健康问题,其发生率呈逐年增长趋势[1]。随着肥胖因素在代谢综合征和心血管疾病病因中的重要作用越来越被深入地认识,脂肪组织获得了巨大的科研价值,其中脂肪组织的内分泌功能紊乱在肥胖及IR中所起的作用受到越来越多的关注。脂肪因子是内脏脂肪组织分泌的活性产物,脂肪细胞分泌脂肪因子失衡与代谢综合征、2型糖尿病的发生发展存在着密切的联系。Trayhurn等[2]认为缺氧是肥胖者脂肪因子调节紊乱的重要始动因素,并由此诱导了脂肪组织炎症反应发生,导致IR的发生。本研究通过建立持续低氧脂肪细胞模型,模拟肥胖组织缺氧变化,探讨不同时间持续缺氧对3T3-L1细胞表达脂肪因子水平的影响。
1 材料与方法
1.1 实验材料 3T3-L1脂肪细胞株由加拿大AmiraKlip教授提供,Hanks液、DMEM高糖购自美国Gibico公司,胎牛血清购自以色列Bioind公司,胰岛素、1-甲基-3-异丁基-黄嘌呤(IBMX)、地塞米松溶液购自美国Sigma公司,高纯总RNA提取试剂盒、cDNA合成试剂盒购自北京天根公司,引物购自北京天一辉远生物科技有限公司,TOP荧光定量试剂盒 (TransStart®Top Green qPCR SuperMix、Passive Reference Dye)购自北京全式金生物技术有限公司。主要仪器:细胞孵育箱、缺氧箱(芬兰热电公司Thermo Electron Corporation,Model3111),实时定量PCR(qRT-PCR)仪为ABI7500。
1.2 方法
1.2.1 细胞培养 细胞模型选用3T3-L1前脂肪细胞株。将复苏的3T3-L1前脂肪细胞在37℃,5%CO2培养箱中,用含有10%FBS的高糖DMEM培养基培养。待观察到细胞长满培养瓶底壁,将细胞接种于6孔培养板中,并每2 d换液1次,观察细胞生长状态。观察到6孔板中细胞长满后,继续培养2 d。之后加入含10%FBS的高糖DMEM培养基及含0.5 mmol/L IBMX、0.25μmol/L地塞米松、10mg/L胰岛素的分化液,培养48 h,再以含10mg/L胰岛素的培基培养48 h。随后换用含10%FBS的高糖DMEM的培养液继续培养,每2 d换液1次。观察细胞可见在诱导分化10~12 d后,90%以上的3T3-L1细胞内含有大量串状脂滴,呈脂肪细胞表型。对诱导分化14 d后的细胞进行后续实验处理。
1.2.2 分组及处理 将细胞分为6组,设置常氧组和缺氧组。常氧组为对照组(缺氧0 h),置于37℃、5%CO2培养箱中培养。缺氧组为实验组,将细胞分别置于37℃、1%O2、5%CO2、94%N2下分别孵育4、12、24、48 h和72 h。每组6孔。实验重复3次。
1.2.3 实时定量PCR测定脂肪细胞缺氧诱导因子1α(HIF-1α)、葡萄糖转运子1(GLUT-1)mRNA水平 按照总RNA提取试剂盒步骤提取上述脂肪细胞总RNA,紫外分光光度计检测确定总RNA浓度及纯度。严格按照cDNA第一链合成试剂盒(20μL体系)说明,取2μgRNA合成cDNA第一链。取2 μL合成的cDNA产物及相应的上下游引物(表1)加入20μLTransStart®Top Green qPCR SuperMix体系内扩增,条件为94℃30 s,94℃5 s,60℃34 s,40个循环,β-actin作为内参。以β-actin基因的表达量作为内参来校正目的基因的表达量,结果数值以Ct值表示,每个时间点做3个复孔,取平均值,结果以2-ΔΔCt表示。实验重复3次取平均值。
1.2.4 qRT-PCR测定脂肪细胞脂联素、瘦素mRNA水平 提取脂肪细胞总RNA,紫外分光光度计检测确定总RNA浓度及纯度。严格按照cDNA第一链合成试剂盒(20μL体系)说明,取2μgRNA合成cDNA第一链。取2μL合成的cDNA产物及相应的上下游引物(表1)加入20μLTransStart®Top Green qPCRSuperMix体系内扩增,条件为94℃30 s,94℃5 s,60℃34 s,40个循环,β-actin作为内参。以βactin基因的表达量作为内参来校正目的基因的表达量,结果数值以Ct值来表示,每个时间点做3个复孔,取平均值,结果以2-ΔΔCt表示。实验重复3次取平均值。

表1 qRT-PCR引物序列Tab 1 Geneprimer sequencesused for qRT-PCR
1.3 统计学处理 采用SPSS 17.0软件包进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析 (One-Way ANOVA),组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同时间持续缺氧后脂肪细胞 HIF-1α、GLUT-1mRNA表达水平变化 与常氧组相比,缺氧培养的脂肪细胞HIF-1α、GLUT-1mRNA表达水平升高,并且在缺氧24 h达到最高水平。72 h缺氧组HIF-1α、GLUT-1mRNA表达水平与常氧组无统计学差异。HIF-1αmRNA表达在4 h缺氧组为常氧组的(1.36±0.34)倍;缺氧12 h为对照组的(2.52± 0.44)倍;24 h缺氧组为对照组的(5.82±0.52)倍;缺氧48 h为常氧组的(4.27±0.39)倍;72 h缺氧组为常氧组的(1.76±0.61)倍。4 h缺氧组HIF-1αmRNA表达较常氧组无统计学差异。12 h缺氧组、24 h缺氧组及48h缺氧组HIF-1αmRNA表达较常氧组及4 h缺氧组均有升高,差异有统计学意义。48 h缺氧组及72 h缺氧组HIF-1αmRNA表达较24 h有所下降,差异有统计学意义,见图1。GLUT-1mRNA表达缺氧4 h组为对照组(1.14±0.44)倍;缺氧12 h时为常氧组的(2.18±0.43)倍;缺氧24 h组为常氧组的(5.96±0.63)倍;缺氧48 h组为常氧组的(1.71±0.18)倍;72 h缺氧组为常氧组的(1.23±0.15)倍,见图2。其中12、24、48 h缺氧组GLUT-1mRNA表达升高较常氧组有统计学差异。48 h缺氧组及72 h缺氧组GLUT-1mRNA表达较24 h缺氧组下降,差异有统计学意义。
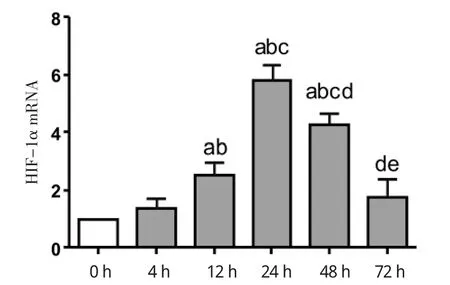
图1 不同时间持续缺氧孵育后脂肪细胞HIF-1α基因表达Fig 1 Theexpression of HIF-1αat different incubation timeof hypoxia in adipocytes
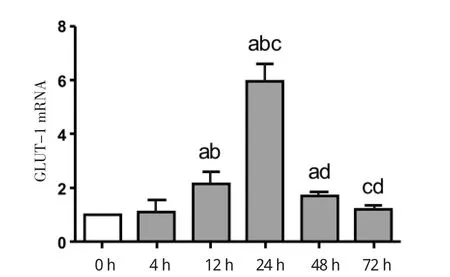
图2 不同时间持续缺氧孵育后脂肪细胞GLUT-1基因表达Fig 2 The expression of GLUT-1 at different incubation time of hypoxia in adipocytes
2.2 不同时间持续缺氧后脂肪细胞脂联素、瘦素mRNA表达水平变化 与常氧组相比,缺氧组脂联素mRNA的表达整体呈下降趋势。脂联素mRNA表达水平在4 h缺氧组为对照组的(0.87±0.20)倍;12 h缺氧组为常氧组的(0.35±0.12)倍;缺氧24 h组为常氧组的(0.21±0.09)倍;缺氧48 h组为常氧组的(0.19±0.09)倍;72 h缺氧组为常氧组的(0.61±0.18)倍。与常氧组相比较,缺氧组脂联素mRNA表达水平下降,其中12 h缺氧组、24 h缺氧组、48 h缺氧组、72 h缺氧组mRNA的下降较对照组有统计学差异。与24 h、48 h缺氧组相比,72 h脂联素mRNA表达有所上升,差异有统计学意义,见图3。瘦素mRNA的表达缺氧组呈现高于常氧组的趋势。瘦素mRNA在4 h缺氧组是常氧组的(2.15±0.23)倍;缺氧12 h组是常氧组的(2.64±0.37)倍;缺氧24 h组是常氧组的(5.70±0.52)倍;48 h缺氧组是常氧组的(3.19±0.31)倍;缺氧72 h是常氧组的(3.95±0.30)倍。与常氧组相比,4、12、24、48、72 h缺氧组的瘦素mRNA的表达均有升高,差异均有统计学意义。48 h及72 h缺氧组较24 h缺氧组下降,差异有统计学意义。见图4。
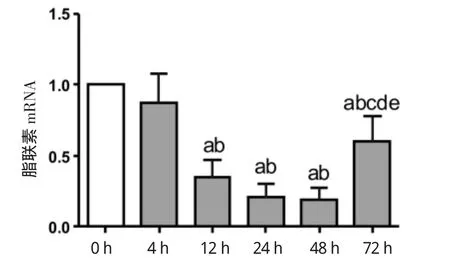
图3 不同时间持续缺氧孵育后脂肪细胞脂联素基因表达Fig 3 Theexpression of adiponectin at different incubation time of hypoxia in adipocytes

图4 不同时间持续缺氧孵育后脂肪细胞瘦素基因表达Fig 4 The expression of leptin at different incubation time of hypoxia in adipocytes
3 讨论
近年来,随着肥胖及其相关代谢性疾病发病率的增高,肥胖与IR关系及机制的研究已成为内分泌与代谢病领域的焦点问题。在众多的研究成果中,肥胖导致脂肪组织缺氧,造成脂肪组织的慢性炎症状态,进而参与IR的发生发展这一理论得到越来越多的重视。“脂肪组织缺氧”假说是Trayhurn等[2]在2004年提出的,他们认为缺氧是肥胖者脂肪因子调节紊乱的重要始动因素,并诱导了脂肪组织发生炎症反应。国外实验室均证明在遗传性和营养诱导的肥胖小鼠的内脏脂肪组织中确实存在缺氧,并且与炎症因子的升高和脂联素的下降密切相关,为支持脂肪组织缺氧假说提供了有力证据[3]。人体解剖学证实白色脂肪组织血供不丰富,相关研究证明,肥胖者白色脂肪组织中血供并未增加,新生血管不足可导致局部脂肪组织血供不足,造成局部缺氧[4]。另一方面,肥胖患者脂肪细胞直径增大可达到约150~200μm[5],氧气在组织内的弥散距离为120 μm[6],增大的脂肪细胞会形成屏障阻碍氧气在组织内弥散,加重了脂肪组织内的缺氧。缺氧诱导脂肪的炎症因子表达水平的升高[7],可使内皮功能紊乱而进一步使血供减少。内皮功能紊乱可能阻碍了胰岛素扩血管和招募毛细血管的效应,导致脂肪组织血流减少,加重脂肪细胞的缺氧,介导肥胖者分泌脂肪因子紊乱。3T3-L1前脂肪细胞分离自小鼠胚胎(17~19 d)的Swiss3T3细胞[8],加入诱导剂特异性地诱导分化后,显微镜下可见细胞间质丰富,许多三酰甘油脂滴积聚于细胞核周围,呈现典型的成熟脂肪细胞形态。3T3-L1前脂肪细胞在形态学变化、细胞生长、脂质积聚及脂肪代谢相关酶的表达都能充分展示人体脂肪细胞的特点,是国际上公认的研究脂肪代谢的细胞模型。本实验对3T3-L1前脂肪细胞进行不同时间持续缺氧处理,模拟肥胖状态下脂肪组织的缺氧环境,以此来重点研究在肥胖中,缺氧因素对脂肪细胞表达脂联素和瘦素的影响。
在缺氧状态下,细胞内相关低氧反应基因表达增强,以利于机体对于低氧产生适应能力。HIF-1是由α和β亚基组成的异二聚体,α亚基、β亚基分别属于功能单位和结构单位。HIF-1α是最重要的氧信号转导因子,对其他因子具有调控作用,但其表达相对不稳定,受到O2调节。研究证明,当氧供充分时,HIF-1α发生脯氨酰羟基化和泛素化,经过蛋白酶体途径迅速降解。而缺氧能增加HIF-1α的稳定性,促使HIF-1α转位到核内,促进低氧目标基因的表达[1]。受HIF-1调控的低氧反应基因有70多种,涉及物质代谢、细胞增生、凋亡及血管形成等方面,GLUT-1、VEGF等低氧敏感因子,在转录水平受HIF-1调节,成为较特异的低氧反应标志[9]。本研究以缺氧下HIF-1α、GLUT-1mRNA表达水平增加为依据,成功构建持续缺氧模型。
脂联素由ap M1基因编码,244个氨基酸残基组成,在循环中,以低分子量的6聚体和高分子量的12~18聚体形式存在,是非常重要的脂肪因子,在多种生理过程中起着重要作用,包括改善胰岛素敏感性,血管内皮功能保护,抑制动脉粥样硬化的发生等[3]。血浆脂联素通过两个不同的受体,即脂联素受体1(adiponectin receptor,AdipoR1)和AdipoR2实现信号转导,它们的广泛表达可以诱导AMPK的磷酸化和激活,从而引起下游一系列分子的改变,刺激葡萄糖的利用和脂肪酸的氧化。AdipoR2基因表达增加了参与肝摄取葡萄糖所有基因的表达。此外,脂联素和TNF-α都可由脂肪细胞分泌,并且结构相似,因而可能存在相互拮抗作用,可通过抑制TNF-α在胰岛素信号中的作用来改善IR[10]。循环中脂联素水平较高,但肥胖患者血浆脂联素水平却比正常人下降,这与脂肪组织分泌的其它激素是截然相反的,提示内脏脂肪的堆积产生了某些脂联素生成的抑制因子,进一步导致胰岛素敏感性下降、血压升高、动脉粥样硬化等[11]。在本实验中,我们建立不同时间持续缺氧脂肪细胞模型,研究脂肪缺氧对脂肪细胞表达脂联素的影响。结果显示缺氧处理的脂肪细胞脂联素表达下降,在4~48 h缺氧组中,随着缺氧时间的延长,脂联素的降低更为明显。缺氧72 h脂肪细胞表达脂联素未能继续下降,可能与细胞状态有关,细胞对缺氧反应敏感性较缺氧24 h及48 h差。通过以上数据可以得出:肥胖状态下,脂肪组织缺氧是一个非常重要的脂联素生成的抑制因子。在细胞状态良好的前提下,缺氧时间越长,脂肪组织脂联素生成降低越明显。
瘦素是主要由白色脂肪组织分泌产生的、由ob基因编码(位于人类基因7q32)的、166或167个氨基酸组成的分泌型蛋白质类激素,分子量约14~16kD[12]。瘦素进入血液循环后,通过多种组织上、多种形式的瘦素受体作用于中枢及外周多种位点,从而发挥调节机体能量代谢、维持正常生殖功能、促进血管生成、提高免疫力等生理学作用。瘦素作用于其位于下丘脑的受体后,可以激活PI3K信号通路,从而增强脂肪酸的氧化,增加机体对葡萄糖的摄取利用;同时,瘦素可以发挥抑制食欲及刺激能量消耗的作用,因此,它是机体调控体质量的主要的活性因子之一。另一方面,瘦素与其受体的结合还可以明显抑制IL-1介导炎症通路的表达,从而发挥强大的抗炎作用[13]。因此,瘦素从理论上讲也被认为是一种重要代谢相关性的保护因子。然而,研究表明,血清瘦素浓度与肥胖程度(如体质量指数、体脂百分含量)呈显著正相关,肥胖个体血清瘦素水平大约是正常体质量者的2倍,是消瘦者的3倍或>3倍,这可能是由于瘦素调节机体脂肪代谢的脱逸作用所致[14]。瘦素在脂肪组织和胰岛素之间起负反馈的信号传递作用,由于肥胖患者的瘦素受体对瘦素不敏感,负反馈机制受到破坏,瘦素不能有效抑制胰岛细胞的胰岛素分泌,导致高胰岛素血症及IR。对于肥胖时脂肪细胞分泌瘦素升高的机制,缺氧机制发挥了重要作用,本实验显示缺氧孵育脂肪细胞后瘦素mRNA表达水平较常氧条件下明显升高,并且有一定的时间依赖性,在24 h时升高达到最大水平。
本研究团队主要研究肥胖-脂肪缺氧与IR之间的联系,在以往的工作中对脂肪细胞缺氧与代谢紊乱方面的研究取得了一些成果[15-16]。本次实验主要模拟肥胖-脂肪缺氧时脂肪细胞持续缺氧状态,设定不同缺氧时间,分析持续缺氧状态对脂肪组织合成脂联素及瘦素的影响。一方面通过HIF-1α和GLUT-1等低氧敏感因子的表达增高为依据,成功构建了脂肪细胞缺氧模型。不同时间缺氧处理脂肪细胞后,脂肪细胞表达脂联素下降,瘦素表达升高,提示在肥胖中脂肪组织缺氧是导致脂肪组织分泌脂肪因子紊乱的重要因素;另一方面,由于脂肪细胞体外培养的的特殊性,脂肪细胞的对外部刺激的反应,还需要考虑到细胞本身状态。综合以上因素,本实验证明缺氧介导的脂肪细胞各种内分泌功能变化,在24 h时最为明显,这为下一步进行肥胖-脂肪组织相关研究时脂肪细胞缺氧处理时间的选择提供参考。预防和治疗肥胖及与其密切相关的胰岛素抵抗已经成为全世界关注的难题。尽管对肥胖-胰岛素抵抗的相关研究正在逐年增加,但是进展依然缓慢。本研究团队主要致力于对肥胖-脂肪缺氧的机制研究,希望能够为肥胖-胰岛素抵抗等代谢问题的预防及治疗提供理论依据。
[1] Trayhurn P.Hypoxia and adipose tissue function and dysfunction in obesity[J].PhysiolRev,2013,93(1):1
[2] Trayhurn P,Wood IS.Adipokines:inflammation and the pleiotropic roleofwhiteadipose tissue[J].Br JNutr,2004,92(3):347
[3] Ye J,Gao Z,Yin J,etal.Hypoxia isa potential risk factor for chronic inflammation and adiponectin reduction in adipose tissueofob/ob and dietary obesemice[J].Am JPhysiol Endocrinol Metab,2007, 293(4):E1118
[4] Kabon B,Nagele A,Reddy D,etal.Obesity decreasesperioperative tissueoxygenation[J].Anesthesiology,2004,100(2):274
[5] Skurk T,Alberti-Huber C,Herder C,et al.Relationship between adipocyte size and adipokine expression and secretion[J].J Clin EndocrinolMetab,2007,92(3):1023
[6] Brahimi-Horn M C,Pouysségur JO.A source of Life and stress[J]. FEBSLett,2007,581(19):3582
[7]胡立娟,牛文彦.不同时间缺氧对脂肪细胞炎症因子表达的影响[J].天津医科大学学报,2012,18(1):4
[8] Poulos SP,Dodson M V,Hausman G J.Cell linemodels for differentiation:preadipocytesand adipocytes[J].Exp BiolMed(Maywood), 2010,235(10):1185
[9] Rocha S.Gene regulation under low oxygen:holding your breath for transcription[J].Trends Biochem Sci,2007,32(8):389
[10]杨义生,洪洁,顾卫琼,等.脂肪组织的分泌功能与代谢综合征[J].国外医学内分泌学分册,2004,24(3):156
[11]Mangge H,Almer G,Truschnig-Wilders M,et al.Inflammation, adiponectin,obesity and cardiovascular risk[J].Curr Med Chem, 2010,17(36):4511
[12]Zhang Y,Proenca R,MaffeiM,etal.Positional cloningof themouse obesegeneand itshuman homolog[J].Nature,1994,372(6505):425
[13]Münzberg H,MyersM G.Molecular and anatomical determinantsof central leptin resistance[J].NatNeurosci,2005,8(5):566
[14]Pelleymounter M A,Cullen M J,Baker M B,et al.Effects of the obesegene producton bodyweight regulation in ob/obmice[J].Science,1995,269(5223):540
[15]何庆,高占国,李晓通,等.肥胖小鼠脂肪组织缺氧对脂联素表达的转录抑制作用[J].中华糖尿病杂志,2013,5(8):486
[16]岳晶晶,周芹,何庆,等.不同频率间歇低氧对3T3-L1脂肪细胞炎症因子和脂肪因子的影响[J].天津医药,2012,40(4):308
(2014-09-12收稿)
杨传慧1,李 萍1,何 庆1,刘金泉2,牛文彦2
(1.天津医科大学总医院内分泌科,天津300052;2.天津医科大学免疫学系,天津300070)
目的:探讨不同时间持续缺氧孵育后脂肪细胞脂联素和瘦素表达的变化。方法:将分化成熟的3T3-L1脂肪细胞随机分为6组,即常氧(21%O2)组和缺氧(1%O2)4、12、24、48、72 h组,实时定量PCR(qRT-PCR)法测定各时间点脂肪细胞中缺氧诱导因子1α(HIF-1α)、葡萄糖转运子1(GLUT-1)、脂联素和瘦素基因表达。结果:与常氧组相比,缺氧12、24、48 h组HIF-1α、GLUT-1mRNA表达水平升高,差异有统计学意义(P<0.05)。缺氧24 h时HIF-1α、GLUT-1mRNA达到最高。各缺氧组脂联素mRNA在12、24、48、72 h缺氧组的表达下降,较常氧组有统计学差异(P<0.05)。各缺氧组瘦素mRNA的表达高于常氧组,并在24 h时达到最高,差异有统计学意义(P<0.05)。结论:缺氧使脂肪细胞HIF-1α、GLUT-1、瘦素mRNA表达升高,脂联素mRNA表达下降,各反应在缺氧24 h时达到最大水平。
脂肪细胞;缺氧诱导因子1α;葡萄糖转运子1;缺氧;脂联素;瘦素;肥胖;胰岛素抵抗
Effectof incubation timeof hypoxia on theexpression of adipokines in the3T3-L1 adipocytes
YANGChuan-hui1,LIPing1,HEQing1,LIU Jin-quan2,NIUWen-yan2
(1.Department of Endocrinology,General Hospital,Tianjin Medical University,Tianjin 300052,China;2.Department of Immunology, Tianjin MedicalUniversity,Tianjin 300070,China)
Objective:To explore the effect of different incubation time of hypoxia on the expression of adipokines in the 3T3-L1 adipocytes.Methods:Thedifferentiated 3T3-L1 adipocyteswere randomly divided into6 groups,normoxia(21%O2)and hypoxia(1%O2)conditions for 4,12,24,48,72 h respectively.ThemRNA expressions of hypoxia inducible factor-1α (HIF-1α),glucose transporter 1 (GLUT-1),adiponectin and leptinwere detected by the qRT-PCR.Results:In 3T3-L1 adipocytes,themRNA expressionsofHIF-1αand GLUT-1 inhypoxia conditions for12 h,24h and 48 hwerehigher than normoxia-treated cells(P<0.05);furthermore,theywerehighestin thegroup ofhypoxia-treated cells for24 h.Comparedwith thenormoxiagroup,theadiponectinmRNA expressionsof the hypoxia-treated 3T3-L1 adipocytesdecreased inallgroups(P<0.05)except for the4h group(P<0.05).Ttranscription levelof leptin in thehypoxia-treated cellsincreased(P<0.05),and itreached thehighest level in the24 h hypoxiagroup.Conclusion:ThemRNA expressionsofHIF-1α,GLUT-1 and leptin of3T3-L1 adipocytes increase in the condition ofhypoxia incubation,while the levelofadiponectinmRNA decreases under hypoxia treatment.Allchangesabove reach thepeaks within the24hof hypoxia-treated 3T3-L1 adipocytes.
adipocytes;hypoxia inducible factor-1α;glucose transporter1;hypoxia;adiponectin;leptin;obesity;insulin resistance
R589.2
A
1006-8147(2015)01-0001-05
国家自然科学基金资助项目(81170740,81270144);天津市科委科技支撑项目(09ZCZDSF04500)
杨传慧(1988-),女,硕士在读,研究方向:内分泌与代谢;
何庆,E-mail:hech69@hotmail.com。

