海拔对当归多糖含量的影响
文 / 李冰, 于长青*, 郝琴, 张晓雪, 魏文慧
(甘肃省轻工研究院 分离技术开发中心 天然产物工程技术研究中心, 甘肃 兰州730000)
海拔对当归多糖含量的影响
文 / 李冰, 于长青*, 郝琴, 张晓雪, 魏文慧
(甘肃省轻工研究院 分离技术开发中心 天然产物工程技术研究中心, 甘肃 兰州730000)
通过野外采样对岷县海拔梯度间当归多糖含量进行了研究。结果发现:1)当归多糖含量随着海拔的升高呈现出极显著增大后显著下降的趋势。2)随温度的上升,当归多糖含量呈现出先显著增大后极显著下降的趋势。3)海拔和温度的交互作用对当归多糖含量有极显著的影响。研究表明:海拔对当归多糖含量变化有着重要的影响,且当归多糖含量在海拔间的变化是海拔作用于温度产生的结果,并在海拔2450~2520 m、年均温度5.9~6.2 ℃的范围内含量最高,为确定当归多糖的适宜栽培区域和提高岷归品质提供理论依据。
岷归; 当归多糖; 海拔; 温度
生态环境是药用植物中有效成分形成和积累的重要因素[1]。药用植物的有效成分同时受到遗传因子(内因)和环境因子(外因)的影响[2],而环境因子随海拔梯度发生的剧烈变化为研究药用植物有效成分提供了理想的条件[3]。如随着海拔的升高,环境温度、生长季长度和资源有效性均会减少,而年降水量、风速、霜冻发生频率及太阳辐射量等则会增加[4,5]。因此,药用植物中的有效化学成分也会随海拔的变化而变化[6,7]。研究发现,植物中多糖含量随海拔高度的升高而增加[8],但也有研究表明,植物多糖随海拔升高不总是呈现出增加规律[9,10]。
一般地,温度会随着海拔升高而降低,从而对植物生长产生影响[11,12],植物多糖等药用成分也随之改变。大量研究表明[1,13-15],适温有利于无氮物质如糖、淀粉等的合成。因此,引起不同居群间植物多糖变化的影响机制是不尽相同的。在研究海拔对植物多糖的影响时,需要探讨影响是海拔和温度共同作用产生的,还是海拔直接作用的结果。目前,国内外有关植物多糖研究主要集中在探讨植物多糖提取方法及工艺优化等方面,但海拔对植物种内不同居群间多糖含量的变化有何响应,作用机制如何还鲜见报道。
当归(Angelica sinensis(Oliv.) Diels),主产于甘肃岷县,云南、四川、陕西、湖北等省均有分布[16]。其干燥根具有促进新陈代谢、护肝、降压、抑制动脉粥样硬化、抗菌、镇痛、消炎等功效[17],主要成分为多糖、挥发油糖、阿魏酸等[18]。岷县当归又称岷归,因产于甘肃省岷县而得名,是名贵的妇科良药和重要滋补品,素有“归中上品”之称。目前,国内外对岷归的研究主要集中在化学成分分析、有效成分提取及提取工艺优化等方面[19-23]。本文选择不同居群岷归为研究对象,探讨当归多糖量随海拔高度的变化规律及作用机制,旨在为确定当归多糖的适宜栽培区域和提高岷归品质提供理论依据。
1、材料与方法
1.1 研究区域概况
本研究区在甘肃省定西市岷县境内,位于青藏高原东麓与西秦岭陇南山地接壤区海拔2300-3000m;年均降水量560.8mm,降雨主要分布7-9月;年平均气温为5.8℃,一月份平均温度-6.9℃,七月份平均温度16℃;年平均无霜期不少于100d。该区地势开阔、多风、气候寒冷等[24]。
1. 2试验材料
试验材料为岷县境内分布的药食同源栽培植物当归(Angelica sinensis(Oliv.) Diels)。当归是伞形科(Umbelliferae)当归属(Angelica)多年生草本植物。根圆柱状,分枝,有多数肉质须根,黄棕色,有浓郁香气。花期6-7月,果期7-9月[16]。
1. 3试验仪器与试剂
仪器为Cary50 VARIAN型紫外分光光度计(美国瓦利安公司)、AB104-N型分析天平(瑞士梅特勒-托利多集团)、JFSD-70型粉碎机(上海五久自动化设备有限公司)、GSY4-Ⅱ型恒温水浴锅(北京市医疗设备厂)、800型离心沉淀器(上海手术器械厂)。
试剂为葡萄糖(分析纯,天津市百世化工有限公司)、苯酚(分析纯,天津市化学试剂一厂)、硫酸(比重1.84,分析纯,白银银环化学制剂厂),其他试剂均为分析纯。
1.4 试验方法
1.4.1 取样
2014年10月在岷县境内选取8个不同海拔的试验区(表1),每个试验区分别选择3个相距大于1 km生境相似的样点,每个样点随机采集当归10~15株(不考虑当归生命周期),取其地下根部,按样点归类带回试验室。对于采集的样品,按样点归类进行干燥粉碎,标记装袋备用。
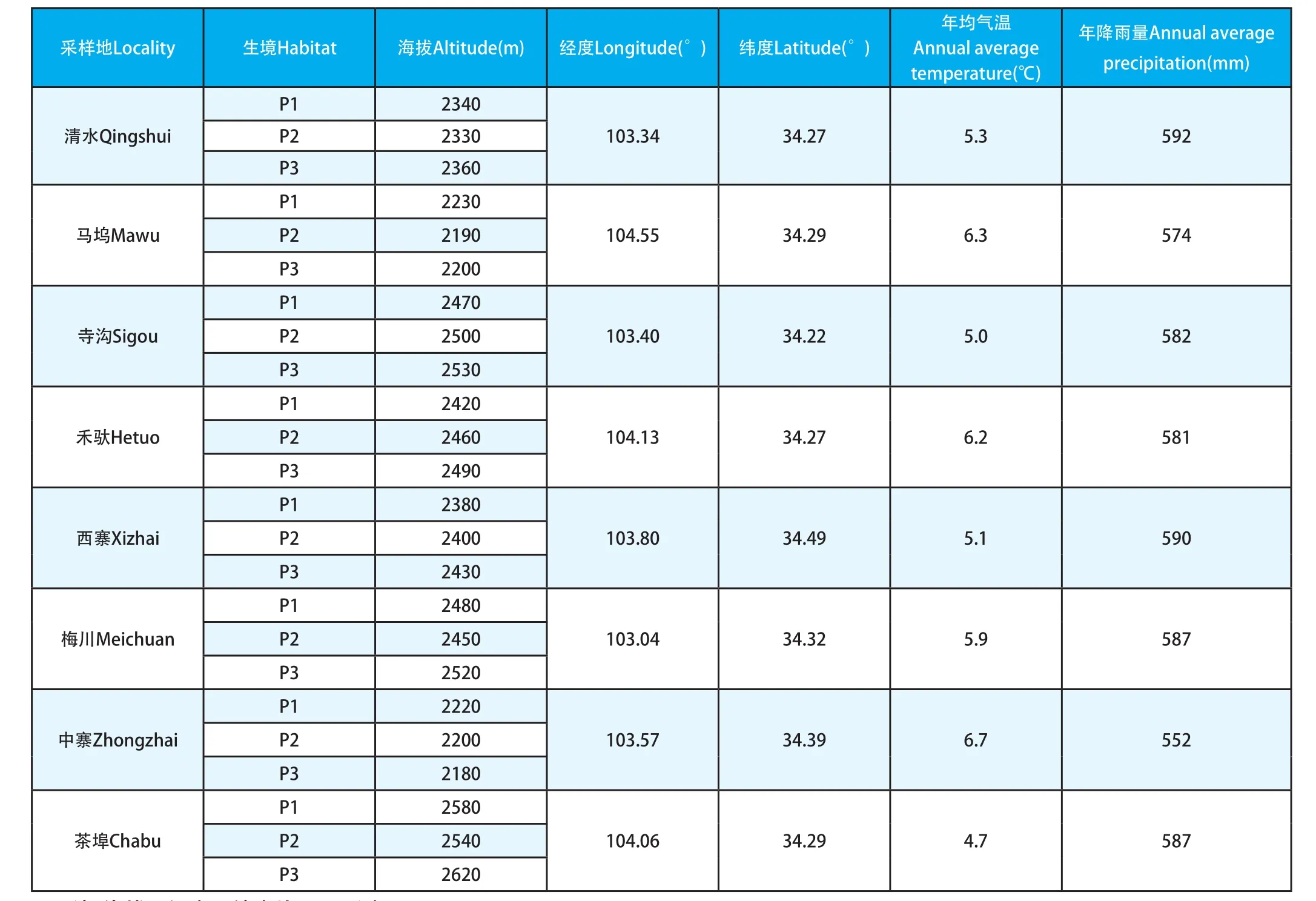
表1 岷归居群概况Table 1 The background of field populations studied of Min Angelica
1.4.2 当归提取物的制备
分别取各样地样品110g,加入660mL蒸馏水浸泡过夜后,经沸水煮提两次,每次2小时。将水提液离心过滤,合并滤液,加热浓缩至小体积后,向其中加入体积分数为80%的乙醇溶液,室温下过夜,3500r・min-1离心10min,舍弃上清液,将多糖沉淀干燥。将提取的当归多糖配置成10%的水溶液,向其中加入终浓度为20%的Sevage溶液(正丁醇:氯仿=1:4),充分振荡,3500r・min-1离心10min,收集水层,重复多次,干燥后得到脱蛋白的当归提取物,称其质量。
1.4.3 当归多糖的测定
以葡萄糖为标准,采用苯酚-硫酸法[23]测定当归多糖含量。以如下公式计算当归中的多糖含量。
其中:C为根据标准曲线计算出的葡萄糖浓度(μg/mL);V为样品体积(mL);ts为稀释倍数;M为当归提取物质量(g)。
1.4.4 数据分析
用Bivariate correlations和Linear regression分析当归多糖含量与海拔、温度的相关性和线性分析。根据海拔与温度的负相关关系[25],用General lineal model中的Univariate分析海拔与温度是否对当归多糖存在交互作用(P<0.05),如果存在交互作用则说明当归多糖在海拔间的变化是海拔作用于温度产生的结果;如果不存在交互作用(P>0.05)则说明当归多糖在海拔间的变化是海拔直接作用产生的结果。统计分析均采用SPSS19.0统计软件。
2、结果与分析
2. 1 硫酸-苯酚法测多糖标准曲线的绘制
根据苯酚-硫酸法测得葡萄糖浓度与吸光值的关系,绘制标准曲线,如图1所示,对应的回归方程为A=0.017X-0.004,R2=0.9994。
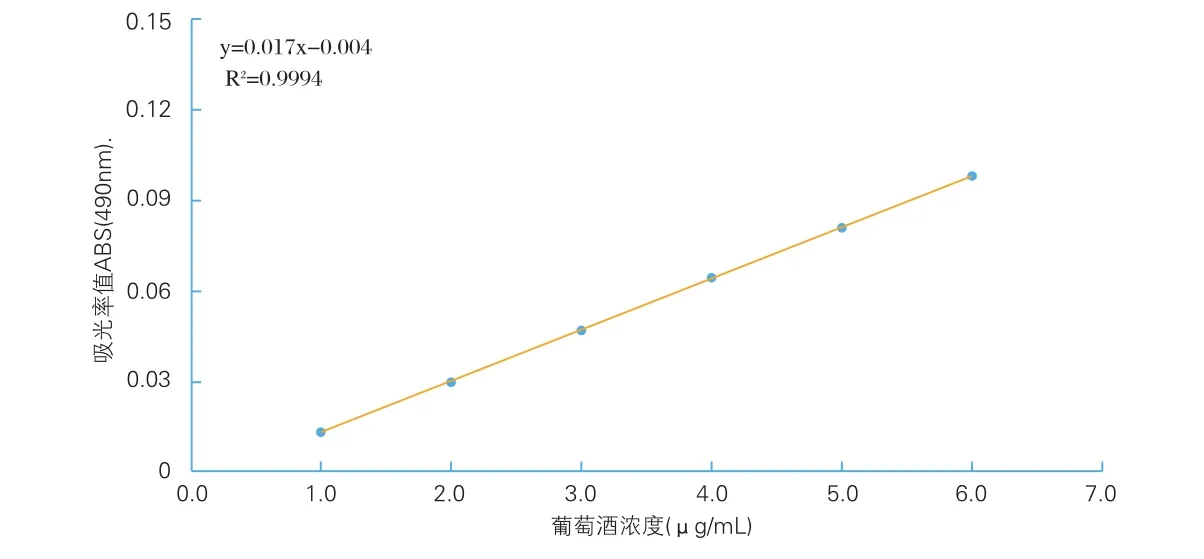
图1 当归多糖标准曲线Fig.1 angelica polysaccharides standard curve
2. 2 海拔与当归多糖含量的关系
如图3所示,在岷县境内海拔2200m~2400m间,随着海拔的升高,当归多糖含量极显著增大(P<0.01);2450m~2600m间,随着海拔的升高,当归多糖含量显著减少(P<0.05)。其中海拔为2450~2520m的样品中多糖含量高于其他海拔当归多糖含量。说明海拔对当归多糖含量具有重要影响,但不同海拔区域当归多糖含量存在的差异。

图2 海拔与当归多糖含量的回归分析Fig.2 Relationships between altitude and Angelica sinensis
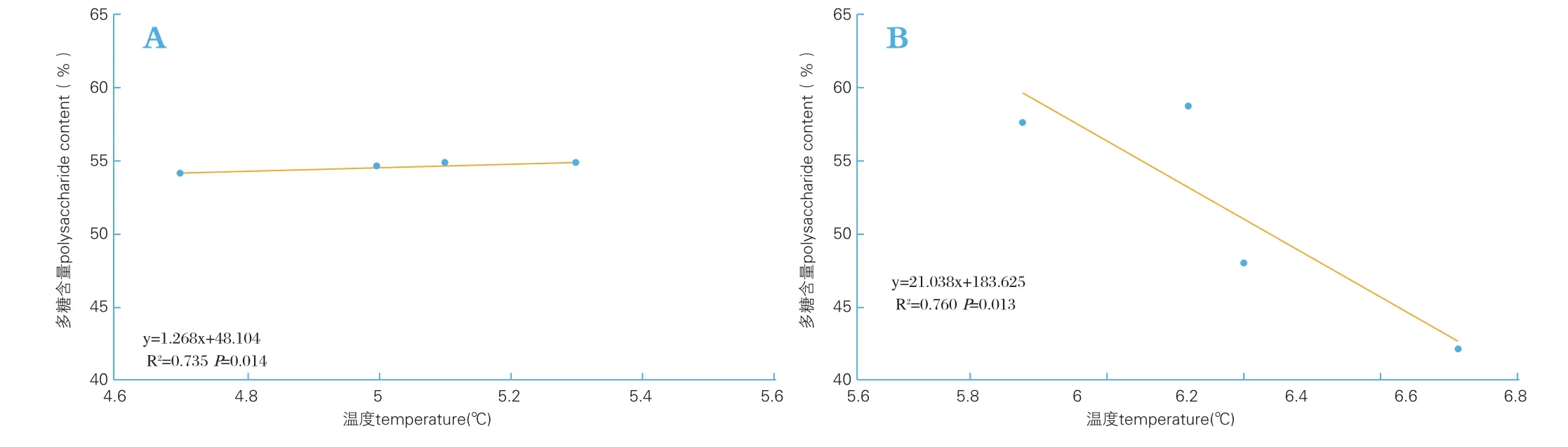
图3 温度与当归多糖含量的回归分析Fig.3 Relationships between temperature and Angelica sinensis
2. 3 温度与当归多糖含量的关系
由图3可以看出,当年均温度从4.7℃~5.3 ℃时,多糖含量随温度的上升而显著上升(P<0.05);当年均温度从5.9℃~6.7℃时,多糖含量随温度的升高而显著下降(P<0.05)。其中年均温度5.9℃~6.2℃处样品中多糖含量高于其他温度当归多糖含量。结果表明,温度对当归多糖含量同样具有重要的影响。
2. 4 海拔与温度对当归多糖含量的作用机制
分析结果表明(表2),海拔和温度的交互作用对当归的多糖含量有极显著的影响(P<0.01),说明影响当归中多糖含量的变化是由海拔和温度两因素共同作用的结果。

表2 海拔和温度对岷归多糖影响的方差分析F值结果表Tab.2 The influence of altitude and temperature on Angelica Polysaccharide values tested by univariate
3、讨论
3. 1 海拔与当归多糖含量的关系
海拔在2200m~2400m时,当归中多糖含量随海拔的升高而增大,这说明海拔升高所造成的环境胁迫对当归的生长发育产生了影响,而这种影响具体表现为对当归多糖含量的富集,这符合植物代谢产物的补偿理论,即因海拔梯度差异而发生的环境胁迫必然对植物的生长发育产生影响,植物也会以代谢产物含量和分布部位的变化产生补偿效应[3]。王惠珍[26]的研究表明,海拔升高导致当归中类胡萝卜素(Car)、净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci)降低而可溶性糖、叶绿素、阿魏酸等有效成分含量增加,当归产量增加、品质改善。海拔在2450m~2600m时,当归中多糖含量随海拔的升高而减少。马毅[27]等的研究证实,在海拔2300~2810m,岷归中多糖含量随海拔升高而升高,在海拔2900~3100 m多糖含量随海拔升高而逐渐下降。这说明补偿效应可能是由于海拔梯度通过改变当归光合产物分配和干物质积累速度所造成的结果,另一方面温度、光照、水分、土壤、传粉环境、生长季长度等多种外界因素随海拔梯度的变化对当归多糖也会产生影响[27]。此外,由于植物可塑性,植物有效成分可能还受到植物自身遗传的影响,其机制还有待进一步研究。
3. 2 温度与当归多糖含量的关系
当归多糖含量随温度的上升呈现出先增大后下降的趋势,这说明当归多糖的合成受温度的调控,与植物次生代谢受环境条件影响的理论相符[28]。粟君[29]等对青钱柳多糖的研究表明,适温有利于植物次生代谢产物的积累,过高或过低都不利于多糖的积累。由于温度直接影响植物的光合作用、呼吸速率、细胞分裂、物质运输与传递等生理生化过程,温度的适度升高具有促进植物的生长速率,提高生态系统净生产力的作用[30],当温度超出一定的阈值,会影响到植物的代谢和调节过程,导致植物产生生理衰退,生长受到抑制,甚至导致死亡[26]。
3.3 海拔对当归多糖含量的作用机制
数据表明,海拔与温度两因素共同作用于当归,使其多糖含量发生变化。由于海拔是综合影响因子,温度受其影响最大。一般情况下,海拔每升高100m,温度降低约0.6℃,且随着海拔增加,月平均气温降低,昼夜温差变大,从而影响植物生活史[11]。因此,当归多糖含量的变化是海拔影响温度变化所产生的,而非海拔直接作用的结果。此外,植物个体大小一般随海拔的升高而减小[31],且植物中有效成分的多少与其个体大小紧密相关[32,33],所以,植物有效成分还会受到系统发育水平等遗传方面的影响,不同多糖含量的当归是否与其所处的系统进化水平有关,还需要进行更多的后续研究。
4、 结论
海拔对当归多糖含量变化有着重要的影响,多糖含量随海拔和温度的升高呈现出先增大后减小的趋势,且当归多糖含量在海拔间的变化是海拔影响温度变化所产生的,并在海拔2450~2520 m、年均温度5.9~6.2 ℃的范围内含量最高,为确定当归多糖的适宜栽培区域和提高岷归品质提供理论依据。
[1]陶曙红, 吴凤锷. 生态环境对药用植物有效成分的影响[J]. 天然产物研究与开发, 2003, 15(2): 174-177.
[2]曹海禄, 曹国番, 魏建和, 等. 遗传和环境因子对药用植物品质的影响[J]. 中草药, 2007, 38(5): 785-788.
[3]王引权, 王艳, 陈红刚, 等. 海拔梯度对药用植物品质形成影响的研究进展[J]. 中国现代中药, 2012, 14(5): 41-43.
[4]Korner C. Alpine plant life: functional plant ecology of high mountain ecosystems[M]. New York: Springer verlag, 1999.
[5]李冰, 刘左军, 赵志刚, 等. 海拔对钝裂银莲花不用花色居群间繁殖特征及繁殖分配的影响[J]. 草业学报, 22(1): 10-19.
[6]Christian Z, Birthe S, Hermann S. Altiludinal differences in the contents of phenolics in flowerings heads of three memberof the tribe lactuceae (Asteraceae) occurring as introduce species in New Zealand[J]. Biochemical systematics and ecology, 2005, 33(9): 855-872.
[7]田方, 陈学林, 廉永善. 药用植物地利成分及海拔与中药性味的相关性研究[J]. 时珍国医国药, 2010, 21(2): 326-328.
[8]朱仁斌, 宛志沪, 丁亚平. 皖西山区西洋参有效成分含量与栽培地海拔高度的关系[J]. 中草药,2002, 33(2): 163-166.
[9]王寅秀, 赵岩, 陈文学, 等. 海拔高度对人参多糖量的影响[J].中草药, 2011, 42(4): 796-798.
[10]王寅秀. 不同部位人参中多糖含量随海拔变化规律及其活性比较研究[D]. 吉林, 吉林农业大学, 2011, 6.
[11]Korner C. Alpine plant life: functional plant ecology of high mountain ecosystems[M]. 2nd ed. New York: Springer Berlin Heidelberg, 2003.
[12]潘红丽, 李迈和, 蔡小虎, 等. 海拔梯度上的植物生长与生理生态特征[J]. 生态环境学报, 2009, 18(2): 722-730.
[13]粟君, 方升佐, 李彦. 温度及种源对青钱柳多糖含量的影响[J]. 林业科技开发, 2011, 25(2): 52-55.
[14]贺玉林. 丹参有效成分的积累及其与生态因子的关系[D].北京, 中国协和医科大学, 2007, 6.
[15]王亚星, 臧埔, 马琳, 等. 药用植物次生代谢影响因素研究进展[J]. 中国医药生物技术, 2011, 6(4): 291-294.
[16]中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社, 1980, 55(3): 41.
[17]中华人民共和国卫生部. 中国药典(一部)[M]. 北京: 人民卫生出版社, 2000: 269.
[18]樊秦, 李应东, 赵文君, 等. 超滤膜纯化当归多糖的研究[J].中国中医药信息杂志, 2009, 16(8): 54-55.
[19]陈飞, 姚成. 当归化学成分研究进展[J]. 中医药研究, 2002, 18(3): 51-54.
[20]黄伟晖, 宋纯清. 当归化学成分研究[J]. 药学学报. 2003, 38(9): 680-683.
[21]赵雪娇, 王海峰, 赵丹奇, 等. 当归化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2013, 30(3): 182-185.
[22]徐会生, 赵广荣, 张铁军, 等. 当归多糖的提取分离研究进展[J]. 江西科学, 2007, 25(1): 42-46.
[23]孙元琳, 杨萍芳, 吴海霞, 等. 水法提取当归多糖工艺条件优化[J]. 中国食品学报, 2009, 9(5): 130-134.
[24]姚玉璧, 马鹏里, 张秀云. 道地与近道地当归栽培气候生态与土壤环境区划[J]. 中国农学通报, 2011, 27(27): 156-160.
[25]潘红丽, 李迈和, 蔡小虎, 等. 海拔梯度上的植物生长与生理生态特征[J]. 生态环境学报, 2009, 18(2): 722-730.
[26]王惠珍. 当归产量和品质形成对海拔的响应及生理机制[D]. 兰州: 甘肃农业大学,2011.
[27]马毅, 晋玲, 王振恒, 等. 甘肃岷县不同海拔栽培当归多糖含量比较研究[J]. 中兽医医药杂志, 2013, 2: 7-8.
[28]林启寿. 中草药成分化学[M]. 北京: 科学出版社, 1977.
[29]粟君, 方升佐, 李彦. 温度及种源对青钱柳多糖含量的影响[J]. 林业科技开发, 2011, 25(2): 52-55.
[30]Celine B, Running S W. Impacts of climate change on natural forest productivity-evidence since the middle of the 20th century[J]. Global Change Biology, 2006, 12: 862-882.
[31]Marcos M, Traveset A. Sexual allocation in single-flowered hermaphroditic individual in relation to plant and flower size[J]. Oecologia, 2003, 137: 69-75.
[32]苏文华, 陆洁, 张光飞, 等. 短葶飞蓬总黄酮含量的生态生物学分析[J]. 中草药, 32(12):1119-1121
[33]程广有, 高峰, 葛春华, 等. 中国境内东北红豆杉天然群体紫杉醇含量变异规律[J]. 北京林业大学学报, 2005, 27(4): 7-11.


