火龙果矮化突变体的遗传分析
陈 楠, 文晓鹏*, 蔡永强, 刘 涛, 包九零
(1.贵州大学 农业生物工程研究院, 贵州 贵阳 550025; 2.贵州省果树研究所, 贵州 贵阳 550006)
火龙果矮化突变体的遗传分析
陈 楠1, 文晓鹏1*, 蔡永强2, 刘 涛2, 包九零1
(1.贵州大学 农业生物工程研究院, 贵州 贵阳 550025; 2.贵州省果树研究所, 贵州 贵阳 550006)
为了给火龙果的突变机制提供新信息,通过ISSR标记、DNA甲基化及检测赤霉素(GA3)含量等方法,对火龙果矮化突变体(D)及其回复突变体(R)进行遗传分析。结果表明:对比野生型(WT),D和R均带有不同程度的刺座突变,同时均对GA3敏感,其中D的GA3含量极显著低于WT,推测其为GA3缺陷型的矮化;筛选到3条有多态性差异的ISSR引物,D与WT存在有4个位点的差异,R与WT未找到差异位点;D的甲基化程度比WT高2.8%,而R的甲基化程度比WT低约0.9%。
火龙果; 矮化突变体; ISSR标记; DNA甲基化; GA3缺陷型
火龙果又名红龙果、青龙果、仙蜜果、情人果等,属仙人掌科(Cactaceae)量天尺属(Hylocereusundatus)植物,其外形独特、营养丰富,是高维生素、低糖、低脂肪的保健食品,具有较高的营养价值和经济价值。20世纪90年代初台湾开始试种,近年来已陆续引种到广西、广东、海南、福建、云南、贵州等热带和亚热带地区[1]。目前,火龙果的种质创新主要采用传统的杂交育种[2],而诱变育种可提高突变几率,缩短育种年限,在梨、苹果和柑橘上已取得较大成果[3],在火龙果上的应用也在逐步开展。如邓仁菊[4]和张冰雪[5]探讨了EMS对火龙果种子和幼苗的影响。贵州大学农业生物工程研究院在前期工作中,采用EMS诱变获得火龙果的矮化突变体,并通过组织培养得到回复突变体,但对其的遗传分析尚未见报道。笔者拟通过ISSR标记、DNA甲基化及检测赤霉素(GA3)含量,对火龙果矮化突变体(D)及其回复突变体(R)进行遗传分析,旨在为探讨火龙果的矮化突变机制提供新信息。
1 材料与方法
1.1 材料
由贵州大学农业生物工程研究院保存的火龙果品种紫红龙(野生型,WT)及其矮化突变体(D)和回复突变体(R)试管苗。其中,D与WT为第一代至第五代,R为D在培养第三代产生,即第三代至第五代。
1.2 形态学指标测定
取每种材料各30株剪下5 mm茎尖,转至MS(100%)培养基培养,分别于20 d及40 d后,统计株高及刺座形态。
1.3 赤霉素测定及应答处理
应用双抗体夹心法测定供试材料的赤霉素(GA3)含量,该试验委托上海恒远生物技术公司完成。取D及WT 5 mm茎尖各30株,接种在MS+1 mol/L GA3培养基上,20 d后统计株高及刺座形态。
1.4 ISSR检测
取供试材料各100 mg,采用dp 305-3植物DNA提取试剂盒,提取基因组DNA,通过凝胶检测DNA质量,分光光度计检测其浓度。
从52条ISSR引物中,筛选稳定且可显示清晰条带的引物进行遗传差异性检测。反应体系共10 μL,其中,含20 ng/μL基因组DNA 0.5 μL,10 μmol/L引物0.5 μL,2×PCR mixPCR 5 μL,ddH2O 4 μL。反应程序为94℃预变性5 min;94℃变性1 min,特定退火温度下退火1 min,72℃延伸1.5 min,30个循环,72℃延伸5 min。反应产物使用2%琼脂糖凝胶电泳分离,使用凝胶成像系统观察照相并记录结果。
1.5 甲基化测定
分别用EcoR I/HpaII和EcoR I/MspI组合对基因组DNA进行酶切,连上接头,应用AFLP扩增程序进行2轮扩增,产物加上样缓冲液变性后,在6%的聚丙烯酰胺凝胶上检测[6-7]。
将仅使用EcoRI/MspI酶切的样品记为m泳道,仅使用EcoRI/HpaII酶切的样品记为h泳道,将m泳道独有而h泳道没有的条带数记为M,将h泳道独有而m泳道没有的条带数记为H。总带数=H+M+(m与h泳道共有条带数),将外部胞嘧啶甲基化程度记为M%,将内部胞嘧啶甲基化程度记为H%,M%与H%之和为该样品总甲基化比率。
2 结果与分析
2.1 火龙果的形态学指标
由表1可见,不同材料的株高存在显著差异(表1)。培养20 d时,矮化突变体D株高极显著低于WT(约58%),回复突变体R株高显著低于WT(约10%);培养40 d时,矮化突变体D株高极显著低于WT(约85%),回复突变体R株高极显著低于WT(约16%)。因此,培养时间越长,D和WT的株高差值越大。同时,有96%的D及93%的R伴随刺座的变异(图1),刺座并不生刺而是形成红色的突起物,这种变异在WT上未发现。由此可见,矮化突变体D在株高突变时也产生刺座突变,R为D在株高水平上的回复,而刺座突变未回复。

表1 不同培养时间火龙果的株高
注:同列中不同大小写字母分别表示1%和5%的显著水平(下同)。
Note:Different capital and lowercase letters in the same column indicated 1% and 5% significant levels respectively. The same below.
2.2 火龙果的GA3含量与应答反应
由表2可见,不同突变体及不同继代次数材料的GA3含量存在较大差异,在第1代和第5代中,矮化突变体D的GA3含量均极显著低于同时期WT,而回复突变体R的GA3含量极显著高于矮化突变体D及WT的同时却有较高的标准差,这可能是由回复突变的不稳定性造成。因此,GA3含量下降是导致矮化突变的重要原因。

注:A为矮化突变体D母株,B为野生型WT母株,C为第一代20 d及40 d的D与WT对比(由左至右为20 d D、20 d WT、40 d D、40 d WT)。
Note:A, stock plant of D; B, stock plant of WT; C, comparison of D and WT at 20 d and 40 d of the first generation(from left to right 20 d D, 20 d WT, 40 d D, 40 d WT).
图1 不同时期火龙果矮化突变体与野生型的形态性状
Fig.1 Comparison of the dwarf mutant and the wild ype in tdifferent period
表2 不同继代次数火龙果的GA3含量
Table 2 The content of GA3of pitaya in different times of subculture pg/g

材料Material第1代Firstgeneration第5代Fifthgeneration矮化突变体D3170.22±57.78Bb3220.27±43.68Cc野生型WT3793.95±41.21Aa3689.20±39.95Bb回复突变体R-3959.38±89.10Aa
由表3可见,外施GA3的D与未施加GA3的WT在高度上无显著性差异,而外施GA3使D极显著高于未施加GA3的D(53%)。说明,D的矮化性状可以通过外施GA3来矫正。
表3 施加GA3的火龙果及其对照(CK)培养20 d的株高
Table 3 The height of pitaya applied with GA3and the control(CK) after cultured for 20 days mm

材料Material外施GA3FoliagefertilizationofGA3CK矮化突变体D12.07±0.38Ab7.93±0.67Bc野生型WT12.80±0.49Aa11.20±0.47Ab
注:表中不同大小写字母分别表示1%和5%的显著水平。
Note: Different capital and lowercase letters in the same column indicated 1% and 5% significant levels respectively.
2.3 火龙果的ISSR与MSAP检测
由图2可见,在28条可以显示清晰条带的引物中,共显示96个标记,其中仅有USC813、USC815和USC853的4个位点显示矮化突变体D与WT的差异,而在R与WT间未检测到差异谱带。其中,USC813的差异位点为D独有,而USC815和USC853的差异位点为D缺失。

图2 火龙果DNA对应引物USC813、USC815 及USC853的ISSR图谱
Fig.2 ISSR map of pitaya DNA by using primer USC813, USC815 and USC853
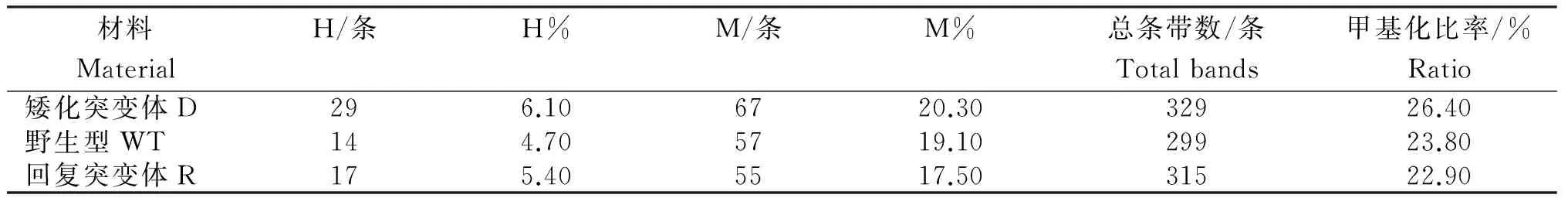
表4 火龙果的DNA甲基化比率
由表4可见,作为EMS诱变的产物,与野生型相比,D具有较高的DNA甲基化比率,而R的甲基化比率略低于二者。同时,供试材料的DNA序列中,CCGG位点上的甲基化大多发生在外部的胞嘧啶上,这也符合自然界中外部胞嘧啶甲基化程度远大于内部胞嘧啶的规律。
3 结论与讨论
植物激素影响植物的株高,其中GA3是影响株高的最重要激素之一。GA3影响的矮化分为GA3缺陷型和GA3不敏感型。GA3缺陷型的特点是GA3生物合成途径被抑制或阻断,使植物体GA3缺乏或痕量存在,体外施用GA3后,突变体的矮化表型可恢复到野生型表型;而GA3不敏感型的特点则是植物体内的GA3感受、利用途径受阻,这类突变体植株往往GA3含量正常甚至相比WT偏高,而体外施加GA3也不会导致株高的恢复[8-10]。本试验D的GA3含量极显著低于WT,而在施加GA3培养一定时间后,D的株高基本恢复到WT的水平,因此D为GA3缺陷型的矮化。
矮化突变体D是通过EMS诱变产生,大多数情况下,EMS诱变产生的突变大体为甲基化水平的表观遗传学变异[11-13]。近年来越来越多的研究表明,EMS诱变是一种高效的诱变手段,水稻、玉米、小豆等多种作物均通过EMS诱变开发出一系列的新品种[14-15]。本试验的ISSR分子标记显示D与WT的数个位点差异,这些位点差异可能是EMS诱变及组培环境的共同作用。当然,D也显示出较高CCGG位点的甲基化比率,这与EMS诱变的特征相符合,而D在株高水平上的突变和回复是受到DNA水平还是表观遗传学水平的影响,甚至是这二者的共同作用,只能通过后续对差异位点的测序定位才能得知。
形态学测定表明,R是D在株高水平上的回复突变,而R和D均伴随WT不具备的刺座突变。施加GA3并未对D的刺座产生影响,因此D的刺座突变与其矮化突变并无直接关联,很可能D是这2种突变同时发生并共存的突变体,而刺座突变的机理尚需进一步探讨。R在株高略低于WT的同时,却有更高的GA3含量及更低的甲基化比率,这可能意味着R在对株高进行回复的同时,也产生了一系列类似于GA3敏感型的变异。
[1] 邓仁菊,范建新,蔡永强,等.国内外火龙果研究进展及产业发展现状[J].贵州农业科学,2011,39(6):188-192.
[2] 吕庆芳,李润唐,邹恒欢,等.火龙果和霸王花授粉效应[J].中国南方果树,2011,40(3):60-62.
[3] 范建新,邓仁菊,李金强.果树诱变育种研究进展[J].安徽农业科学,2008,36(22):9155-9157.
[4] 邓仁菊,范建新,蔡永强.60Co^γ射线辐照和EMS处理对火龙果成活率及幼苗生长的影响[J].激光生物学报,2011(1):22-26,31.
[5] 张冰雪,丁文鹏.EMS对火龙果种子萌发的影响[J].山地农业生物学报,2013,32(3):194-197.
[6] 洪 柳,邓秀新.应用MSAP技术对脐橙品种进行DNA甲基化分析[J].中国农业科学,2005,38(11):2301-2307.
[7] 吕晓婷,赵春梅,王爱华,等.苹果MSAP技术体系的优化及其应用[J].中国农学通报,2012,28(22):287-292.
[8] 张国华,张艳洁,丛日晨,等.赤霉素作用机制研究进展[J].西北植物学报,2009,29(2):0412-0419.
[9] 黄先忠,蒋才富,廖立力,等.赤霉素作用机理的分子基础与调控模式研究进展[J].植物学通报,2006,23(5):499-510.
[10] 王月华,韩烈保,曾会明,等.植物赤霉素矮化突变体研究进展[J].中国生物工程杂志,2006,26(8):22-27.
[11] Mohamed Z, Wei-Seng H, Shek-Ling P, et al. EMS-induced mutagenesis and DNA polymorphism assessment through ISSR markers in Neolamarckia cadamba(kelampayan) and Leucaena leucocephala (petai belalang)[J]. European Journal of Experimental Biology, 2014,4(4): 156-163.
[12] Kim Y, Schumaker K S, Zhu J K. EMS mutagenesis of Arabiodopsis[J].Methods Mol Biol,2006,323:101-103.
[13] Motilal B, Jogeswar P, Ramya R M, et al. Analysis of EMS induced in vitro mutants of Asteracantha longifolia(L.) Nees using RAPD markers[J].Indian Journal of Biotechnology,2012(11):39-47.
[14] Kim Y, Schumaker K S, Zhu J K. EMS mutagenesis of Arabidopsis[J].Methods Mol Biol,2006,323:101-103.
[15] 张明义,王 翔,张彦芹,等.玉米EMS诱变材料的抗旱性筛选[J].山西农业科学,2011,39(2):99-102.
(责任编辑: 刘忠丽)
Genetic Analysis of Dwarf Mutant of Pitaya
CHEN Nan1, WEN Xiaopeng1*, CAI Yongqiang2, LIU Tao2, BAO Jiuling1
(1.InstituteofAgro-bioengineering,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouInstituteofFruitTreeScience,Guiyang,Guizhou550006,China)
The genetic analysis of the dwarf mutant (D) and its reverse variation type(R)of Pitaya was carried out by ISSR markers, DNA methylation, as well as gibberellin (GA3) detection to provide new information of mutational mechanism of pitaya.Results:Compared with the wild type (WT), D and R demonstrated variations in thorny location, and both of them were sensitive to GA3, suggesting that D was a GA3-deficient dwarf mutant. Four polymorphic bands generated from three selected primers were score between D and WT.However, no aberrant markers were obtained between R and WT. The ratio of DNA methylation of D was 2.8% higher than that of WT, conversely, that of R was 0.9% lower than WT.
pitaya; dwarf mutant; ISSR marker; DNA methylation; GA3-deficient
2015-03-18; 2015-05-01修回
贵州省重大专项子项目“火龙果优异种质资源创新及工厂化育苗技术研究”(20126006-1)
陈 楠(1989-),男,在读硕士,研究方向:植物学研究。E-mail:sznjsz0430@qq.com
*通讯作者:文晓鹏(1965-),男,教授,博士,从事植物cDNA文库的构建、遗传转化、转基因梨的基因表达等研究工作。 E-mail:xpwensc@hotmail.com
1001-3601(2015)05-0262-0163-03
S663.9
A
园艺·中药材
Horticulture·CHinese Herbal Medicimes

