镰刀菌Q7-31T菌株植物细胞壁降解酶系的结构
赵联正, 谢占玲,2*, 贾贤卿
(1.青海大学 生态环境工程学院, 青海 西宁 810016; 2.青海省高原作物种质资源创新与利用重点实验室, 青海 西宁 810016)
镰刀菌Q7-31T菌株植物细胞壁降解酶系的结构
赵联正1, 谢占玲1,2*, 贾贤卿1
(1.青海大学 生态环境工程学院, 青海 西宁 810016; 2.青海省高原作物种质资源创新与利用重点实验室, 青海 西宁 810016)
为探究植物细胞壁降解酶高效降解细胞壁的机制,用RT-PCR方法对Q7-31T菌株植物细胞壁降解酶基因片段进行克隆,使用Prot-Param、SOPMA、ProtScale Server等软件对质谱鉴定结果进行生物学分析。结果表明:将Q7-31T菌株植物细胞壁降解相关酶归为GH5家族内切葡聚糖酶、GH7家族内切葡聚糖酶、GH7家族外切葡聚糖酶和GH10家族内切木聚糖酶4类酶。这些相关酶类为中等分子量大小,二级结构由α-螺旋、延伸链、β-转角和无规则卷曲4种元件构成,其中无规则卷曲的数量最高;均为亲水性酶,磷酸化位点比例较高,存在1~2个糖基化位点;均存在较高比例的催化结构域,三级结构呈中空的C字形。结论:少量的糖基化位点、高比例的催化结构域、多变的三维构象、大量的磷酸化位点与高效的协同作用方式可能决定Q7-31T菌株的植物细胞壁降解酶对细胞壁的高效降解。
镰刀菌; 植物细胞壁降解酶; 结构
纤维素是自然界中最丰富的可再生资源,目前分布最广的天然碳水化合物是植物细胞壁的主要组成成分,占植物干重的35%~50%,也是地球生物圈碳素和能量循环的主要部分。由于纤维素具有水不溶性的高结晶构造,其外围又被木质素、半纤维素层包围,将其水解成可利用的葡萄糖难度大,到目前为止,仍未得到较好地利用[1-2]。随着世界人口骤长,为解决日益加剧的食品和能源危机,纤维素资源的利用引起世界各国极大关注和高度重视。近年来,随着现代生物技术的迅速发展,基因工程等一系列分子生物学技术的应用,使这一领域的研究不断深入,其中,纤维素降解机理和植物细胞壁降解酶成为其研究的主要组成部分[3-4]。
纤维素酶使纤维素转化为葡萄糖的详细机理研究尚未有定论,许多学者对于各个组分的作用机理提出不同的观点,如协同作用模型、Cl-CX假说、竞争吸收模型等[5-6]。目前,通过基因工程技术并利用原核和真核表达系统改造以及表达纤维素降解相关酶基因已取得一定的进展,但对于纤维素酶将纤维素降解成为葡萄糖的详细机制研究尚未定论。并且,依然存在纤维素酶的单位产量较低、胞内酶提取困难、提取工艺繁杂、生产成本居高不下等关键问题。纤维素降解机理的研究有助于从根本上突破纤维素酶产量低、工业化生产难实现的瓶颈。笔者拟以镰刀菌属Q7-31T菌株的植物细胞壁降解酶系为研究对象,分析其酶系的结构特点,为进一步探究植物细胞壁降解酶高效降解细胞壁的机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 镰刀菌(Fusariumsp. )Q7-31T菌株,由青海大学生态环境工程学院微生物实验室于2007年从青海省大通县宝库乡采集的羊肚菌子实体上自行分离纯化获得,保存于中国普通微生物菌种保藏管理中心(登录号为CGMCC 3.17610),实验室中使用固体活化培养基于室温保存。
1.1.2 酶及试剂盒 DNA聚合酶、dNTPs、Mg2+等基因扩增试剂全部购自宝生物工程(大连)有限公司,DL2000 DNA Marker、SanPrep柱式DNA胶回收试剂盒、柱式真菌总RNA抽提纯化试剂盒、M-MuLV第一链cDNA合成试剂盒购自上海生工生物工程有限公司。
1.1.3 培养基 固体活化培养基:PDA培养基粉末39 g,1 000 mL水,121℃灭菌20 min;液体种子培养基:葡萄糖2%,蛋白胨0.3%,Mendels营养盐,121℃高压灭菌20 min;发酵产酶培养基:燕麦秸秆粉0.3%,蛋白胨0.3%,Mendels营养盐,121℃高压灭菌20 min;Mendels营养盐[7]:(NH4)2SO41.4 g/L、KH2PO42.0 g/L、尿素 0.3 g/L、CaCl20.3 g/L、MgSO40.3 g/L、FeSO45.0 mg/L、MnSO41.6 mg/L、ZnSO41.4 mg/L、CoCl22.0 mg/L。
1.2 RT-PCR引物设计
根据质谱鉴定结果,在CAZy数据库中搜索同一家族内切葡聚糖酶系中近源菌种的基因,并在NCBI数据库中搜索对应的基因序列。应用Clustalx 1.83软件将获得的基因序列进行比对,得到保守序列。使用Primer Premier 5.0软件设计多对引物(表1),并用Oligo 6.0软件对设计引物进行评估和分析。由上海生工生物工程有限公司合成引物。
1.3 RT-PCR反应体系的优化
根据设计的引物,以反转录获得cDNA为模版,确定最佳RT-PCR反应体系(表2),总体系为25 μL。
1.4 镰刀菌Q7-31T的总RNA提取
将Q7-31T菌种活化后,将其接种到液体种子培养基中,170 r/min,25℃振荡培养2 d。将其接种至液体发酵培养基中,170 r/min,25℃振荡培养。待其达到产植物细胞壁降解酶最旺盛时期,将菌液10 000 r/min,4℃离心5 min,收集菌丝,作为材料进行总RNA的提取。总RNA的提取采用真菌总RNA提取试剂盒,参照使用说明提取Q7-31T菌株的总RNA。用核酸检测仪检测RNA的浓度和纯度,电泳检测RNA条带,并将其稀释至50 ng/μL,-20℃保存。
表1 RT-PCR扩增引物序列
Table 1 Primer sequence of RT-PCR amplification
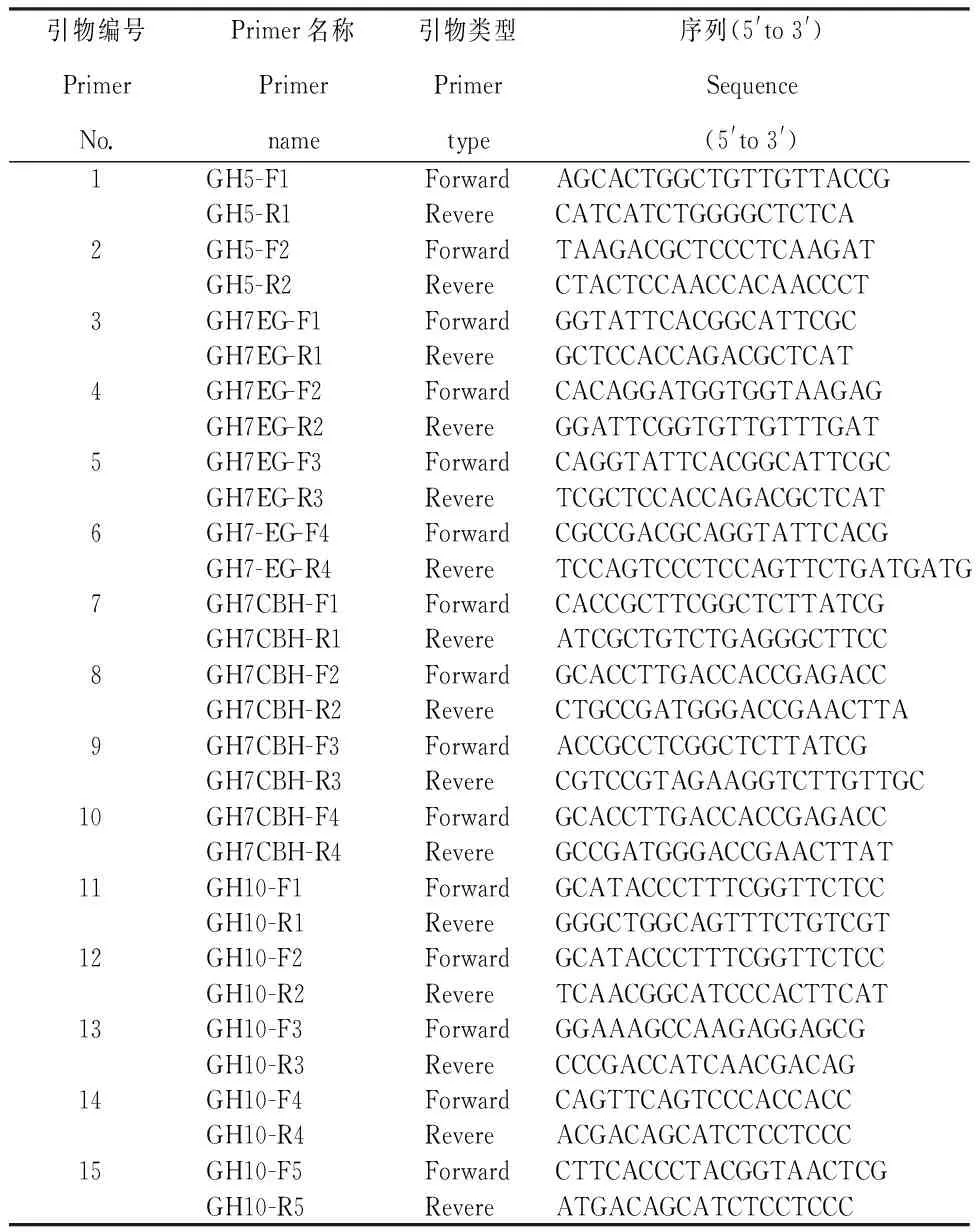
引物编号PrimerNo.Primer名称Primername引物类型Primertype序列(5'to3')Sequence(5'to3')1GH5-F1ForwardAGCACTGGCTGTTGTTACCGGH5-R1RevereCATCATCTGGGGCTCTCA2GH5-F2ForwardTAAGACGCTCCCTCAAGATGH5-R2RevereCTACTCCAACCACAACCCT3GH7EG-F1ForwardGGTATTCACGGCATTCGCGH7EG-R1RevereGCTCCACCAGACGCTCAT4GH7EG-F2ForwardCACAGGATGGTGGTAAGAGGH7EG-R2RevereGGATTCGGTGTTGTTTGAT5GH7EG-F3ForwardCAGGTATTCACGGCATTCGCGH7EG-R3RevereTCGCTCCACCAGACGCTCAT6GH7-EG-F4ForwardCGCCGACGCAGGTATTCACGGH7-EG-R4RevereTCCAGTCCCTCCAGTTCTGATGATG7GH7CBH-F1ForwardCACCGCTTCGGCTCTTATCGGH7CBH-R1RevereATCGCTGTCTGAGGGCTTCC8GH7CBH-F2ForwardGCACCTTGACCACCGAGACCGH7CBH-R2RevereCTGCCGATGGGACCGAACTTA9GH7CBH-F3ForwardACCGCCTCGGCTCTTATCGGH7CBH-R3RevereCGTCCGTAGAAGGTCTTGTTGC10GH7CBH-F4ForwardGCACCTTGACCACCGAGACCGH7CBH-R4RevereGCCGATGGGACCGAACTTAT11GH10-F1ForwardGCATACCCTTTCGGTTCTCCGH10-R1RevereGGGCTGGCAGTTTCTGTCGT12GH10-F2ForwardGCATACCCTTTCGGTTCTCCGH10-R2RevereTCAACGGCATCCCACTTCAT13GH10-F3ForwardGGAAAGCCAAGAGGAGCGGH10-R3RevereCCCGACCATCAACGACAG14GH10-F4ForwardCAGTTCAGTCCCACCACCGH10-R4RevereACGACAGCATCTCCTCCC15GH10-F5ForwardCTTCACCCTACGGTAACTCGGH10-R5RevereATGACAGCATCTCCTCCC

表2 Q7-31T菌株的RT-PCR反应体系
1.5 基因片段克隆
利用反转录试剂盒进行RT-PCR扩增得到Q7-31T菌株总cDNA,用核酸检测仪检测cDNA产物的浓度和纯度。后利用内参GAPDH(glyceraldehyde-3-phosphate dehydrogenase)按照使用说明的步骤,检测cDNA产物的质量,将PCR产物进行琼脂糖凝胶电泳检测,目的条带大小为496 bp。将cDNA产物-20℃下保存,作为进一步扩增模板。
参考《分子克隆实验指南》[8],根据设计的引物,试验确定最佳PCR扩增反应体系,后利用Touch Down PCR技术[9]进行扩增。Touch Down PCR反应程序:94℃预变性4 min;94℃变性30 s,65~50℃退火30 s,72℃延伸90 s,共30个循环,每个循环降低0.5℃;94℃变性30 s,50℃退火30 s,72℃延伸90 s,共15个循环;72℃延伸7 min。
扩增反应结束后,取5 μL PCR产物在1%的琼脂糖凝胶上电泳,同时加入5 μL的DL2000 DNA Marker,120 V电泳30 min,用凝胶成像系统检测是否有目的条带,并记录。将具有目的条带的PCR产物用购自上海生工生物工程有限公司的SanPrep柱式DNA胶回收试剂盒回收纯化后送至生工生物工程(上海)股份有限公司测序。
1.6 生物信息学分析
对质谱鉴定结果得到4种酶的氨基酸序列进行相关生物信息学分析, Prot-Param在线软件分析氨基酸序列及理化性质,SOPMA在线工具预测蛋白质二级结构,ProtScale Server在线软件分析疏水性/亲水性,NetPhos 2.0 server在线软件分析潜在磷酸化位点,NetNGlyc 1.0在线软件分析糖基化位点,InterProScan在线软件预测功能结构与域,Swiss-Model数据库(http://swissmodel.expasy.org/)预测三级结构等。
2 结果与分析
2.1 菌株植物细胞壁降解酶基因片段的克隆
2.1.1 Q7-31T菌株 Q7-31T菌株产植物细胞壁降解酶具有高效的天然木质纤维素降解活性[10]。其发酵后胞外酶的质谱鉴定,得到关于植物细胞壁降解的7种酶。经统计发现,Q7-31T菌株诱导产生的植物细胞壁降解酶分布在GH5、GH7和GH10 3个家族。其中GH5家族和GH10家族的酶全部为内切酶,GH7家族中的GH7-314酶为内切葡聚糖酶,CBH-C为外切葡聚糖酶。
2.1.2 PCR引物的筛选 经筛选得到可扩增出目的片段的引物,分别为2号、4号、5号、6号、9号、10号、15号7对引物。
2.1.3 基因克隆与测序 通过RT-PCR得到4条植物细胞壁降解酶编码基因部分片段,经NCBI数据库比对后,这4条部分片段与数据库中有关序列相一致(相似度大于或等于99%),其对应登录号分别为gi|345566216、gi|1170138、gi|46241267、gi|1170139,其氨基酸序列与质谱鉴定的结果相一致。
通过基因水平验证,以质谱鉴定结果为依据,最终确定Q7-31T菌株的胞外全酶的植物细胞壁降解相关酶分为3个不同的家族:GH5家族,内切葡聚糖酶;GH7家族,内切葡聚糖酶、外切葡聚糖酶(CBH-C);GH10家族,内切木聚糖酶。
2.2 菌株植物细胞壁降解酶的生物信息学分析
2.2.1 基因序列 GH5家族内切葡聚糖酶GH5-281、GH7家族内切葡聚糖酶GH7-314、外切葡聚糖酶CBH-C和GH10家族内切木聚糖酶GH10-276 4种酶对应的NCBI数据库中的登录号为GH5-281,gi|345566250;GH7-314,gi|1170138;CBH-C,gi|46241268;GH10-276,gi|1170139,相应的进化关系如图1,由于CBH蛋白属于GH7家族,因此GH7-314与CBH-C的亲缘关系较近、遗传差异小,尽管GH5-281与GH10-276聚到一支,但这2种酶的遗传差异较大。利用Prot-Param在线软件,对4种酶的氨基酸序列进行分析得到,氨基酸序列组成及理化性质(表3):4种酶的氨基酸数目为420~515个,其中CBH-C的氨基酸数目高达513个,而GH10-276仅含有385个氨基酸,分子量为44~55 KDa。酸性氨基酸占6%~10%,碱性氨基酸占6%~11%。理论等电点多小于7,GH7家族内切葡聚糖酶理论等电点大于8。

图1 4种酶的进化关系

表3 Q7-31T菌株4种植物细胞壁降解酶序列
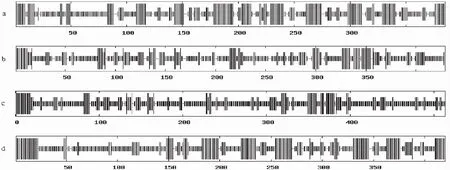
注:a为GH5-281,b为GH7-314,c为CBH-C,d为GH10-276。竖线从长到短依次为α-螺旋、延伸链、β-转角和无规则卷曲。
Note: a, GH5-281; b,GH7-314; c,CBH-C; d, GH10-276. Vertical line from long to short followed by: Alpha helix, Extended strand, Beta turn and Random coil .
图2 Q7-31T菌株4种植物细胞壁降解酶的二级结构
Fig.2 Secondary structure of four kinds of cellulases from strain Q7-31T
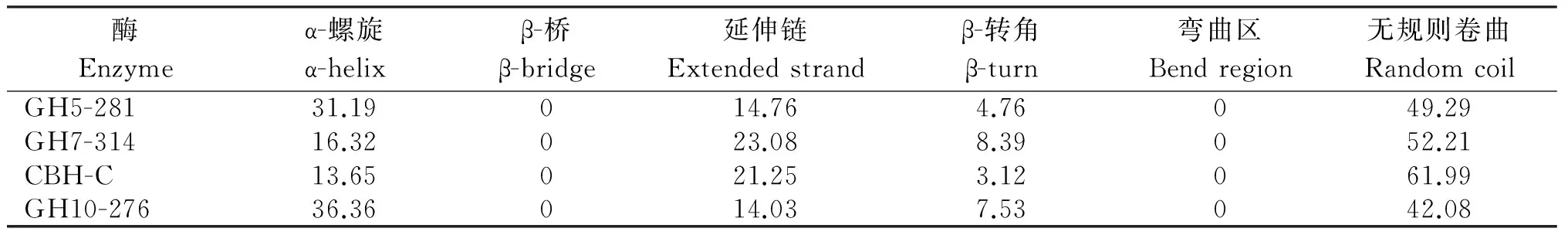
表4 Q7-31T菌株4种植物细胞壁降解酶的二级结构
2.2.2 二级结构 由图2及表4可见,4种酶的二级结构元件均为α-螺旋、延伸链、β-转角和无规则卷曲4种,其中无规则卷曲的比例最高。4种酶中唯一的外切葡聚糖酶CBH-C的无规则卷曲比例高达61.99%,而β-转角的比例却低至3.12%,这与其外切葡聚糖酶的功能存在密切联系。
2.2.3 疏水性/亲水性 用ProtScale Server对率亲环素蛋白氨基酸序列的疏水性/亲水性进行预测,负值越小表示亲水性越强,正值越大表示疏水性越强,介于-0.5~+0.5的为两性氨基酸(图3)。这4种酶的亲水性均大于疏水性,与4种酶均为水解酶,、作用环境为水环境有关。其中CBH-C酶的亲水性明显大于疏水性,与其作用方式为外切有关。

注:a为GH5-281,b为GH7-314,c为CBH-C,d为GH10-276。
Note: a,GH5-281; b,GH7-314; c,CBH-C; d, GH10-276.
图3 Q7-31T菌株4种植物细胞壁降解酶的疏水性/亲水性
Fig.3 Hydrophobicity/Hydrophilicity of four kinds of cellulases from strain Q7-31T
2.2.4 潜在磷酸化位点 分值大于0.5的氨基酸位点是酸化位点,这4种酶在丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)3个氨基酸上均具有潜在的酸化位点(图4)。对4种酶的潜在磷酸化位点进行统计(表5),总体上来说其磷酸化位点总数较多,其中GH5-281和CBH-C的磷酸化位点数分别高达45个和38个,GH7-314、CBH-C和GH10-276丝氨酸上的潜在酸化位点数高于苏氨酸和酪氨酸上的磷酸化位点数,而GH5-281在苏氨酸上的磷酸化位点数则高于丝氨酸和酪氨酸上的磷酸化位点数。
2.2.5 糖基化位点 由图5、表6可见,GH5-281、GH7-314、CBH-C这3种酶均存在1~2个潜在N-糖基化位点,不存在O-糖基化位点,而GH10-276纤维素降解辅助酶并不存在潜在的糖基化位点。
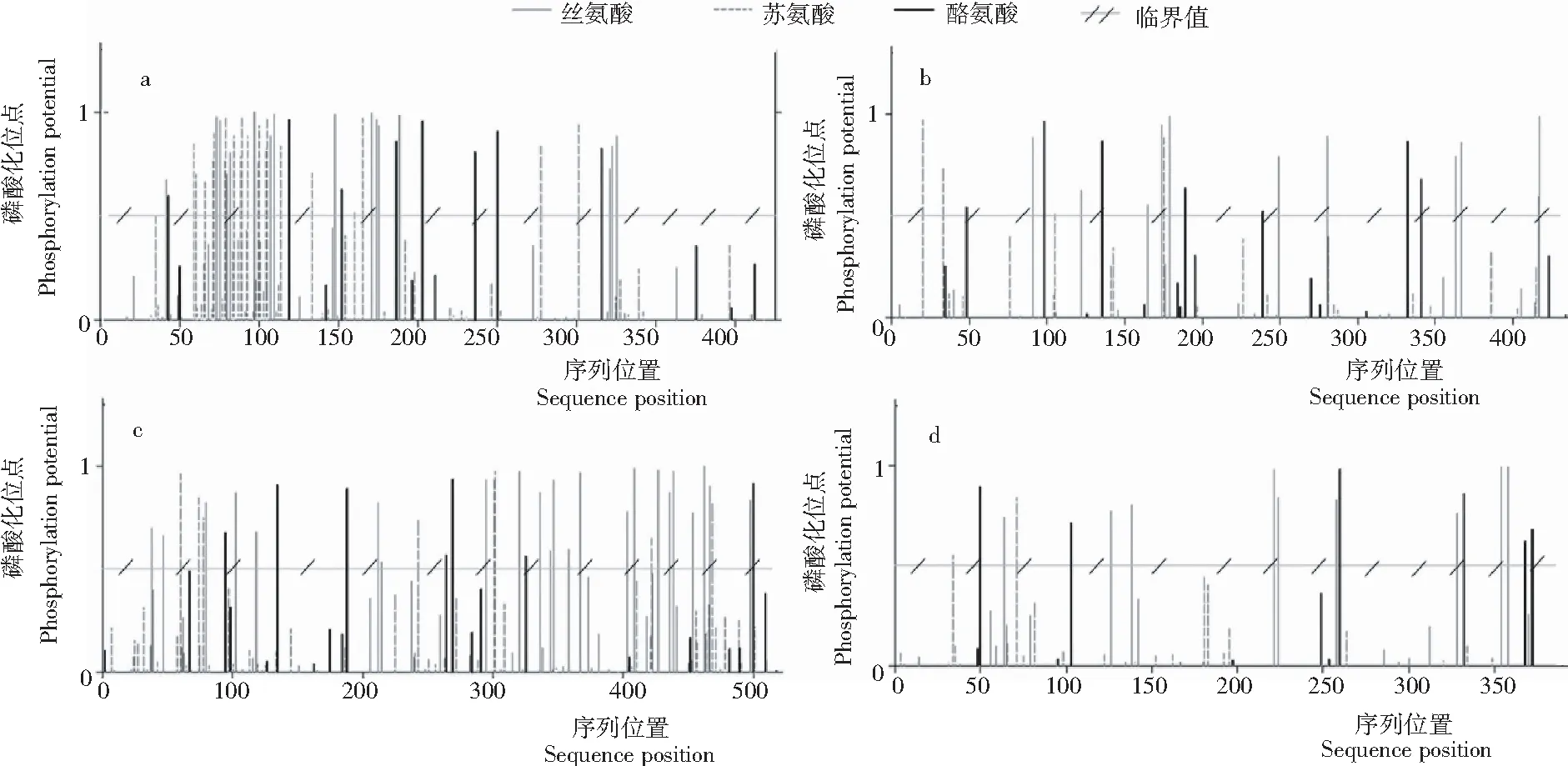
注:a,GH5-281;b,GH7-314;c,CBH-C;d,GH10-276。
Note: a,GH5-281; b, GH7-314; c,CBH-C; d,GH10-276.
图4 Q7-31T菌株4种植物细胞壁降解酶潜在的磷酸化位点
Fig.4 Potential phosphorylation sites of four kinds of cellulases from strain Q7-31T
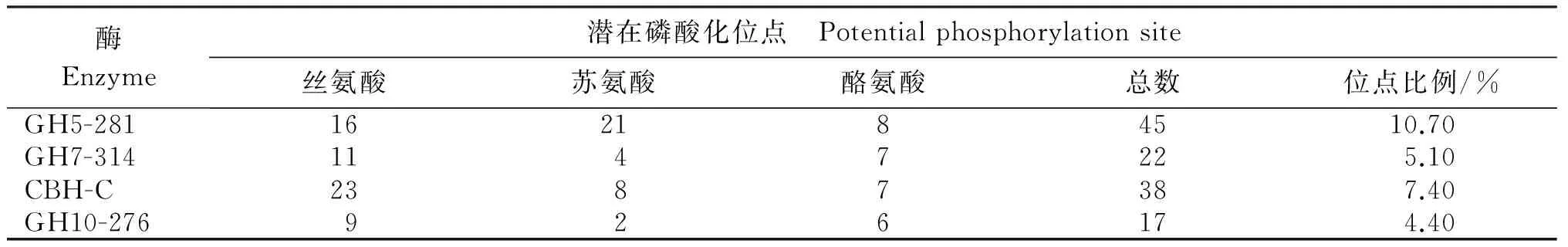
表5 Q7-31T菌株4种植物细胞壁降解酶潜在的磷酸化位点
注:位点比例为潜在磷酸化位点占蛋白质总氨基酸数的比例。
Note: The number accounting for potential phosphorylation sites in the protein of the total number of amino acids ratio.

注:a,GH5-281;b,GH7-314;c,CBH-C;d,GH10-276。
Note: a,GH5-281; b,GH7-314; c,CBH-C; d, GH10-276.
图5 Q7-31T菌株4种植物细胞壁降解酶潜在的糖基化位点
Fig.5 Potential glycosylation sites of four kinds of cellulases from strain Q7-31T
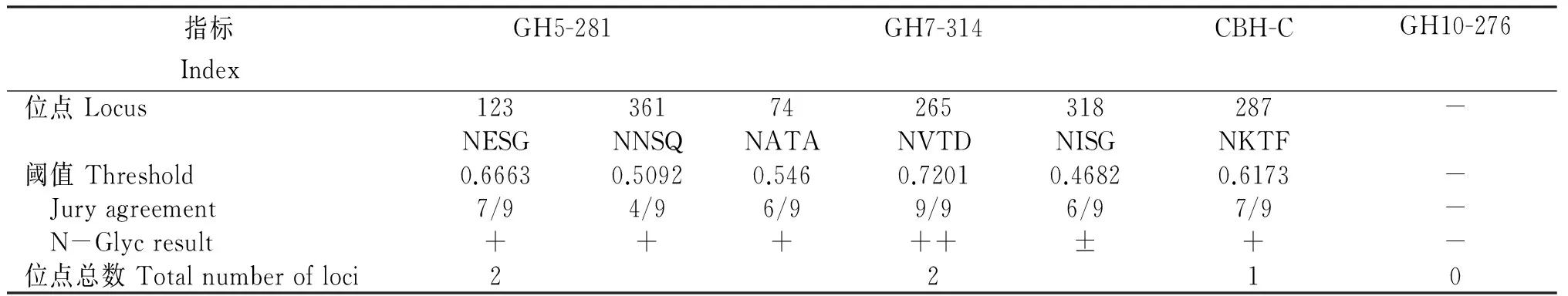
表6 Q7-31T菌株4种植物细胞壁降解酶糖基化位点
注:++,预测结果可能性极高;+,预测结果可能性高;±,预测结果存在一定的可能性;-,预测没有糖基化位点。位点总数:阈值>0.5的位点总数。
Note: + +,high probability prediction; +, high probability prediction; ±,There is a certain possibility that prediction; -,no predicted glycosylation sites. Total points: threshold > 0.5.
2.2.6 功能结构域 由图6可见,GH5-281的第18位至第54位为纤维素结合域,第115位至第416位为催化域和家族识别序列;GH7-314的第20位至第417位为催化域和家族识别序列,没有纤维素结合域;CBH-C的第477位至第513位为纤维素结合域,第18位至第453位为催化域和家族识别序列;GH10-276的第17位至第53位为纤维素结合域,第88位至第385位为催化域和家族识别序列。家族识别序列表示,GH5-281属于GH5蛋白质家族,GH7-314、CBH-C属于GH7蛋白质家族,GH10-276属于GH10蛋白质家族,这一结果也同质谱鉴定的结果相同。

图6 Q7-31T菌株4种植物细胞壁降解酶的功能结构域
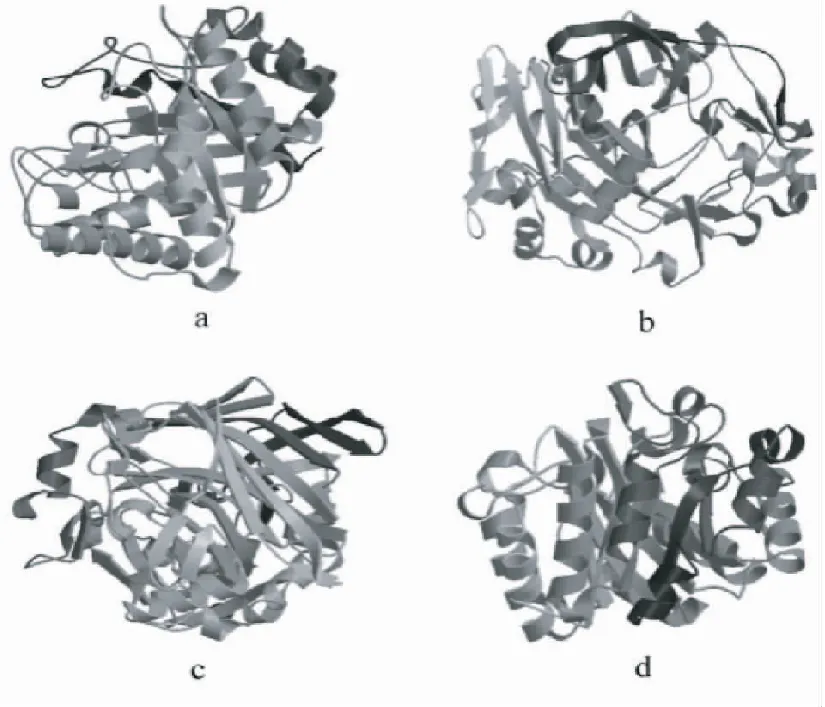
注:a,GH5-281(gi|23200107);b,GH7-314(gi|2624625);c,CBH-C(gi|683437155);d,GH10-276(gi|3915312)。括号内为使用的模板。
Note: a,GH5-281 (gi|23200107); b, GH7-314 (gi|2624625); c,CBH-C (gi|683437155); d,GH10-276 (gi|3915312). The templates are in brackets.
图7 Q7-31T菌株4种植物细胞壁降解酶的三级结构
Fig.7 Tertiary structures of four kinds of cellulases from strain Q7-31T
2.2.7 三级结构 由图7可见,4种酶的空间构型均为C字形,即存在中空结构,酶的比表面积大。
3 结论与讨论
3.1 少量的糖基化位点
对4种酶的糖基化位点分析发现,GH10家族内切酶不含糖基化位点,其余3种酶均含1~2个糖基化位点。蛋白酶的酶切位点大多在连接区(linker)附近,而外切酶连接区糖基化,内切酶连接区未糖基化,外切酶的连接区中含有一些可能的蛋白酶切位点,而内切酶的连接区中无,其与防止蛋白酶切有着密切的联系[4]。本研究发现,在CBH-C酶的连接区中存在糖基化位点,这与上述理论相符。然而另外2种内切酶中含有糖基化位点,且部分糖基化位点位于催化结构域(catalytic domain,CD)上,这与高培基[4]的发现不符,糖基化位点可能存在其他方面的作用,其作用机理有待进一步研究。
3.2 高比例的催化结构域
3种纤维素降解酶均含CD,GH5家族内切酶和GH7家族外切酶均含纤维素结合结构域(cellulose binding domain,CBD)和连接区,而GH7家族内切酶不含CBD。CBD是一面亲水,另一面疏水的楔形结构,能插入和分开纤维素的结晶区,在其吸附于纤维素分子链表面后,酶分子连接到纤维素上,可能提高底物表面有效酶的浓度,或可能促进纤维素表面单个葡聚糖链的溶解,具有疏解纤维素链的作用[3],降低和打破纤维素内非共价连接的氢键网络[11]。汪天虹[12]、高培基等[4]的报道证实这一理论。虽单一的CD或CBD仍然可表现出水解和吸附能力,但任何单一或者两个结构域等物质的量的混合液水解或吸附能力均远低于其相应的全酶分子[4]。当CBD和CD同时存在,且存在连接区时,在植物细胞壁降解酶分子折叠过程中,其三维构象发生改变,影响整个酶的活性[4]。
本研究中Q7-31T菌株中CBH-C酶的CBD位于C端,CD位于N端,这可能与酶分子的空间结构和协同作用存在着密切的联系。肖志壮[13]对EGI酶C端的CBD切除以后,在N端加入CBD,进行重组表达后发现,纤维素降解活性显著下降,这一研究也对CBD的位置与酶分子的空间结构和协同作用存在密切联系这一理论提供一定支持。GH7家族内切酶不含CBD,而含有高比例的CD,这可能与其具有更高效、专一的催化作用有关。
3.3 多变的三维构象
根据植物细胞壁降解酶分子的空间结构,高培基等[4]提出了内、外切植物细胞壁降解酶与底物作用时底物专一性不同的运动模式:CBH活性部位呈桶状,只能允许单根纤维分子链进入,EG活性部位为一开放的裂隙,可使酶分子镶在纤维表面上,进行随机性内切,水解出纤维寡糖。本研究证实了这一运动模式的合理性。本研究对4种酶进行三级结构的模拟后发现,4种酶均呈C字形,中间有一凹槽,结构域分析发现,4种酶的CD中均含有丰富的色氨酸,色氨酸很有可能与酶和纤维素的结合有关[14]。同时,二级结构预测结果表明,4种酶中存在大量的无规卷曲,酶分子呈现多变的三维构象,更有利于酶与底物结合和作用。
3.4 大量的磷酸化位点
比较4种酶潜在的磷酸化位点数,总体上来说其磷酸化位点总数均很多,而且丝氨酸上的潜在磷酸化位点数普遍高于苏氨酸和酪氨酸上的磷酸化位点数。一般来说,多肽链中的氨基酸潜在的磷酸化位点越多,发挥更多功能的可能性越大[15]。大量磷酸化位点的存在,为4种酶发挥更多作用,表现更高效的活性提供基础。
3.5 高效的协同作用方式
木质纤维素通常含有木质素、半纤维素和纤维素,是一个致密的结构。本研究的质谱鉴定结果表明,Q7-31T菌株胞外酶中含有大量GH10家族的内切木聚糖酶,用于水解木质素。结构功能域分析结果表明,GH5家族的内切酶含有CBD,而GH7家族的内切酶不含CBD。分析其作用方式:GH5家族内切酶的CBD将纤维素链疏解后,GH5家族和GH7家族内切酶的CD进一步降解纤维素链。在水解木质纤维素时,纤维素酶和木聚糖酶能互相改善彼此性能,因为木质纤维素中的木聚糖和纤维素相互覆盖[16]。
结合已有的相关纤维素降解理论和本研究对Q7-31T菌株植物细胞壁降解酶系的分析,对Q7-31T菌株植物细胞壁降解酶降解植物细胞壁的作用方式进行预测:首先,GH10家族的木聚糖酶结合木质纤维素降解表面的木质素,打开缺口;随后GH5家族内切酶的CBD将纤维素链疏解后,GH5家族和GH7家族内切酶的CD以随机作用的方式将纤维素分子切割成短纤维素链、纤维寡糖或葡萄糖;然后,GH7家族外切葡聚糖酶从纤维素链、纤维寡糖末端进行切割,形成纤维二糖;最后,由β-葡聚糖苷酶将纤维二糖切割成为葡萄糖。整个过程同时且反复地进行。
对镰刀菌属Q7-31T菌株胞外全酶的质谱鉴定结果进行基因水平的验证,将其植物细胞壁降解相关酶归为GH5、GH7和GH10 3大家族,并根据作用特点分为内切葡聚糖酶:GH5家族、GH7家族;外切葡聚糖酶:GH7家族;内切木聚糖酶:GH10家族。少量的糖基化位点、高比例的催化结构域、多变的三维构象、大量的磷酸化位点与高效的协同作用方式可能决定Q7-31T菌株的植物细胞壁降解酶对植物细胞壁的高效降解。
[1] 张华锋.纤维素酶研究进展[J].现代农业科学,2009,16(6):25-26,39.
[2] 汪维云,朱金华,吴守一.纤维素科学及纤维素酶的研究进展[J].江苏理工大学学报,1998,19(3):20-28.
[3] 高凤菊,李春香.真菌与细菌纤维素酶研究进展[J].唐山师范学院学报,2005,27(2):7-10.
[4] 高培基.纤维素酶降解机制及纤维素酶分子结构与功能研究进展[J].自然科学进展,2003,13(1):21-29.
[5] Lenting H B M,Warmoeskerken M M C G.Mechanism of interaction between cellulase action and applied shear force,an hypothesis[J].Journal of Biotechnology, 2001,89(2):217-226.
[6] Henrissat B.Cellulases and their interaction with cellulose[J].Cellulose,1994(1):169-196.
[7] Eveleigh D,Mandels M,Andreotti R,et al. Measurement of saccharifying cellulose[J].Biotechnology For Biofuels,2009(2):21-23.
[8] Sambrook J,Russell D.分子克隆实验指南[M].3版.北京:科学出版社,2002.
[9] 王 楠,王养民,张 斌.普通PCR与TD-PCR在临床医学科研中应用价值的比较[J].临床军医杂志,2008,36(2):280-282.
[10] Xie Z L,Gao H Y,Zhang Q,et al.Cloning of a novel xylanase gene from a newly isolated Fusarium sp.q7-31and its expression in escherichia coli[J].Brazilian Journal of Microbiology,2012,43(1):405-417.
[11] 王禄山,张玉忠,高培基.纤维二糖水解酶I吸附结构域的新功能[J].中国科学C辑:生命科学,2008,38(7):678-686.
[12] 汪天虹,邹玉霞,石屹峰,等.微紫青霉CBHI酶纤维素结合结构域在大肠杆菌中的分泌型表达及性质研究[J].中国生物化学与分子生物学报,2000,16(5):644-649.
[13] 肖志壮.瑞氏木霉内切葡聚酶基因的亚克隆及表达[D].山东:山东大学,2001.
[14] 阎伯旭,孙迎庆,高培基.有限酶切拟康氏木霉植物细胞壁降解酶分子研究其结构域的结构与功能[J].纤维素科学与技术,1998,6(3):1-9.
[15] 梁前进,王鹏程,白燕荣.蛋白质磷酸化修饰研究进展[J].科技导报,2012,30(31):73-79.
[16] Junhua Zhang,Liisa Viikari.Impact of xylan on synergistic effects of xylanases and cellulases in enzymatic hydrolysis of lignocelluloses [J].Appl. Biochem. Biotechnol.,2014,174:1393-1402.
(责任编辑: 刘忠丽)
Structure of Plant Cell Wall Degrading Enzymes fromFusariumStrain Q7-31T
ZHAO Lianzheng1, XIE Zhanling1,2*, JIA Xianqing1
(1.CollegeofEco-EnvironmentalEngineering,QinghaiUniversity,Xining,Qinghai810016; 2.NationalKeyLaboratoryBreedingBaseforInnovationandUtilizationofPlateauCropGermplasm,Xining,Qinghai810016,China)
For exploring the mechanism of high-efficiency plant cell wall degradation process based on plant cell wall degrading enzymes fromFusariumstrain Q7-31T, for the gene cloning and biological analysis, the methods respectively were PCR amplification and some bioinformatic softwares such as Prot-Param, SOPMA and ProtScale Server. Results: The plant cell wall degrading enzymes in Q7-31T are classified as: GH5 family endoglucanase, GH7 family endoglucanase, GH7 family exo-glucanase and GH10 family endoxylanase, which are consistent with mass spectrometry. The enzymes are medium molecular size, and the secondary structure consists of four elements:α-helix, extended strand,β-turn and random coil, of which random coil is most abundant; four enzyme classes are hydrophilic enzymes, and have higher proportion of phosphorylation sites. There are 1~2 glycosylation sites. Four enzymes are present in a higher proportion of catalytic domains and the tertiary structure of a hollow “C”shape. Conclusion: A small number of glycosylation sites, high proportion of catalytic domains, changeable three-dimensional conformations, large number of phosphorylation sites and high-efficiency synergism probably determine the high-efficiency degradation of plant cell wall degrading enzymes in strain Q7-31T.
Fusarium; plant cell wall degrading enzymes; structure
2014-11-01; 2015-04-10修回
国家自然科学基金资助项目“Q7-31植物细胞壁降解酶系组成及协同作用研究”(31260021)
赵联正(1993-),男,在读本科,专业方向:生物技术。E-mail:zhaolianzheng114@163.com
*通讯作者:谢占玲(1966-),女,教授,博士,从事真菌及酶学研究。E-mail:xiezhanling2012@126.com
1001-3601(2015)05-0256-0138-08
Q932
A

