三七根部总RNA不同提取方法的比较
郑锐东, 姚啟聪, 廖 鹏, 吴漫晔
(1.揭阳职业技术学院 实训中心, 广东 揭阳 522000; 2.广州基迪奥生物科技有限公司, 广东 广州 510006; 3.揭阳职业技术学院 生物工程系, 广东 揭阳 522000)
三七根部总RNA不同提取方法的比较
郑锐东1, 姚啟聪2,3, 廖 鹏3, 吴漫晔3
(1.揭阳职业技术学院 实训中心, 广东 揭阳 522000; 2.广州基迪奥生物科技有限公司, 广东 广州 510006; 3.揭阳职业技术学院 生物工程系, 广东 揭阳 522000)
为探明三七根部总RNA的最佳提取方法,获取高质量RNA,选取三七根部为材料,比较Trizol试剂法、CTAB法、改良Trizol法和试剂盒法提取三七根部总RNA的质量。结果表明:4种方法提取三七根部RNA效果不同,其中以改良Trizol法提取RNA的质量最高,其RNA的OD260/OD280为2.00,OD260/OD230为1.90,28S∶18S为1.9,RIN值为7.4,质量浓度为386 μg/μL。而另外3种方法易出现样品降解、盐离子残留。结论:改良Trizol法适用于三七根部总RNA的提取。
三七根部; RNA提取; 改良Trizol法
三七(Panaxnotoginseng)又名田七,五加科人参属植物[1],药用历史悠久,是我国名贵的特产中药材,仅产于我国滇桂西南部,素有参中之王美誉[2]。三七具有保护心血管、增强机体免疫力、消炎、抗肿瘤、抗衰老等一系列药理作用[3]。随着对三七的深入研究,其更多的药理作用及临床应用也越来越受到关注。一些学者已开始关注三七的微观层次,利用分子生物学技术研究其抗病虫害基因、有效成分合成调控基因已成为三七的研究趋势[4-5]。进一步研究三七分子生物学作用,提取三七高质量RNA是试验关键。目前,国内外学者开展了大量关于三七分子生物学方面的研究并取得成效,赵洋等[6]采用CTAB法、天根试剂盒法、普通Trizol法、改良Trizol法对三七种子总RNA进行提取比较表明,改良Trizol法提取的三七种子RNA纯度好、浓度高,质量符合后续的cDNA文库构建等分子生物学研究的要求;陈莉等[7]比较利用改进的异硫氰酸胍一步法、异硫氰酸胍高盐法、CTAB法和Thomas’RNA提取法等4种方法提取三七根茎2个部位总RNA的可行性表明,改进的异硫氰酸胍一步法和异硫氰酸胍高盐法能有效地抑制酚类物质、多糖及皂苷等次级代谢产物对总RNA的影响,可从三七根茎中获得质量高、完整性较好的总RNA。但比较Trizol试剂、CTAB、改良Trizol和试剂盒4种方法提取三七根部总RNA的质量尚未见报道,故笔者利用此4种方法提取三七根部总RNA,以期解决因三七细胞成分的复杂性、次级代谢产物的多样性制约其提取高质量RNA的难题,探明三七根部总RNA的最佳提取方法,为其相关分子生物学研究提供参考。
1 材料与方法
1.1 材料
1.1.1 三七 四年生,取自云南文山平坝镇。用清水冲洗表面泥土后用RNA-Free water冲洗1次,置于消毒滤纸上晾干,液氮速冻,-80℃保存。
1.1.2 试剂 Trizol购自Invitrogen公司,CTAB缓冲液(2% CTAB、2.5%聚乙烯吡咯烷酮PVP-40,100 mmol/L Tris-HCl pH8.0,25 mmol/L EDTA,2%β-巯基乙醇,2 mol/L NaCl),以上除NaCl为国产分析纯外,其余试剂均购自Sigma公司,去多糖多酚试剂盒、氯仿、酚∶氯仿(25∶24,pH5.2)、无水乙醇、异丙醇、75%乙醇、3 mol/L乙酸钠、β-巯基乙醇、1%PVP、RNA-Free water(104 kPa,121℃灭菌45 min)购自Tiangen公司,以上试剂均用RNA-Free water配制。
1.1.3 仪器设备 4℃离心机、研钵(180℃烘4 h)、移液枪、RNA-Free离心管(购自Axygen公司)、RNA-Free枪头、凝胶成像系统、毛细管电泳系统、NanoDrop 2000,Agilent 2100生物分析仪等。
1.2 RNA提取方法
1.2.1 Trizol法[8]取0.1 g材料置于研钵中,在液氮环境下研磨成粉末,并转移至1.5 mL离心管中,加1 mL Trizol充分混匀,15~25℃静置10 min,使核酸蛋白复合物完全分离。再加入200 μL氯仿充分混匀,4℃ 12 000 r/min离心10 min。取上清液,加入等体积酚仿(酚∶氯仿=25∶24)混匀,4℃ 12 000 r/min离心10 min。取上清液加入等体积的氯仿充分混匀,4℃ 12 000 r/min离心10 min。取上清液,加入等体积异丙醇,-20℃沉淀1 h,4℃ 12 000 r/min离心10 min。弃上清,加 700 μL 75%乙醇,洗涤沉淀,重复1次,用4℃ 12 000 r/min离心5 min。弃上清,甩一下后吸干乙醇,真空干燥2 min,加30 μL RNA-Free 双纯水,室温溶解10 min,-80℃保存备用。
1.2.2 CTAB法[9]取0.1 g材料置于研钵中,在液氮环境下研磨至粉末,并转移到1.5 mL离心管中,加600 μL预热CTAB(预先加入2%β-巯基乙醇)充分混匀,65℃水浴30 min,4℃ 12 000 r/min离心10 min。取上清加入等体积酚∶氯仿∶异戊醇(25∶24∶1)溶液,混匀,4℃ 12 000 r/min离心10 min。取上清重复上一步。取上清加入等体积氯仿∶异戊醇(24∶1)溶液,4℃ 12 000 r/min离心10 min。取上清加入等体积异丙醇,沉淀后4℃ 12 000 r/min离心10 min。加700 μL 75%乙醇,洗涤沉淀,重复1次,4℃ 12 000 r/min离心5 min,弃上清。甩一下后吸干乙醇,真空干燥 2 min,加30 μL RNA-Free water,室温溶解10 min ,-80℃保存备用。
1.2.3 改良Trizol法[8、10]取0.1 g材料置于研钵中,在液氮环境下研磨成粉末,并转移至1.5 mL离心管中,加1 μL Trizol充分混匀,室温静置10 min;4℃ 12 000 r/min离心10 min;取上清,加入200 μL氯仿、35 μL 3 mol/L乙酸钠、15 μL β-巯基乙醇、10 μL 1%PVP,充分混匀,冰浴15 min;4℃ 12 000 r/min离心10 min;取上清并加入等体积异丙醇、200 μL 3 mol/L乙酸钠,-20℃沉淀1 h,4℃ 12 000 r/min离心10 min弃上清;加1 mL 75%乙醇洗涤沉淀,重复1次,4℃ 12 000 r/min 离心5 min,弃上清。甩一下后采用枪头小心吸干,尽量减少乙醇残留,真空干燥2 min,加30 μL RNA-Free 双纯水,室温溶解5 min,-80℃保存备用。
1.2.4 试剂盒法[11]取500 μL裂解液RL(预先加入β-巯基乙醇),转入1.5 mL离心管中。液氮中研磨0.1 g材料成粉末后转入上述离心管中,剧烈振荡20 s,充分裂解,室温静置5 min。将裂解物12 000 r/min离心2 min,取上清并转移至SC过滤柱上12 000 r/min离心2 min,精确测量裂解物(上清)体积,加0.5体积无水乙醇,混匀。将混合物加入吸附柱CR3中,12 000 r/min离心15 s,去除废液;加350 μL去蛋白液RW1,12 000 r/min离心15 s,去除废液;加入80 μL DNase I工作液,室温静置15 min,加350 μL去蛋白液RW1,12 000 r/min离心15 s,去除废液。加入350 μL漂洗液RW(使用前加入60 mL无水乙醇),12 000 r/min离心15 s,去除废液;加入500 μL漂洗液RW,重复1次。将CR3置于空收集管,12 000 r/min离心2 min,去除漂洗液;取出CR3,放入RNase free离心管中,在吸附膜的中间部位加30 μL RNase free water,室温放置2 min,12 000 r/min离心1 min,-80℃保存备用。
1.3 RNA 质量及完整性检测
1.3.1 琼脂糖凝胶电泳 称取0.3 g琼脂糖加入30 mL TAE,加热熔化琼脂糖,待温度下降到60℃,加入3 μL EtBr,把溶液倒入制胶板中冷却,在电泳槽中加入500 mL电泳液,分别上样1 μL RNA 样品,100 V稳压电泳15 min,在凝胶成像系统下观察,拍照。
1.3.2 RNA完整性检测 分别取不同提取方法中的1 μL RNA溶液在NanoDrop 2000检测浓度及在260/280、260/230中的吸光度。
1.3.3 毛细管电泳检测 取4种不同方法中RNA完整性最优的RNA进行毛细管电泳,Agilent 2100生物分析仪检测RIN及28S∶18S。
2 结果与分析
2.1 不同方法提取三七根部总RNA完整性
由图1可见,常规Trizol法可以提取18S、28S和5S,但5S非常亮,说明RNA大部分已降解;28S和18S两者荧光强度差别小,未呈明显的2倍差异关系,而且出现大片段条带,说明存在DNA污染,总体上RNA完整性较差。改良Trizol法提取的总RNA,28S和18S谱带整齐清晰,带型无拖尾和弥散,亮度接近明显的2∶1关系,而且5S条带较弱,表明RNA基本无降解,结构完整,加之点样孔中无亮带,杂质少,表明该法提取的RNA质量优良。传统的CTAB法提取繁琐而且需要过夜沉淀, RNA降解的风险增加,故提取的RNA 5S非常亮,未出现28S和18S,证明RNA全部降解,表明此方法不适合参试材料RNA的提取。试剂盒提取法从电泳图上看基本无28S和18S,5S也较弱,RNA已经全部降解。因为RAN过柱子时将小片段的RNA分子已经全部过滤,故5S也较弱。因此,此方法也不适合三七根部总RNA的提取。综合上述4种方法,改良Trizol法提取的RAN质量明显优于其他3种提取方法,由此初步地确立改良Trizol法为提取三七根部总RNA首选方案。
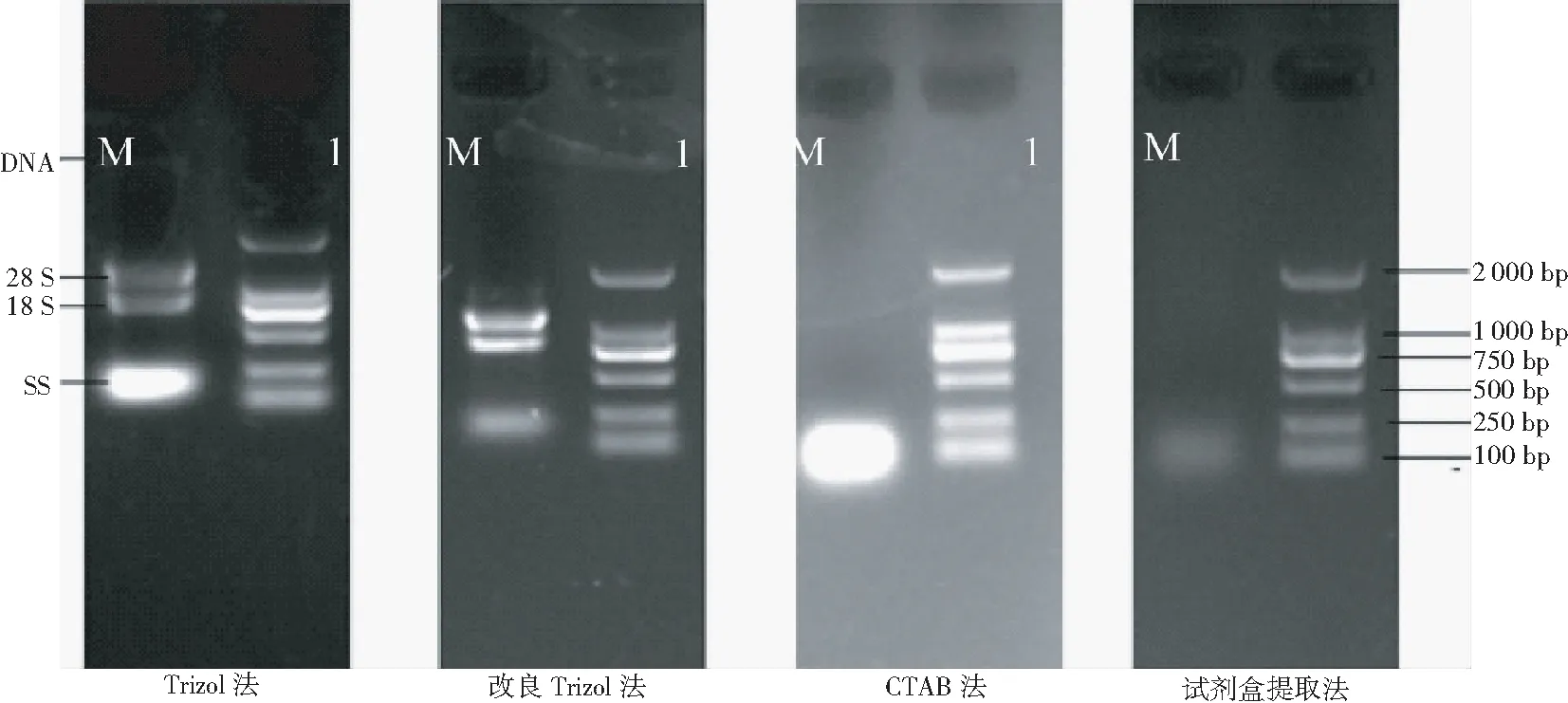
注(Note):M:DL2000 Marker;Note1,PanaxnotoginsengRNA.
图1 不同方法提取三七根总RNA的电泳图谱
Fig.1 The total RNA electrophoretogram of different extraction methods fromP.pseudoginsengroot
2.2 不同方法提取三七根部总RNA浓度和纯度
由表1可知,改良Trizol法、CTAB法提取的RNA总量较高。但从OD260/OD280的比值看,Trizol法为1.59<1.80,表明提取物中含有多糖多酚污染,导致RNA获得率降低。CTAB法和试剂盒法的OD260/OD280比值偏高,说明样品存在降解。从OD260/OD230的比值来看,Trizol法、CTAB法和柱子法均小于1.80,说明还有盐离子残留。而改良Trizol法的OD260/OD280和OD260/OD230均在1.80~2.00,说明无蛋白和次生代谢产物污染,总量和浓度均符合要求。结合电泳图,改良Trizol法是最适宜三七根部组织RNA提取的方法。

表1 不同方法提取三七根部总RNA的浓度和纯度

图2 三七根部RNA的完整性与28S、18 S比值
Fig.2 The integrity and ratios of 28S∶18S of the RNA which meets the demand for transcriptome analysis
2.3 毛细管电泳分析RNA用于高通量测序质量检测
比较4种提取RNA方法结果,选择改良Trizol法提取三七根部的RNA用于转录组测序质量检测。如图2所示,RIN值为7.4,28S∶18S为1.9,浓度为386 μg/μL,表明,改良Trizol法提取的RNA符合进行RNA-sep等高通量测序要求。
3 结论与讨论
RNA本身不稳定,易降解。此外,不同植物种类及同种植物不同组织内部物质组分、含量有较大差异,不同部位代谢产物差异也非常显著,其RNA提取方法也不尽相同[12]。因此,要获得高质量RNA需要不断地摸索和优化条件。特别是成熟三七根部中含有大量的酚类、多糖类及其他代谢产物,其中多糖类物质在研磨过程中会包含RNA形成沉淀[13-14];酚类物质易被氧化成醌,并与RNA发生不可逆结合,形成褐化效应[15],影响RNA的提取。Trizol法提取总RNA时,溶液中酚类物质容易被氧化成醌,后者能与RNA结合,直接影响RNA的提取。CTAB是一种阳离子去污剂,可有助于细胞裂解并能从低离子强度溶液中沉淀酸性多聚糖和核酸的特性。而在高离子强度溶液环境中,由于溶解度差异,CTAB与多聚糖、蛋白形成沉淀,但核酸仍可通过有机溶剂抽提,去除酚类、蛋白等杂质后加乙醇即可分离出核酸[16-17]。试剂盒法提取RNA时先用异硫氰酸胍/酚裂解细胞,同时使RNA酶失活,然后RNA在高盐环境下选择性吸附于离心柱内硅基质膜,通过多次快速漂洗、离心,除去蛋白等杂质,最后利用RNAase free water洗脱RNA[18]。但根据分析结果,上述3种方法并不适合三七根部RNA提取。改良Trizol法中的PVP因具有很强的酚螯合能力,且β-巯基乙醇具有强还原性,双重作用能有效防止酚类物质被氧化成醌进而与RNA结合。同时,PVP为水溶性,容易通过抽提除去[19],故改良Trizol法能最大程度地简化操作程序,分离纯化出完整性较好的总RNA。此法中加入试剂的作用机理与赵洋等[6]提到的方法原理有相似之处,结果也进一步验证了其在三七根部总RNA提取中的可靠性。
与其他3种方法相比,改良Trizol法能有效去除提取过程中残留的β-巯基乙醇、异硫氰酸胍及三七的酚、糖类物质,提取的总RNA纯度高,完整性好,可用于进一步的RT-PCR和构建cDNA文库等分子操作,是三七根部总RNA提取最适宜的方法。
[1] 中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1983:1024-1025.
[2] 王海燕, 容 蓉, 田景振.三七活性成分药理作用及临床应用概述[J].山东中医药大学学报,2014,38(2):178.
[3] 甘 雨, 徐惠波, 孙晓波.三七总皂苷的药理作用研究进展[J].时珍国医国药,2007,18(5):1251-1252.
[4] 赵胜军.高羊茅耐盐基因工程育种及耐盐植物胁迫相关基因NHX|TaPOD|TaPOX的克隆、表达及功能分析[D].济南:山东大学,2007.
[5] 王春晖,赵云雷,王红梅,等.适用于转录组测序的棉花幼根总RNA提取方法筛选[J].棉花学报,2013,25(4):372.
[6] 赵 洋,段承俐.三七种子总RNA提取方法的比较[J].西南农业学报,2013,26(1):42-46.
[7] 陈 莉,朱 华,李 坤,等.三七总RNA提取方法的对比研究[J].生物技术通讯,2005,16(5):428-430.
[8] 李 苗,李国旗.罗布麻总RNA提取方法比较研究[J].北方园艺, 2014(11):93-96.
[9] 赖 来.农杆菌介导的MADS-box基因转化黄瓜初步研究[D].上海:上海交通大学,2007.
[10] 陈 静,高 飞,周宜君,等.改良Trizol 法提取高质量蒙古沙冬青总RNA[J].生物技术通报, 2013(10):88.
[11] 罗 兵.甘蓝SRK-SCR相互作用研究及作用强度与酵母生长关系模型的构建[D].重庆:西南大学,2011.
[12] 田 伟,田义轲,王彩虹,等.苹果组织总RNA提取方法的比较研究[J].青岛农业大学学报,2010,27(2):122-125.
[13] 李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-38.
[14] Lewinsohn E, Steele C L, Croteau R. Simple isolation of functional RNA from woody stems of gymnosperms[J].Plant Mol Biol Reptr,1994,12:20-25.
[15] Lessard P, Decroocq V, Thomas M, et al. Extraction of RNA, cloning and subtractive Hybridization[C]. Clark MS. Plant molecular biology: A laboratory manual. New York: Springer, 1997:154-222.
[16] 刘晓菊,洪海波,李 敏,等.改良CTAB法提取核桃总RNA试验[J].山东农业科学,2008(1):97-99.
[17] 赖晓鸥.人工栽培黄花蒿单株样本青蒿素含量测定方法的优化与遗传多态性的分析研究[D].成都:四川师范大学,2007.
[18] 李 玲.miRNA128-b在NSCLC中调节EGFR的表达[D].济南:山东省医学科学院,2010.
[19] 胡 薇,白 石,祝 涛,等.人参根组织RNA提取方法的研究与优化[J].吉林农业大学学报,2010,32(5):505-508.
(责任编辑: 刘忠丽)
Comparison of Different Extraction Methods of Total RNA fromPanaxpseudoginsengRoot
ZHENG Ruidong1, YAO Qicong2,3, LIAO Peng3, WU Manye3
(1.TrainingCenter,JieyangVocationalandTechnicalCollege,Jieyang,Guangdong522000; 2.GuangzhouGeneDenovoBiologicalTechnologyCo.,Ltd.,Guangzhou,Guangdong510006;3.BioengineeringDepartment,JieyangVocationalandTechnicalCollege,Jieyang,Guangdong522000,China)
In order to obtain efficient extraction method and high quality RNA fromP.pseudoginsengroot, Comparison of Trizol method, CTAB method, modified Trizol method and isolation kit method for total RNA extraction from root ofP.pseudoginsengwas conducted. Results: The four methods were of various extraction effects, of which, the modified Trizol method with 2.00 OD260/OD280, 1.90 OD260/OD230, 1.9 28S∶18S, 7.4 RIN, 386 μg/μL mass concentration was the best. The other three methods easily lead to sample degradation or saltion residues. Conclusion: The modified Trizol method is an efficient extraction method of RNA fromP.pseudoginsengroot.
Panaxpseudoginsengroot; RNA extraction; modified Trizol method
2014-11-09; 2015-04-15修回
郑锐东(1982-),男,讲师,从事生物工程教学与研究。E-mail:superzrd@163.com
1001-3601(2015)05-0268-0183-04
S567.23+6
A

