吡拉格雷钠对氧糖剥夺/复氧后星形胶质细胞水肿及AQP4表达的影响
许淑红,尹茂山,吴玉林
(1.中国药科大学药学院,江苏南京 211198;2.济南大学山东省医学科学院医学与生命科学学院,山东济南 250200;3.山东省医学科学院药物研究所,山东 济南 250062)
脑水肿是缺血性脑卒中、颅脑创伤等众多神经系统疾病共同的病理过程[1]。脑组织的进行性水肿使颅内压升高,脑的血流量减少,是导致脑功能障碍和死亡的主要原因之一。水通道蛋白4(aquaporin,AQP4)是膜水通道蛋白家族的一员,在脑组织中广泛表达,是控制水出脑组织的通道,在脑组织水平衡、星形细胞迁移、神经兴奋及炎症等方面均起着重要作用[2]。大量研究[2-3]表明,AQP4 与脑水肿关系密切,AQP4在星形胶质细胞周足处表达明显,调控水分子出入脑组织,因此在脑水肿的形成和消退的各个阶段起着重要作用,参与了多种疾病所引起的脑水肿的病理过程。进一步研究[4-6]显示,AQP4定位于星形胶质细胞(astrocyte,Ac)上,被发现在脑水肿的形成中能明显促进Ac的肿胀,AQP4作为一个潜在的药物作用靶点成为预防和治疗脑水肿的研究热点之一。脑水肿形成的因素很多,其中血小板功能异常是参与脑血栓形成的重要因素,与脑水肿关系密切。奥扎格雷钠是TXA2合成酶抑制剂,抑制TXA2的生成,抑制血小板聚集,同时促进PGI2的产生,从而使凝血过程受到有效抑制,达到改善微循环,增加脑血液供应,达到消除脑水肿的作用。临床试验[7]证明,奥扎格雷钠具有见效快、疗程短、价格适中、无毒副作用等诸多优点。吡拉格雷钠(tetramethylpyrazine-2'-O-sodium ferulate,TSF)是以奥扎格雷钠为先导物进行改良的结构新型的血栓烷素A2合成酶抑制剂。本课题组的前期研究发现,吡拉格雷可以明显减轻大鼠脑缺血/再灌注后的脑水肿,很好地保护血脑屏障的完整性,但其减轻脑水肿的具体途径及机制目前都尚不清楚。本研究通过对体外星形胶质细胞行氧糖剥夺/复氧处理,建立细胞水肿模型,观察TSF对星形胶质细胞水肿模型的治疗效果及其对AQP4表达的影响。
1 材料与方法
1.1 实验动物及材料
1.1.1 实验动物 出生3 d内的SD新生乳鼠(由江苏大学动物中心提供)。
1.1.2 材料及试剂 戊巴比妥钠(美国Sigma公司);胎牛血清,0.25%胰蛋白酶(含0.025%EDTA),DMEM无糖培养基,DMEM培养基(美国Sig-ma公司);D-Hanks缓冲液;3-氧 - 甲基-[1-3H]-D-葡萄糖;根皮素;NaOH溶液;HCl溶液;BCA蛋白浓度测定试剂盒(Beyotime公司);AQP4一抗(Abcam公司);酶标仪;低温离心机;二氧化碳孵箱。
1.2 实验方法
1.2.1 原代星形胶质细胞的培养 取SD乳鼠脑组织,用预冷D-Hanks缓冲液清洗表面血迹,并快速除去脑膜和血管,制备单细胞悬液,以上操作均在无菌条件下进行。将单细胞悬液接种入培养瓶中,培养瓶置于二氧化碳孵箱(5%CO2,20%O2),37℃恒温培养1 h;将细胞悬液转换至另一培养瓶,继续置于二氧化碳孵箱培养,隔2~3 d换液,7 d后于37℃,200 r·min-1振荡 18 h,换液,细胞长满至90%~95%瓶底时,以0.25%胰蛋白酶消化离心,重复传代至第3代,此时即得到成熟纯化的原代星形胶质细胞[8]。
1.2.2 氧糖剥夺/复氧星形胶质细胞水肿模型的建立 弃去星形胶质细胞培养瓶中的正常培养基,PBS快速冲洗2次。加入无糖DMEM培养基,置于低氧(1%O2,5%CO2)孵箱,进行2 h的氧糖剥夺培养;氧糖剥夺后,弃去无糖DMEM培养基,置于DMEM/F 12培养基,正常条件培养。
1.2.3 实验分组 将体外原代星形胶质细胞分为4个组:① 正常组:正常星形胶质细胞在二氧化碳孵箱(5%CO2,20%O2),37℃ 恒温,以 10% 胎牛血清的DMEM/F 12培养基培养;② 氧糖剥夺/复氧(oxygen glucose deprivation/reoxygenation,OGD/Reox)损伤组:将正常星形胶质细胞进行2 h氧糖剥夺培养,恢复正常条件培养至6、12、24和48 h 4个时间点;③ Ozagrel阳性对照组:在星形胶质细胞行OGD/Reox损伤各时间点在细胞培养基中加入治疗浓度的Ozagrel治疗;④ TSF治疗组:星形胶质细胞OGD/Reox损伤模型建立后各时间点在细胞培养基中加入不同浓度梯度的TSF治疗。
1.2.4 细胞体积测定 各时间点实验结束前30 min,加3-氧 - 甲基-[1-3H]-D-葡萄糖于细胞培养基中,使其终浓度为1.85×108Bq·L-1,以此作示踪物测定细胞体积。各时间点取样,用预冷根皮素(1 mmol·L-1)培养基快速洗6遍,以终止反应,NaOH消化10 min,以等浓度HCl中和,加闪烁液混匀,取0.5 mL用于流体闪烁计数,取0.1 mL用于BCA法蛋白质含量测定,换算成细胞内水含量(Kletzien法),结果以L·g-1蛋白表示。
1.2.5 LDH漏出率测定 星形胶质细胞分别在氧糖剥夺/复氧培养至各时间点,各组取约0.3 ml细胞培养液,测定乳酸脱氢酶(lactate dehydrogenase,LDH)活性,结果计算采用公式:LDH漏出率/%=[培养基 LDH/(胞质 LDH+培养基 LDH)]×100%。
1.2.6 星形胶质细胞活性鉴定(MTT法) 取星形胶质细胞以1×108·L-1密度种于96孔培养板中,每孔接种100 μL,每组设6个复孔,培养至所需的天数,DMEM培养基冲洗3次,加5 μL的MTT(5 g·L-1),孵育4 h,弃去 MTT及培养基,每孔加入200 μL的二甲基亚砜,振荡5 min,酶标仪(A570 nm)测定,取均值,采用公式计算结果:细胞存活率/%=[A(实验组)/A(对照组)]×100%。
1.2.7 Western blot测定星形胶质细胞AQP4蛋白表达水平 去除培养液,加入蛋白裂解液,置于冰上裂解20 min;4℃下14 000×g离心10 min,取上清,用BCA法测定总蛋白浓度。30~50 μg总蛋白上样量以浓度为8%的凝胶电泳分离。冰水浴下恒流(300mA)湿法转膜1.5 h,以体积分数5%的脱脂奶粉封闭1 h,加AQP4一抗(1∶300),4℃共孵育过夜。TBS-T洗涤,与二抗共孵育2 h,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析,以β-actin的灰度值标化蛋白表达水平。
1.2.8 RT-PCR测定星形胶质细胞AQP4 mRNA转录水平 取各组别星形胶质细胞,均匀粉碎后按TRIzol提取程序(说明书)提取组织总 RNA;按AMV逆转录试剂盒操作说明进行逆转录后,4℃保存。扩增引物:AQP4上游引物5'-GGAATTTCTGGCCATGCTTA-3',下游引物 5'-AAGACAGACTTGGCGATGCT-3',扩增片段产物长231 bp。β-actin上游引物5'-CTGCCGCATCCTCTTCCTC-3',下游引物5'-CTCCTGCTTGCTGATCCACTA-3',扩增产物长398 bp。扩增条件:94℃ 15 s,55℃ 15 s,72℃ 20 s,共35个循环。2%琼脂糖凝胶电泳后,凝胶成像仪观察,用 Band Scan 5.0软件测定条带灰度值,将AQP4 mRNA、分别与β-actin mRNA灰度值的比值作为观察指标,进行统计学分析。
1.3 统计学分析采用SPSS19.0进行统计分析,计量资料采用±s表示,组间比较均采用单因素方差分析(One-way analysis of variance,ANOVA)处理。
2 结果
2.1 TSF对OGD/Reox后星形胶质细胞体积变化的影响
2.1.1 OGD/Reox后不同时间点星形胶质细胞体积变化 经过2 h时长的氧糖剥夺后,星形胶质细胞不同时间点细胞体积随着时间延长呈不断增高趋势。与正常组相比,OGD/Reox后48 h时差异有显著性(P <0.01)。见 Tab 1、Fig 1。
Tab 1 Changes of astrocytes volume in different time points(±s,n=6)

Tab 1 Changes of astrocytes volume in different time points(±s,n=6)
#P<0.05,##P<0.01 vs control
Group Control Time points after OGD/Reox 6 h 12 h 24 h 48 h Cell volume 5.49 ±0.44 6.33 ±0.64 6.81 ±0.41 7.20 ±0.45#7.67 ±0.38##

Fig 1 Changes of astrocytes volume in different time points(±s,n=6)
2.1.2 不同浓度梯度TSF对OGD/Reox后48 h星形胶质细胞体积的影响 星形胶质细胞氧糖剥夺2 h复氧48 h后,与模型组相比,不同浓度梯度的TSF(10-7、10-6、10-5、10-4mol·L-1)处理的细胞体积均有明显降低(P<0.05),各浓度梯度之间差异无显著性(P>0.05);Ozagrel组与TSF组各浓度梯度之间差异也无显著性(P>0.05)。见Tab 2、Fig 2。

Fig 2 Effects of different concentrations of TSF on astrocytes volume after OGD/Reox(±s,n=6)
2.1.3 LDH漏出率检测结果 实验表明,正常供氧条件下,LDH漏出率也仅为2.3%,氧糖剥夺2 h复氧后各时间点随着复氧时间的延长LDH的漏出率增加,与正常对照组差异有显著性(P<0.05,P<0.01),与模型组对比,TSF给药组的LDH漏出率明显降低(P<0.05);Ozagrel组与TSF组各浓度梯度之间差异无显著性(P>0.05)。见Tab 3、Fig 3。

Fig 3 The leakage rate of LDH in astrocytes(±s,n=6)
2.2 MTT检测细胞活力结果与正常组相比,OGD 12、24和48 h细胞的MTT值明显降低(P<0.05),比较星形胶质细胞OGD/Reox后各个时间点MTT值,随缺氧/复氧时间增加,MTT值逐渐下降,显示细胞活力降低;与OGD/Reox比较,TSF治疗组细胞活力均有增高(P<0.05);Ozagrel组与TSF组各浓度梯度之间差异也无显著性(P>0.05)。见 Fig 4、5。

Fig 4 Changes of MTT in OGD/Reox group(±s,n=6)
Tab 2 Effects of different concentrations of TSF on astrocytes volume after OGD/Reox(±s,n=6)

Tab 2 Effects of different concentrations of TSF on astrocytes volume after OGD/Reox(±s,n=6)
##P<0.01 vs control;*P<0.05 vs OGD/Reox
Group Control OGD/Reox Ozagrel Different concentration of TSF/mol·L-1 10 -7 10 -6 10 -5 10-4 Cell volume 5.49 ±0.44 7.63 ±0.45## 6.41 ±0.27* 7.48 ±0.34 6.80 ±0.54* 6.44 ±0.33* 6.57 ±0.73*
Tab 3 The leakage rate of LDH in astrocytes(±s,n=6)

Tab 3 The leakage rate of LDH in astrocytes(±s,n=6)
#P<0.05,##P<0.01 vs control;**P<0.01 vs OGD/Reox
Group Leakage rate of LDH after OGD/Reox/%6 h 12 h 24 h 48 h Control 2.30 ±0.21 2.19 ±0.25 2.38 ±0.21 2.33 ±0.28 OGD/Reox 3.91 ±0.39 4.98 ±0.37# 7.21 ±0.36## 8.13 ±0.34##Ozagrel 3.13 ±0.04 3.83 ±0.19 4.72 ±0.46** 5.63 ±0.37**TSF 3.06 ±0.31 3.73 ±0.31 4.89 ±0.38** 5.80 ±0.41**

Fig 5 Changes of MTT in TSF group compared with OGD/Reox group(± s,n=6)
2.3 Western blot检测 TSF对星形胶质细胞OGD/Reox后AQP4表达的影响
2.3.1 Western blot检测不同浓度梯度TSF对星形胶质细胞OGD/Reox后AQP4表达的影响 星形胶质细胞OGD/Reox后48 h,以TSF处理,与模型组相比,不同浓度梯度TSF处理组AQP4蛋白表达水平均有明显降低(P<0.05),与正常组及Ozagrel组相比,差异均无显著性(P>0.05)。见Fig 6。
2.3.2 Western blot检测星形胶质细胞 OGD/Reox后各时间点AQP4的表达及TSF的影响 正常组星形胶质细胞有一定量的AQP4蛋白表达;与正常组相比,OGD/Reox组细胞AQP4蛋白在2 h氧糖剥夺/复氧培养至48h时达最高值明显高于正常组(P<0.01);TSF处理组AQP4蛋白在2 h氧糖剥夺/复氧后的表达变化趋势与OGD/Reox相似,但在各个时间点的表达水平均有明显降低(P<0.05);Ozagrel组与TSF组之间也差异无显著性(P>0.05)。见Fig 7。

Fig 6 Expression of AQP4 in TSF group for different concentrations via WB(±s,n=6)
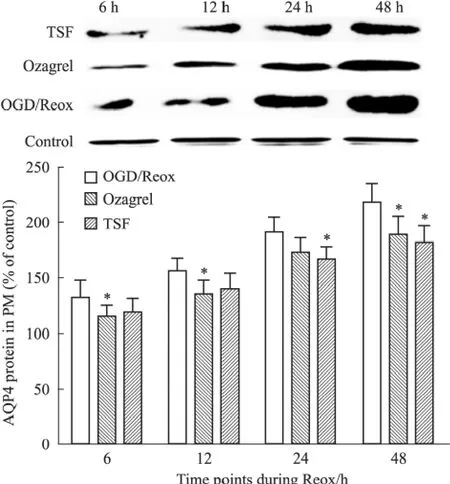
Fig 7 Expression of AQP4 in TSF group compared with OGD/Reox group for different time points via WB(±s,n=6)
2.4 RT-PCR检测TSF对星形胶质细胞OGD/Reox后AQP4 mRNA转录的影响
2.4.1 RT-PCR检测不同浓度梯度TSF对星形胶质细胞OGD/Reox后AQP4 mRNA表达的影响 星形胶质细胞OGD/Reox后48 h,与 OGD/Reox组相比,不同浓度梯度TSF处理组AQP4 mRNA表达水平均有明显降低(P<0.05),与正常组及Ozagrel组相比,差异均无显著性(P>0.05)。见Fig 8。

Fig 8 Expression of AQP4 mRNA in TSF group compared with OGD/Reox group for different concentration via RT-PCR(±s,n=6)
2.4.2 RT-PCR检测星形胶质细胞OGD/Reox后各时间点AQP4 mRNA转录及TSF的影响 正常组星形胶质细胞有一定量的AQP4 mRNA的表达,但表达量不随时间的变化而变化。与正常组相比,OGD/Reox组细胞AQP4 mRNA在2 h氧糖剥夺并复氧培养至48 h时达最高值明显高于正常组(P<0.01);与OGD/Reox组相比较 Ozagrel组及 TSF处理组AQP4 mRNA在2 h氧糖剥夺并复氧后的表达也提高,但在各个时间点的表达水平均有明显较低;Ozagrel组与TSF组之间差异也无显著性(P>0.05)。见Fig 9。
3 讨论
脑水肿是一种过多的水分异常潴留在脑组织内的病理过程。其存在于多种脑疾病的发生发展过程中,属于急慢性脑部疾病的重要病理过程。尤其是在脑梗死的患者中,梗死灶周围发展出现水肿,形成脑水肿。目前,尽管对于脑水肿进行了大量临床及实验学研究,关于其具体的发生机制尚未阐明。

Fig 9 Expression of AQP4 mRNA in TSF group compared with OGD/Reox group for different time points via RT-PCR( ± s,n=6)
王婷婷等[9]在对脑缺血损伤的治疗研究中发现,胡黄连苷Ⅱ能够清除自由基、抗氧化,下调AQP4蛋白的表达,抑制TLR4-NF-κB信号传导通路,从而缓解脑水肿、改善大脑的神经功能。Arii[10]的研究表明,奥扎格雷钠可通过减少脑梗死患者TXA2水平减少大鼠脑水肿的形成。但具体的调节机制仍未探明。徐斌等[7]进一步研究显示,奥扎格雷钠与巴曲酶合用通过减低MMP-9、TXA2水平保护血管内皮,减少梗死后脑水肿以及出血性转化的发生。吡拉格雷钠,是以奥扎格雷钠为先导物进行改良的结构新型的TXA2合成酶抑制剂,可能也是抑制TXA2的产生,保护血管内皮的损伤,从而影响了星形胶质细胞的迁移速率,改善水分子进出脑组织平衡状态,产生脑水肿的治疗作用。
本研究通过对星形胶质细胞体外OGD/Reox,导致星形胶质细胞胞体及突起明显肿胀,建立了细胞水肿模型,以此模拟体内星形胶质细胞缺血/再灌注损伤引起脑水肿的病理过程[11]。实验过程中,星形胶质细胞在氧糖剥夺/复氧处理后,细胞逐渐肿胀,至48h时肿胀不断明显,LDH活性的不断增高和MTT值得不断降低正是星形胶质细胞严重损伤的表现。而在OGD/Reox后加入不同浓度的TSF处理,可以使细胞的肿胀明显减轻,LDH活性增高的程度也同样明显降低,表明TSF能够明显减轻氧糖剥夺引起的星形胶质细胞水肿。Western blot及RTPCR的结果更分别从蛋白水平和mRNA的转录水平印证了这一结果。
AQP4是脑内主要的水通道蛋白,越来越多的研究表明AQP4与脑水肿关系密切。Lopez-Rodriguez等[12]发现,形态和生长特征无明显差异的AQP4基因敲除小鼠和AQP4+/+野生型小鼠的星型胶质细胞相比,前者对水的通透性比后者低,提示AQP4是水分子快速进出的通道。Papadopoulos等[13]利用体外培养的星形胶质细胞建立人类在脑水肿模型的研究中发现,AQP4敲除小鼠的脑水肿程度明显轻于野生小鼠。由此可见,AQP4表达水平的高低与细胞毒性脑水肿的严重程度直接相关。在2 h氧糖剥夺后星形胶质细胞严重水肿的过程中,AQP4蛋白的表达量呈上升趋势。而在加入TSF后,氧糖剥夺后星形胶质细胞AQP4的表达水平较模型组均明显降低,细胞水肿也明显减轻,由此可以推测,TSF通过作用于AQP4有关蛋白阻止细胞水肿过程中胞外水分异常过多的进入细胞内,从而达到减轻氧糖剥夺后星形胶质细胞水肿的作用。这种保护作用可能是TSF作为新型TXA2合成酶抑制剂,明显减低了TXA2水平,从而保护血管内皮,修复损伤内皮细胞及对AQP4蛋白调节保护,产生治疗细胞水肿的效果。
TSF作为TXA2合成酶抑制剂具有调节AQP4表达的作用,对于减轻氧糖剥夺后星形胶质细胞水肿作用明显,为临床治疗颅内瘤周脑水肿、创伤性脑水肿等脑水肿也提供了新的思路。最新研究表明,TSF可通过调节钙-钙调蛋白依赖性蛋白激酶II(CaMKII)、ERK信号通路等的活化减轻创伤性脑水肿[14],但其具体分子机制研究有待于我们进一步的研究来探讨。
(致谢:本实验全部由中国药科大学药理学实验室吴玉林老师课题组独立完成,感谢我的导师吴玉林老师在实验设计思路上提出的建议和意见及实验技术上给予的指导。)
[1] Zhang J,Li Q,Sun X.Presidental address.Pseudo-subarachnoid hemorrhage in a patient with hypoxic encephalopathy[J].Neurochirurgie.2015,61(1):35 -7.
[2] 缪 睿,李昌煜.水通道蛋白-依赖性细胞迁移的研究进展[J].中国药理学通报,2011,278(5):601-5.
[2] Miao R,Li C Y.The research progress of AQP-dependent cell migration[J].Chin Pharmacol Bull,2011,278(5):601 -5.
[3] Chen C H,Xue R,Zhang J.Effect of osmotherapy with hypertonic saline on regional cerebral edema following experimental stroke:a study utilizing magnetic resonance imaging[J].Neurocritical Care,2007,7(1):92 -100.
[4] Zador Z,Stiver S,Wang V,et al.Role of aquaporin-4 in cerebral edema and stroke[J].Handb Exp Pharmacol,2009,(190):159-70.
[5] Fu X,Li Q,Feng Z,et al.The roles of aquaporin-4 in brain edema following neonatal hypoxia ischemia and reoxygenation in a cultured rat astrocyte model[J].Glia,2007,55(9):935 -41.
[6] Zelenina M.Regulation of brain aquaporins[J].Neurochem Int,2010,57(4):468-88.
[7] 徐 斌,赵海玲,张 勇,等.奥扎格雷钠与巴曲酶联用治疗脑梗死后脑水肿疗效观察[J].中国热带医学,2013,13(8):1010-2.
[7] Xu B,Zhao H L,Zhang Y,et al.Effect of ozagrel sodium combined with batroxobin on cerebral infarction patients complicated with cerebral edema[J].China Tropical Med,2013,13(8):1010-2.
[8] Wang W W,Xie C L,Zhou L L,et al.The function of aquaporin4 in ischemic brain edema[J].Clin Neurol Neurosurg,2014,127(9):5-9.
[9] 王婷婷,赵 丽,李晓丹,等.胡黄连苷Ⅱ对脑缺血损伤后神经细胞凋亡和超微结构的影响[J].中国药理学通报,2015,31(3):400-6.
[9] Wang T T,Zhao L,Li X D,et al.Effect of picroside II on neuronal apoptosis and ultrastructure in cerebral ischemic injury in rats[J].Chin Pharmacol Bull,2015,31(3):400 -6.
[10] Arii K.The effect of ozagrel sodium on photochemical thrombosis in rat:therapeutic window and combined therapy with heparin sodium[J].Life Sci,2002 Nov 8;71(25):2983 -94.
[11] Rao K V,Reddy P V,Curtis K M,et al.Aquaporin-4 expression in cultured astrocytes after fluid percussion injury[J].J Neurotrauma,2011,28(3):371 -81.
[12] Lopez-Rodriguez A B,Acaz-Fonseca E,Viveros M P,et al.Changes in cannabinoid receptors,aquaporin 4 and vimentin expression after traumatic brain injury in adolescent male mice.Association with edema and neurological deficit[J].PLoS One,2015,10(6):e0128782.
[13] Papadopoulos M C,Verkman A S.Aquaporin-4 gene disruption in mice reduces brain swelling and mortality in pneumococcal meningitis[J].J Biol Chem,2005,280(14):13906 -12.
[14] Zhang C,Zhu J,Zhang J,et al.Neuroprotective and anti-apoptotic effects of valproic acid on adult rat cerebral cortex through ERK and Akt signaling pathway at acute phase of traumatic brain injury[J].Brain Res,2014 ,1555(3):1 -9.