125I标记聚乙二醇化EILDVP肽的小鼠体内血药浓度
赵铁华,史子惠,张另沾
(1.河北师范大学药物研究所,河北 石家庄 050024;2.安徽华星化工股份有限公司,安徽 合肥 230088)
125I标记聚乙二醇化EILDVP肽的小鼠体内血药浓度
赵铁华1,史子惠2,张另沾1
(1.河北师范大学药物研究所,河北 石家庄 050024;2.安徽华星化工股份有限公司,安徽 合肥 230088)
目的 探讨聚乙二醇修饰改善EILDVP肽体内过程的效果。方法 KM小鼠以NaI饱和甲状腺后,按5 mL·kg-1容积,分别尾静脉注射3.441GBq·L-1浓度的125I标记的EILDVP-Tyr-NH2、EILDVP-Cys (mPEG2000-MAL)-Tyr-NH2和EILDVP-Cys (mPEG20000-MAL)-Tyr-NH2肽。给药后不同时间取血,分离血浆,经三氯乙酸处理后测定沉淀部分放射性;测定数据分别代入已制备的相应标准曲线方程,取得血药浓度-时间数据,经3P97药动学统计软件计算主要药代动力学参数。结果 在3.75 ~480 μg·L-1浓度范围内,3种125I标记肽线性关系良好,回收率在88.92%~106.66%之间,日内变异系数(RSD)<10%;125I标记的mPEG2000和mPEG20000修饰EILDVP-Tyr-NH2肽的血浆半衰期(T1/2)分别为0.43 h和1.94 h、较原型肽(0.28 h)延长1.54倍和6.93倍,清除率(Cl)分别降低1.23倍和24.71倍;3种受试化合物表观分布容积(V)值均较小,主要分布在血浆中。结论 适宜分子质量mPEG修饰有利于延长EILDVP肽的体内维持时间,对提高药效具有积极意义;在实验范围内,分子质量较大的mPEG20000对EILDVP肽修饰效果较好。
VLA-4拮抗药;EILDVP肽;聚乙二醇修饰;药代动力学;血药浓度;小鼠
EILDVP(Glu-Ile-Leu-Asp-Val-Pro)是细胞外基质纤维黏连蛋白(NF)与极迟抗原-4(very late antigen-4,VLA-4;整合蛋白α4β1)结合的配体的CS-1区序列,其中LDV(Leu-Asp-Val)序列为其关键的三肽[1]。VLA-4广泛分布于淋巴细胞、中性和嗜酸性粒细胞等炎症细胞表面,其与NF、血管细胞黏附分子-1(VCAM-1)的结合和相互作用是炎症启动和发展过程中炎性细胞黏附、迁移至血管外组织的关键步骤。研究表明,EILDVP等含LDV序列肽可竞争抑制炎细胞与NF、VCAM-1的结合和相互作用,干扰类风湿关节炎、哮喘等慢性炎症和自身免疫性疾病的病理过程[2-6]。但是,与其它肽类分子性质相似,现有以LDV序列为基础结构的VLA-4拮抗肽由于分子量小,易被清除和酶解破坏,其体内代谢时间短,较大的治疗剂量和较短的给药时间间隔可能成为其应用的障碍。利用目前国际公认的聚乙二醇(polyethlene glycol,PEG)修饰增加蛋白质和多肽药物稳定性、延长血浆半衰期等药物性能改善特点,我们对EILDVP肽进行了聚乙二醇修饰[5-7]。本文比较了125I标记2 ku和20 ku分子质量直链甲氧基聚乙二醇(mPEG2000和mPEG20000)修饰EILDVP肽的小鼠血药浓度和相关药代动力学参数,实验结果报告如下。
1 材料与方法
1.1 受试化合物与试剂化合物A:EILDVP-Tyr-NH2、化合物B(mPEG2000修饰肽):EILDVP-Cys(mPEG2000-MAL)-Tyr-NH2、化合物C(mPEG20000修饰肽):EILDVP-Cys (mPEG20000-MAL)-Tyr-NH2,为本实验室采用Fmoc固相方法合成,RP-HPLC方法纯化,质量分数分别为0.995、0.959和0.992;MS鉴定,化合物A分子质量为847.6 u,化合物B在3 050.0 u附近有一组相差44的峰,化合物C在21 050.7 u附近有一组相差44的峰,与预期相符。委托北方生物技术研究所采用氯胺T法对3种化合物进行125I标记,并经PR-HPLC方法分离纯化;标记化合物A放射性比活性为1.005 Bq·g-1、化合物B为0.344 Bq·g-1、化合物C为0.264 Bq·g-1;3种125I标记肽放化纯度(质量分数) 均高于0.95;生理盐水稀释至使用浓度。碘化钠(NaI)、三氯乙酸(TCA)为天津大茂化学试剂厂产品,分析纯;其余试剂为国产分析纯;实验用水为超纯水。
1.2 主要仪器γ 计数器:MF-1000型,西安凯普公司产品;低温冷冻离心机:KDC-2046型,科大创新股份有限公司中佳分公司产品。
1.3 实验动物及其分组给药KM小鼠,清洁级,体质量20~25 g,由河北省实验动物中心提供,合格证编号810145。以上小鼠随机分为125I标记的化合物A、B、C 3组。实验前12 h,各小鼠im质量浓度20 g·L-1NaI生理盐水溶液0.25 mL饱和甲状腺,禁食不禁水,参考预实验计算的3种125I标记肽半衰期(T1/2)和初始血药浓度(C0),进一步按给药后0.08、0.25、0.5、1、2、4、6、8、24、32、48和72 h采血时间点,将小鼠随机分为A组0.08~6 h组、B组0.08~32 h组、C组0.08~72 h组,每组5只小鼠,♀♂兼用(♀3只♂2只,或♀2只♂3只),按5 mL·kg-1容积分别尾静脉注射3.441GBq·L-1浓度的3种125I标记肽。
1.4 血样样品处理[8]各组单次给药后, 分别在各采血时间点, 于动物眼眶取血0.2 mL,肝素抗凝, 全血在4℃条件下6 000×g离心10 min,取血浆-20℃保存备用。检测时取25 μL血浆样品, 加入175 μL纯水, 混匀后,加入等容积质量浓度200 g·L-1的TCA溶液沉淀蛋白, 4℃条件下6 000×g离心10 min后弃上清, 测定酸沉淀部分的放射性,换算为μmol·L-1。
1.5 标准曲线制备[8]分别将3种125I标记肽以纯水配制成3.75、7.5、15、30、60、120、240、480 μg·L-1浓度的标准液。分别取以上标准液10 μL,加入小鼠空白血浆25 μL、纯水165 μL,混匀后加入等容积质量浓度200 g·L-1的TCA溶液沉淀蛋白,每个浓度做3个平行管,“1.4”方法测定沉淀部分放射性,换算为μmol·L-1。以测定样品125I标记肽浓度为横坐标,放射性为纵坐标,分别做3种125I标记肽的标准曲线。
1.6 样品在血浆中回收率、精密度测定[8]按照标准曲线中溶液的配制方法,将3种125I标记肽分别配制为15、60、240 μg·L-1浓度, 分别进行回收率和精密度测定。回收率的测定:取3个浓度3种125I标记肽稀释液,测定其总放射性, 用等容积质量浓度200 g·L-1的TCA沉淀后,测定其沉淀放射性,计算沉淀放射性占总放射性的百分比。精密度的测定:3种125I标记肽每个浓度设6个平行管,同批测定, 评价批内精密度。
1.7 实验动物血药浓度的测定和药代动力学参数计算各组小鼠按“1.3”方法尾静脉注射3种125I标记肽,按“1.4”方法取样并测定沉淀物放射性,测定并换算数据分别代入相应标准曲线方程,求出各时间点血药浓度。3P97药动学统计软件对取得的血药浓度-时间数据进行处理,计算药代动力学参数。
2 结果
Tab 1 Recovery rate and precision of EILDVP peptide labeled by 125I and modified by polyethylene glycol of test results (±s,n=6)
EILDVP-Tyr-NH2,EILDVP-Cys(mPEG2000-MAL)-Tyr-NH2and EILDVP-Cys(mPEG20000-MAL)-Tyr-NH2peptide labeled by125I are separately A,B,C.
2.2 125I标记EILDVP及其聚乙二醇修饰肽的小鼠体内血药浓度和药代动力学参数小鼠尾静脉注射3.441 GBq·L-1浓度(5 mL·kg-1容积)3种125I标记肽后,不同时间点血浆经TCA沉淀后测定放射性,测定并换算数据分别代入相应标准曲线方程,取得血药浓度-时间数据(Fig 1),经3P97药动学统计软件分析房室数为1,计算主要药代动力学参数(Tab 2);其中mPEG20000修饰肽的血浆半衰期(T1/2)明显高于原型肽(化合物A)、清除率(Cl)明显低于原型肽;125I标记EILDVP-Cys (mPEG20000-MAL)-Tyr-NH2(化合物C)组小鼠血浆,在0.08 h时因125I剂量致放射性测量值溢出仪器的读出范围,未影响3P97软件对本组药代动力学参数的计算。
Tab 2 Pharmacokinetic parameters of EILDVP peptide labeled by 125I and modified by polyethylene glycol after i.v. injection in rats(±s,n=5)
EILDVP-Tyr-NH2,EILDVP-Cys(mPEG2000-MAL)-Tyr-NH2and EILDVP-Cys(mPEG20000-MAL)-Tyr-NH2peptide labeled by125I are separately A,B,C.
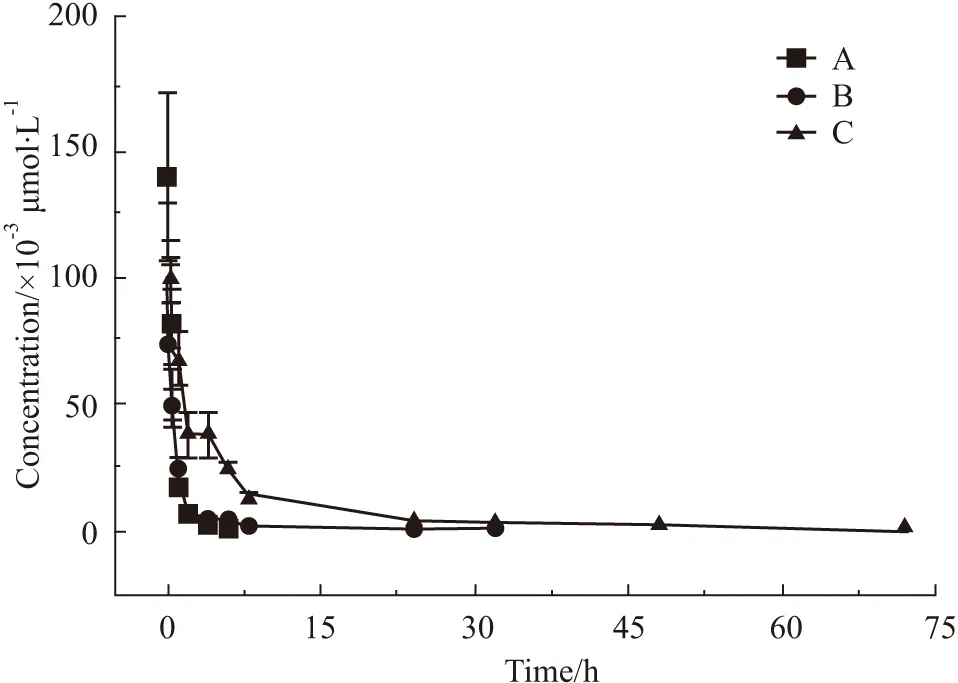
Fig 1 Blood drug concentration-time curve of EILDVP peptide labeled by 125I and modified by polyethylene glycol
EILDVP-Tyr-NH2,EILDVP-Cys(mPEG2000-MAL)-Tyr-NH2and EILDVP-Cys(mPEG20000-MAL)-Tyr-NH2peptide labeled by125I are separately A,B,C.
3 讨论
3.1 被修饰肽的设计相关研究资料和我们既往实验结果提示,EILDVP(Glu-Ile-Leu-Asp-Val-Pro)等含LDV(Leu-Asp-Val)关键序列的VLA-4拮抗肽具有治疗类风湿关节炎、慢性哮喘等免疫性炎症的潜在药用价值,并且聚乙二醇修饰可通过增加体内稳定性、延长半衰期等机制增强肽类分子药理活性[2-7]。本实验在EILDVP-Cys(mPEG2000-MAL)-Tyr-NH2等肽结构中设计加入Tyr,是为EILDVP肽提供原结构中缺乏的125I标记部位[9];利用某些mPEG衍生物特异修饰Cys的特性,在短肽C端加入Cys以提供mPEG定点巯基修饰部位,预期防止随机修饰可能发生的修饰物对短肽生物活性部位的屏蔽[10]。
3.2 修饰物mPEG的分子质量本实验以预期提高被修饰物体内稳定性、半衰期,并较大程度保留原型化合物活性为目的,依据被修饰蛋白质或肽类分子在体内的作用时间与偶联的PEG数量和相对分子质量成正比、生物活性与PEG相对分子质量成反比的蛋白质和肽类药物化学修饰的基本规律[11],参考既往2 ku分子质量 mPEG延长约0.5 ku分子质量短肽半衰期2倍以上的实验结果[7],选择分子质量分别为2 ku和20 ku的直链甲氧基聚乙二醇(mPEG2000和mPEG20000)为修饰物,主要观察和比较mPEG20000对短肽的修饰效果。
3.3 结果分析本实验药代动力学参数显示,125I标记的mPEG2000和mPEG20000修饰肽较原型EILDVP-Tyr-NH2肽的血浆半衰期(T1/2)分别延长1.54倍和6.93倍,清除率(Cl)分别降低1.23倍和24.71倍;3种受试化合物表观分布容积(V)均较小,数据提示主要分布在血浆,原因是否与其血浆蛋白结合率有关,尚待直接测试验证;受单一给药途径限制,因125I 标记量及仪器测量范围所致3种受试化合物动物单位体质量给药剂量差异,不能分析本文mPEG20000修饰肽曲线下面积(AUC)数值与另2种受试化合物的差异。
本实验单剂量3种受试化合物的小鼠体内药代动力学分析结果提示,适宜分子质量的直链甲氧基聚乙二醇(mPEG)修饰有利于延长EILDVP肽在体内的维持时间,从而保证有效浓度药物分子产生活性,对提高药效具有积极意义;在实验涉及分子质量范围内,分子质量较大(20 ku)的mPEG对EILDVP肽修饰效果较好。以上结果与我们既往mPEG修饰含LDV序列肽抗炎作用增强的药效实验结果吻合[6]。
[1] Chen L L, Lobb R R, Cuervo J H, et al. Identification of ligand binding sites on integrin α4β1 through chemical cross-linking[J].Biochemistry,1998,37(24):8743-53.
[2] Dutta A S, Gormley J J, Coath M, et al. Potent cyclic peptide inhibitors of VLA-4 (α4β1 integrin) mediated cell adhesion. Discovery of compounds like cyclo (MePhe-Leu-Asp-Val-D-Arg-D-Arg) (ZD7349)compatible with depot formulation [J].JPeptSci, 2000, 6(8):398-412.
[3] Gloria C, Kashmira S, Gloria J, et al. A small molecule very late antigen-4 antagonist can inhibit ovalbumin-induced lung inflammation [J].AmJRespirCritCareMed,2003,167(10):1400-9.
[4] Vanderslice P, Biediger R J, Woodside D G,et al. Small molecule agonist of very late antigen-4 (VLA-4) integrin induces progenitor cell adhesion[J].JBiolChem,2013,288(27):19414-28.
[5] Pepinsky R B,Lee W C,Cornebise M,et al. Design,synthesis,and analysis of a polyethelene glycol-modified(PEGlyated)small molecule inhibitor of integrin α4β1 with improved pharmaceutical properties[J].JPharmacolExpTher, 2005, 312(2): 742-50.
[6] 甄晓兰.不同分子量聚乙二醇化的VLA-4拮抗肽对致敏性哮喘小鼠肺组织Eotaxin和CCR3表达的影响[D]. 承德医学院,2010.
[6] Zhen X L. Effects of the VLA-4 antagonist peptides modified by different molecular weights PEG in mice lung tissue expression of Eotaxin and CCR3 on allergic asthma models [D]. Chengde Medical College,2010.
[7] 赵铁华,文 曙,邓淑华,等.聚乙二醇化脑啡肽的镇痛药效和体内分布[J].中国药理学通报,2013,29(5):703-7.
[7] Zhao T H, Wen S, Deng S H, et al. Analgesic activity and biodistribution of polyethylene glycol conjugation to enkephalin[J].ChinPharmacolBull,2013,29(5):703-7.
[8] 鹿晓晶,李丽琴,张瑞华,等.125I-相思子毒素P2在小鼠体内的血药浓度及其生物利用度[J].中国药理学通报,2010,26(12):1665-9.
[8] Lu X J, Li L Q, Zhang R H, et al.Plasma concentration and bioavailability of125I-abrin P2in mice[J].ChinPharmacolBull,2010,26(12):1665-9.
[9] 尹伯元.放射性碘标记[M]//尹伯元. 放射免疫测定基础.天津:天津科技出版社,1985:177-8.
[9] Yin B Y.Radio-iodinated labelling[M]//Yin B Y .Basisofradioimmunityassay. Tianjin:Tianjin Science & Technology Publishing Corp,1985:177-8.
[10] Yu P Z, Zheng C Y, Chen J, et al. Investigation on PEGylation strategy of recombinant human interleukin-1 receptor antagonist[J].BioorgMedChem,2007, 15(16):5396-405.
[11] Bowen S, Tare N, Inoue T, et al. Relationship between molecular mass and duration of activity of polyethylene goycol conjugated granulocyte colony-stimulating factor mutein[J].ExpHematol, 1999,27(3): 425-32.
Plasma concentration of125I labeled and polyethylene glycol conjugation to EILDVP peptide in mice
ZHAO Tie-hua1,SHI Zi-hui2,ZHANG Ling-zhan1
(1.InstituteofMateriaMedica,HebeiNormalUniversity,Shijiazhuang050024,China;2.AnhuiHuaxingChemicalIndustryCo.LTd,Hefei230088,China)
Aim To study the pharmacokinetics of polyethylene glycol conjugation on EILDVP peptide in mice by injection through tail vein. Methods KM mice, saturated thyroid gland with compound of NaI,were injected for125I labeled EILDVP-Tyr-NH2, EILDVP-Cys (mPEG2000-MAL)-Tyr-NH2and EILDVP-Cys(mPEG20000-MAL)-Tyr-NH2peptides (125I: 5 mL·kg-1volume 3.441 GBq·L-1concentration) by tail intravenous, respectively. Blood samples at different time intervals were obtained,blood plasma was separated,and the radioactivity of precipitation after trichloroacetic acid (TCA) treatment was tested. According to standard curve equation, the plasma concentration curve and pharmocokinetic parameters were depicted by means of 3P97 pharmocokinetics software. Results Concentration range of 3.75~480 μg·L-1of three125I labled peptides in plasma from mice had good linear relationship. Recovery of method was 88.92%~106.66%, and RSD<10%. The half-life time (T1/2) of EILDVP-Tyr-NH2peptide modified by mPEG2000and mPEG20000, labled by125I was 0.43h and 1.94h,respectively, which was 1.54 times and 6.93 times that of prototype peptide (T1/2=0.28h), and the clearances (Cl) were 1.23 times and 24.71 times,respectively. The apparent distribution volume (V) values of the three species were small, which might mainly distributed in the plasma. Conclusions Suitable for molecular mass mPEG modified the EILDVP peptides could extend to maintain timeinvivo, which could play a positive role in improving efficacy. In the experimental range, EILDVP peptide modified by larger molecular mass of mPEG20000has better effect.
VLA-4 antagonist medicine; EILDVP peptide; PEG; pharmacokinetics; plasma cencentration; mice
时间:2015-11-24 11:00 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151124.1100.046.html
2015-08-05,
2015-09-02
国家自然科学基金资助项目(No 30672561)
赵铁华(1957-),男,硕士,教授,研究方向:中药、天然药物有效成分和多肽设计合成,通讯作者,Tel:0311-80787425,E-mail:zhaotiehua@163.com; 史子惠(1983-),女,硕士,工程师,研究方向:多肽药物,通讯作者,E-mail:shizihui1983@126.com
10.3969/j.issn.1001-1978.2015.12.023
A
1001-1978(2015)12-1745-04
R-332;R446.11;R969.1;R977.6