抗血管内皮生长因子药物在糖尿病视网膜病变围手术期的应用△
冯超逸 徐格致
·抗血管内皮生长因子专题·
抗血管内皮生长因子药物在糖尿病视网膜病变围手术期的应用△
冯超逸 徐格致
糖尿病视网膜病变(diabetic retinopathy,DR)进入增殖期,出现玻璃体积血(vitreous hemorrhage, VH)、牵引性视网膜脱离(tractional retinal detachment, TRD)等,玻璃体切除术是临床干预的有效手段之一。但由于视网膜新生血管的存在,术中复杂且难以预估的出血,不仅干扰术者的手术视野,增加各种手术器械的更换频度,提高手术难度,延长手术时间,同时也对治疗的预后有着不可忽视的不良影响。
近年来,玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物作为DR玻璃体切除术辅助治疗的临床研究,取得了令人希冀的效果[1-8]。对于增生型糖尿病视网膜病变(proliferative DR, PDR),术前予抗VEGF药物玻璃体腔注射,可使视网膜新生血管消退,被认为可以减少随后的玻璃体切除术中的出血,降低手术复杂程度[2-8]。但这一看法仍存在争议,部分研究[9-14]发现,这一辅助治疗并未改变术后玻璃体出血的发生率和患眼的最终视力。本文在评价研究质量的基础上,回顾既往关于抗VEGF药物在DR围手术期的研究报告,并结合我们的临床经验以期得到更客观可靠的结论,指导临床实践。
1 术前应用抗VEGF药物的指征及注意事项
出现不吸收的VH、PDR纤维增殖膜、视网膜前出血、视网膜被牵拉及TRD、牵引性合并孔源性视网膜脱离(rhegmatogenous retinal detachment, RRD)、玻璃体积血合并白内障、玻璃体出血合并虹膜新生血管等,都是进行玻璃体切除术的指征[15]。术前是否需要辅助抗VEGF药物,需要综合评估患者眼部及全身情况,进行个性化的治疗。我们总结既往经验,认为以下几种情况需慎用或注射后宜早期手术(3~7 d):①黄斑旁已存在增殖牵引,牵引膜内较多新生血管者(图1);②颞侧血管弓增殖已呈较完整环形者,环形增殖膜的收缩极易引起大片后极部视网膜脱离,建议抗VEGF治疗后3~5 d即手术(图2)。另一些情况则不用或者慎用:①有严重的全身性疾病、年龄较大、近期发生过心脑血管意外的患者;②视网膜血管已变细,增殖膜内无明显新生血管者;③视盘颜色淡,视网膜电图(electroretinogram, ERG)或视觉诱发电位(visual evoked potential, VEP)等电生理检查显示视功能差者。对于晚期DR,抗VEGF药物可能加重缺血,进一步影响视功能。
2 抗VEGF药物的作用
随着抗VEGF药物在DR中越来越多的应用,诸多临床研究试图将其作为玻璃体切除术的术前辅助治疗,并前瞻性地评估了这一方式对术中操作及术后预后的影响。Avery等[16](2006)在观察玻璃体腔注射贝伐单抗治疗PDR的过程中发现,6例患者在随后的玻璃体切除术中出血明显减少。Yang等[1]从中得到启发,成为该领域的先驱者(2008)。该研究纳入PDR活动期且同时存在3处及以上玻璃体视网膜粘连的患眼共40眼(39例),其中16眼(15例)术前7~9 d玻璃体腔注射贝伐单抗1.25 mg,与另外24眼(24例)同等纤维血管增殖情况的对照组患眼做对比,均行标准的经睫状体扁平部三通道闭合式玻璃体切除手术(three-port pars planavitrectomy, PPV),同时予C3F810%玻璃体腔填充。主要结果评价包括术中出血的严重程度(由分级标准评估)、玻璃体腔可再次窥清视网膜血管的时间(vitreous clear-up time)(≥3周)、玻璃体积血的复发率等。结果显示,贝伐单抗治疗组的术中出血及玻璃体腔恢复清亮的时间都较对照组明显减少,但术后玻璃体积血的远近复发率两组间无明显差异。贝伐单抗注射之后至玻璃体切除手术之前,并未发现视网膜牵引的增加,术后也无患眼出现视网膜脱离。这一结果可能是因为样本量较小,尚不足以发现临床有意义的视网膜牵引的加剧所致。其评价指标包括术前疾病的严重程度、术中出血分级及术后玻璃体腔恢复清亮的时间等,都具有较大的主观性,是这一研究的不足之处。但它向人们展示了抗VEGF药物对于DR玻璃体切除手术的潜在价值,吸引了其他学者随后深入该领域研究。
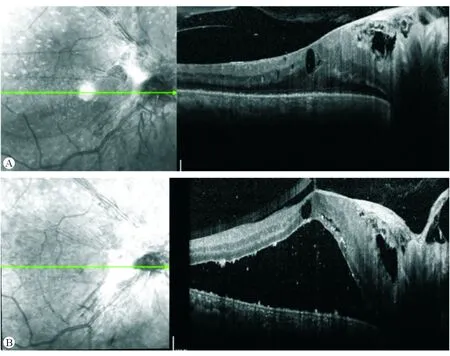
图1. A. 为DR增殖期患者右眼后极部相干光断层扫描线扫图像,牵引存在于黄斑与视乳头间,黄斑囊样水肿;B. 为该患眼抗VEGF注射11 d后,增殖牵拉致后极视网膜脱离,累及黄斑
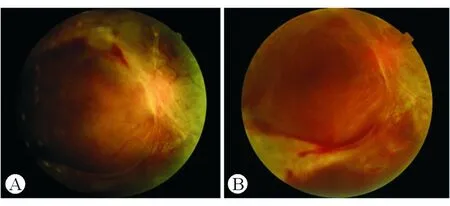
图2. A. 为DR增殖期患者右眼眼底照,视网膜脱离未累及黄斑;B. 为该患眼抗VEGF药物注射1周后,环形增殖膜明显增厚,脱离累及黄斑
目前已发表有关抗VEGF药物在玻璃体切除术中应用的前瞻性对照研究见表1。9项研究为随机对照试验,其中3项采用手术+假注射方式作为对照组,另6项对照组为单纯玻璃体手术组。所用药物均为贝伐单抗。2.1 视力预后 几乎所有该领域的研究均进行了视力预后的评估[2-3, 5-7, 13-14, 18-19],基于可获得的数据进行Meta分析,共6项试验335只患眼。结果显示,术前或术中接受贝伐单抗治疗的患者,在随访期间获得了较好的视力预后(提高2~3行)。但可信区间较宽且包括了无效的范围,平均值为 -0.24 logMAR,95% CI[-0.496 3,0.011 4]。各研究异质性较大(I2=67%)。
2.2 术中出血量 6篇文章以术中出血量作为评价手术复杂程度的指标[2-4, 6-7, 13],结果以每例出血频率、例数、集液袋内红细胞计数,或出血程度分级来评价。DR患眼术前或术中玻璃体腔注射贝伐单抗,可降低术中出血量,平均值为0.157 3,95% CI [0.078 1,0.317 0]。各研究异质性较大(I2= 77%)。
2.3 手术时长 手术时间的长短间接反映手术难易程度,共有4项研究报道了这一结果[2, 5-7]。Meta分析显示,注射抗VEGF可有效缩短手术时间,平均值为-23.611 8,95% CI [-30.919 1,16.304 6]。各研究的异质性I2=45%。
2.4 眼内电凝DR的术中出血 轻中度可经提高眼内灌注压自行停止,更严重的则需眼内电凝来止血。因此眼内电凝从侧面反映了术中出血量和手术难度。6篇文献以此作为结果评价之一[2-3, 5-7, 13]。总体来说贝伐单抗试验组眼内电凝用量较少,但可信区间较宽且包括了无效的范围,平均值为-2.968 9,95% CI [-6.431 0,0.493 2]。各研究异质性较大(I2=98%)。
2.5 术后出血 术后出血被多项研究作为评价干预措施重要的指标之一[2-3, 5, 7, 18-19]。Meta分析结果显示,抗VEGF药物辅助玻璃体切除术,可显著降低术后出血的发生率,平均值为0.155 4,95% CI [0.091 2,0.264 7]。各研究的异质性I2= 50%。
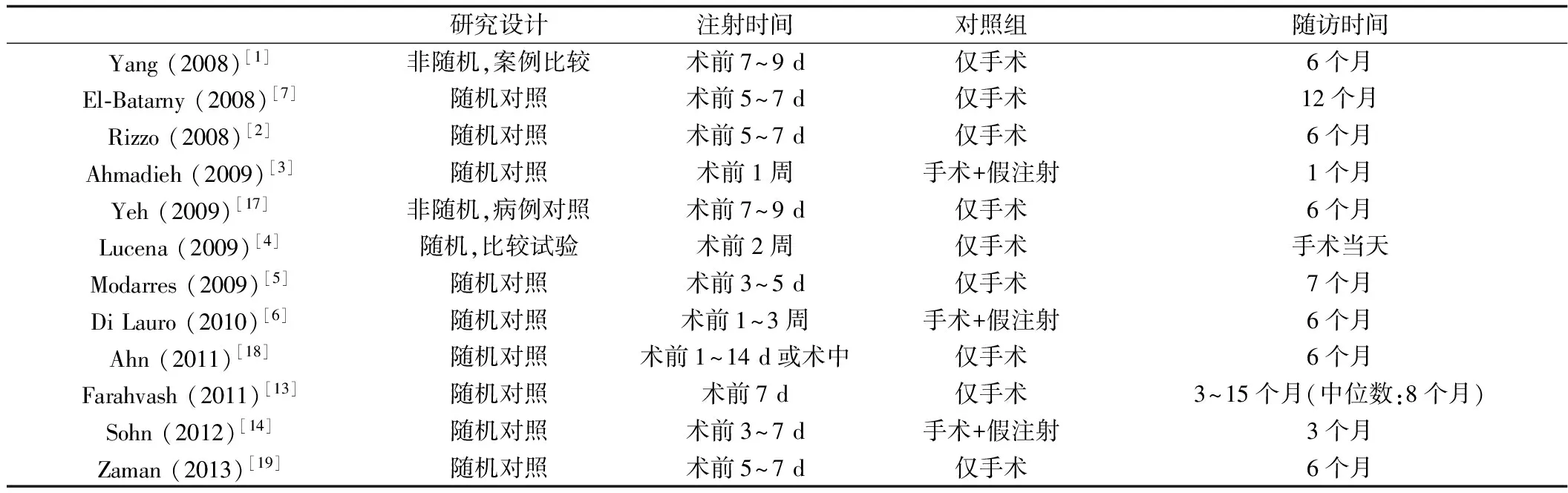
表1 抗VEGF药物在玻璃体切除术中应用的前瞻性随机对照研究
2.6 减少硅油使用 其他结果指标包括术中钝性或锐性分离、松解性视网膜切开、视网膜造孔、手术器械更换次数、玻璃体腔填充方式等,均倾向于抗VEGF药物术前或术中玻璃体腔注射,可降低手术难度,缩短手术时间,减少术中及术后的出血,降低硅油使用及随后的二次手术取出硅油的比例。
2.7 其他 我们根据术中观察,认为抗VEGF药物辅助玻璃体切除术,还有以下几点作用:①促使机化膜成熟;②使成熟的机化膜易于辨认,减少误伤视网膜的机会;③成熟的机化膜与视网膜间的粘连变得疏松;④剥除视盘机化膜时出血明显减少;⑤中央视网膜血管充盈减轻,出血时易于电凝止血;⑥全视网膜水肿减轻,光凝效果提高。
3 结论
既往所报道的关于抗VEGF药物在DR围手术期应用的效果及安全性的随机对照临床试验,样本量均较小,研究证据质量均不高。但总体试验结果倾向于术前玻璃体腔注射贝伐单抗,对于DR所致牵引性视网膜脱离和无法自行吸收的玻璃体积血的玻璃体切除手术,具有有利的辅助作用。这与该领域的其他几项Meta分析的研究[20-22]结果相一致。术前1~2周注射抗VEGF药物,并未对术后的解剖和视力预后造成不利影响。
目前所发表的文章均以贝伐单抗作为评估对象,有关其他抗VEGF药物用于DR相关玻璃体切除手术的应用,尚未见到随机对照临床试验报道。我院目前采用雷珠单抗0.5 mg(0.05 mL),或康柏西普0.5 mg(0.05 mL)术前3~7 d玻璃体腔注射,效果良好。
研究所提及的抗VEGF药物的其他效应,包括玻璃体积血吸收较快、术中并发症较少、手术时长缩短、术后出血减少及术后更佳的视力预后等,则需要样本量更大、随访期更长、研究设计更科学的临床证据来证明。期待在不远的将来获得更多相关研究成果,更好地指导临床决策,造福DR患者。
[ 1 ] Yang CM, Yeh PT, Yang CH, et al.Bevacizumab pretreatment and long-acting gas infusion on vitreous clear-up after diabetic vitrectomy[J].Am J Ophthalmol,2008,146(2):211-217.
[ 2 ] Rizzo S, Genovesi-Ebert F, Di Bartolo E, et al.Injection of intravitreal bevacizumab (Avastin) as a preoperative adjunct before vitrectomy surgery in the treatment of severe proliferative diabetic retinopathy (PDR)[J].Graefes Arch Clin Exp Ophthalmol,2008,246(6):837-842.
[ 3 ] Ahmadieh H, Shoeibi N, Entezari M, et al.Intravitreal bevacizumab for prevention of early postvitrectomy hemorrhage in diabetic patients: a randomized clinical trial[J].Ophthalmology,2009,116(10):1943-1948.
[ 4 ] da RLD, Ribeiro JA, Costa RA, et al.Intraoperative bleeding during vitrectomy for diabetic tractional retinal detachment with versus without preoperative intravitreal bevacizumab (IBeTra study)[J].Br J Ophthalmol,2009,93(5):688-691.
[ 5 ] Modarres M, Nazari H, Falavarjani KG, et al.Intravitreal injection of bevacizumab before vitrectomy for proliferative diabetic retinopathy[J].Eur J Ophthalmol,2009,19(5):848-852.
[ 6 ] di Lauro R, De Ruggiero P, di Lauro R, et al.Intravitreal bevacizumab for surgical treatment of severe proliferative diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol.2010,248(6):785-791.
[ 7 ] El-Batarny AM.Intravitreal bevacizumab as an adjunctive therapy before diabetic vitrectomy[J].Clin Ophthalmol,2008,2(4):709-716.
[ 8 ] Nicholson BP, Schachat AP.A review of clinical trials of anti-VEGF agents for diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol,2010,248(7):915-930.
[ 9 ] Romano MR, Gibran SK, Marticorena J, et al.Can an intraoperative bevacizumab injection prevent recurrent postvitrectomy diabetic vitreous hemorrhage?[J].Eur J Ophthalmol,2009,19(4):618-621.
[10] Lo WR, Kim SJ, Aaberg TM, Sr., et al.Visual outcomes and incidence of recurrent vitreous hemorrhage after vitrectomy in diabetic eyes pretreated with bevacizumab (avastin)[J].Retina,2009,29(7):926-931.
[11] Jirawison C, Ittipunkul N.Intravitreal bevacizumab at the end of diabetic vitrectomy for prevention of postoperative vitreous hemorrhage: a comparative study[J].J Med Assoc Thai,2012,95(Suppl 4):S136-142.
[12] Sato T, Morita S, Bando H, et al.Early vitreous hemorrhage after vitrectomy with preoperative intravitreal bevacizumab for proliferative diabetic retinopathy[J].Middle East Afr J Ophthalmol,2013,20(1):51-55.
[13] Farahvash MS, Majidi AR, Roohipoor R, et al.Preoperative injection of intravitreal bevacizumab in dense diabetic vitreous hemorrhage[J].Retina,2011,31(7):1254-1260.
[14] Sohn EH, He S, Kim LA, et al.Angiofibrotic response to vascular endothelial growth factor inhibition in diabetic retinal detachment: report no. 1[J].Arch Ophthalmol,2012,130(9):1127-1134.
[15] 中华医学会眼科学会眼底病学组.我国糖尿病视网膜病变临床诊疗指南(2014年)[J].中华眼科杂志,2014,50(11):851-865.
[16] Avery RL, Pearlman J, Pieramici DJ, et al.Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy[J].Ophthalmology,2006,113(10):1695.e1691-1615.
[17] Yeh PT, Yang CM, Lin YC, et al.Bevacizumab pretreatment in vitrectomy with silicone oil for severe diabetic retinopathy[J].Retina,2009,29(6):768-774.
[18] Ahn J, Woo SJ, Chung H, et al.The effect of adjunctive intravitreal bevacizumab for preventing postvitrectomy hemorrhage in proliferative diabetic retinopathy[J].Ophthalmology,2011,118(11):2218-2226.
[19] Zaman Y, Rehman AU, Memon AF.Intravitreal Avastin as an adjunct in patients with proliferative diabetic retinopathy undergoing pars plana vitrectomy[J].Pak J Med Sci,2013,29(2):590-592.
[20] Zhao LQ, Zhu H, Zhao PQ, et al.A systematic review and meta-analysis of clinical outcomes of vitrectomy with or without intravitreal bevacizumab pretreatment for severe diabetic retinopathy[J].Br J Ophthalmol,2011,95(9):1216-1222.
[21] Zhang ZH, Liu HY, Hernandez-Da Mota SE, et al.Vitrectomy with or without preoperative intravitreal bevacizumab for proliferative diabetic retinopathy: a meta-analysis of randomized controlled trials[J].Am J Ophthalmol,2013,156(1):106-115.e102.
[22] Martinez-Zapata MJ, Marti-Carvajal AJ, Sola I, et al.Anti-vascular endothelial growth factor for proliferative diabetic retinopathy[J].Cochrane Database Syst Rev,2014,11:Cd008721.
(本文编辑 诸静英)
国家自然科学基金(81170857/H1205)
复旦大学附属眼耳鼻喉科医院眼科 上海市视觉损害与重建重点实验室 上海 200031
徐格致(Email: drxugezhi@163.com)
10.14166/j.issn.1671-2420.2015.04.008
2015-03-24)

