HIF-1α、ROCK-2、FoxM1在醋酸铅诱导PC12细胞损伤中的表达变化
李永金,张 谊,杨开勇,席 可,李少邱,朱春雪,陈月芳,黄晓佳
(江苏大学医学院药理学教研室,江苏镇江 212013)
HIF-1α、ROCK-2、FoxM1在醋酸铅诱导PC12细胞损伤中的表达变化
李永金,张 谊,杨开勇,席 可,李少邱,朱春雪,陈月芳,黄晓佳
(江苏大学医学院药理学教研室,江苏镇江 212013)
中国图书分类号:R-332;R329.24;R916.3;R977.3;R977.6;R995
摘要:目的 探讨低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、Rho关联卷曲螺旋蛋白激酶-2(Rho associated coiled coil forming protein kinase-2,ROCK-2)、叉头蛋白M1 (forkhead box protein M1,FoxM1)在醋酸铅[Pb(Ac)2]诱导大鼠肾上腺嗜铬细胞瘤PC12细胞损伤中的表达和意义。方法 将PC12细胞暴露于不同浓度的Pb(Ac)2(100、200、400 μmol·L-1)24 h以诱导细胞发生损伤。采用噻唑蓝比色法检测细胞的存活率,倒置显微镜观察细胞形态的变化,乳酸脱氢酶漏出率检测法测定细胞损伤程度,采用试剂盒检测丙二醛(malondialdehvde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)水平,Hoechst 33342单荧光染色法观察细胞凋亡,免疫印迹法检测细胞HIF-1α、ROCK-2、FoxM1、淋巴瘤/白血病-2(B cell lymphoma/leukemia,Bcl-2)和Bcl-2相关蛋白(Bcl-2 associated X protein,Bax)的表达。结果 MTT实验显示Pb(Ac)2对PC12细胞具有明显抑制作用并呈剂量依赖性,与对照组相比,Pb(Ac)2可增加细胞内LDH漏出率,升高MDA含量,降低SOD含量,诱导细胞发生凋亡。此外,Pb(Ac)2上调细胞HIF-1α、ROCK-2的表达,下调FoxM1的表达,提高Bax/Bcl-2的表达比例。结论 Pb(Ac)2诱导PC12细胞发生凋亡可能与HIF-1α、ROCK-2、FoxM1的表达以及自由基损伤有关。
关键词:醋酸铅;PC12细胞;细胞损伤;HIF-1α;ROCK-2;FoxM1
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.034.html
铅是一种普遍存在的工业毒物和环境污染物,长期低剂量接触铅对机体的各个系统都有不良影响,尤其是神经系统。铅对中枢和外周神经系统都有直接毒害作用,对胎儿和儿童影响最大,可造成儿童智力、记忆力和神经行为障碍[1]。目前对铅的神经毒性机制研究较多,但关于铅造成神经损伤的机制及可能的药物保护作用靶点仍需研究。因此,深入研究铅如何引起神经系统损伤,对于铅神经毒性的防护和治疗有着重要意义。
在神经细胞损伤过程中,有多种因子参与了细胞的死亡过程,其中低氧诱导因子-1(hypoxia-induc-ible factor-1,HIF-1)和Rho关联卷曲螺旋蛋白激酶(Rho associated coiled coil forming protein kinase,ROCK)受到了广泛的关注。HIF-1是细胞在缺氧条件下活化的重要转录因子,可调控RhoA和ROCK等蛋白的表达变化,尤其是ROCK-2[2]。在缺氧诱导脊髓神经细胞凋亡过程中,HIF-1α、ROCK-2、caspase-3表达上调[3],提示HIF-1α、ROCK-2参与了神经细胞的损伤过程。但目前仍不明确HIF-1α、ROCK-2是否参与调节铅诱导的神经细胞损伤。
叉头蛋白M1(forkhead box protein M1,FoxM1)属于FOX家族的转录因子之一[4],FoxM1在细胞周期的调节中起着重要作用,在细胞周期的各个时期
均有表达。FoxM1的缺失可导致有丝分裂纺锤体的形成缺陷、细胞分裂延迟,从而导致细胞有丝分裂受阻[5]。同时,FoxM1与细胞的增殖和凋亡也有关,在上皮和间质等高增殖细胞中,FoxM1呈高表达[6];在非洲爪蟾神经外胚层细胞的增殖中,FoxM1也起到了重要作用[7]。而盐屋霉素A和硫链丝菌肽等作为FoxM1的抑制剂能特异性拮抗FoxM1,从而达到促进细胞凋亡的作用[8]。但目前关于FoxM1在神经细胞损伤方面的研究较少。本实验选用大鼠肾上腺嗜铬细胞瘤PC12细胞作为实验对象,用不同浓度的醋酸铅[Pb(Ac)2]诱导损伤,探讨HIF-1α、ROCK-2、FoxM1在Pb(Ac)2诱导PC12细胞损伤中的作用,为研究铅神经毒性作用机制提供参考,同时为治疗铅中毒提供新思路。
1 材料与方法
1.1材料 大鼠肾上腺嗜铬细胞瘤PC12细胞株来自于中国科学院上海细胞库;DMEM培养基和胰蛋白酶购自美国Gibco公司;新生牛血清购自杭州四季青生物工程材料有限公司。Pb(Ac)2购自美国Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malonic dialdehyde,MDA)检测试剂盒均购自海门市碧云天生物技术研究所。噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]购自美国Amresco公司;Hoechst 33342购自美国Gibco公司。兔抗B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)单克隆抗体购自美国Cell Signaling Technology公司;兔抗HIF-1α、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体购自美国ImmunoWay公司;兔抗ROCK-2、FoxM1多克隆抗体购自美国Santa Cruz Biotechnology公司;鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自上海康城生物有限公司;辣根过氧化物酶或荧光基团标记的二抗均购自北京康为世纪公司;底物化学发光试剂购自美国Millipore公司。其余试剂均为国产分析纯。
1.2细胞培养及药物处理 将PC12细胞用含10%新生牛血清、1×105U·L-1青霉素、100 mg· L-1链霉素的高糖DMEM培养基培养,置于含5% CO2和95%空气的37℃培养箱中,每2天换液1次,待单层细胞生长至80%后传代培养。实验用细胞均处于指数生长期。
将细胞按5×107·L-1密度接种于96孔板和24孔板中,培养24 h后加入不同浓度的Pb(Ac)2,使其终浓度分别为100、200、400 μmol·L-1,继续培养24 h,对照组加入相应体积的DMEM。
1.3细胞存活率检测 采用MTT还原法检测细胞存活率。药物处理结束后,培养板每孔中加入MTT(终浓度为0.5 g·L-1),37℃反应4 h,倾去培养液,每孔加入100 μL DMSO,待完全溶解后,于490 nm处测定各孔吸光度。按公式:细胞增殖抑制率/%=(1-处理组吸光度/对照组吸光度)× 100%,计算抑制率。
采用LDH漏出率检测法检测细胞死亡率,按照LDH试剂盒说明书进行操作,并计算各组胞内LDH的含量。
1.4细胞内SOD、MDA含量检测 实验分组同上,采用黄嘌呤氧化酶法和硫代巴比妥酸法测定细胞内SOD和MDA的含量,检测按试剂盒说明书操作。
1.5细胞形态学检测 用不同浓度Pb(Ac)2处理PC12细胞后,于普通光学倒置显微镜下观察细胞形态并拍照,观察细胞形态变化。
1.6细胞凋亡检测 取对数生长期的PC12细胞,以每孔2×104个细胞接种于24孔培养板中,染毒处理后弃去培养液,用PBS洗涤,然后用冰甲醇固定细胞10 min。吸去固定液,加入Hoechst 33342染色液(终浓度为10 mg·L-1),于室温下反应5 min,经PBS洗涤后,用荧光酶标仪在激发光波长350 nm,发射光波长460 nm检测24孔培养板中荧光强度,用倒置荧光显微镜观察培养板中细胞的核变化并计算凋亡小体的数量。
1.7细胞HIF-1α、ROCK-2、FoxM1、Bax、Bcl-2蛋白的表达检测 PC12细胞经不同浓度的Pb(Ac)2处理后,收集细胞,提取总蛋白并测定蛋白浓度。以30 μg总蛋白上样进行电泳,转膜封闭后加入抗HIF-1α(1∶1 000)、ROCK-2(1∶1 000)、FoxM1(1 ∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)和GAP-DH(1∶7 000)抗体于4℃反应过夜。洗涤后,将膜和相应二抗(1∶5 000)在室温下反应1 h,以底物化学发光试剂显色后,以凝胶成像系统(Tanon 5200,南京麦高德生物科技公司)进行扫描,以Image J软件分析各条带灰度值。以GAPDH条带灰度值作参照,进行半定量分析。
2 结果
2.1Pb(Ac)2对PC12细胞存活率的影响 实验
结果表明,PC12细胞经不同浓度的Pb(Ac)2(100、200、400 μmol·L-1)染毒处理24 h,细胞存活率逐渐降低,100 μmol·L-1Pb(Ac)2即可引起细胞出现损伤,如Fig 1A所示。经计算,Pb(Ac)2引起PC12细胞损伤的IC50为(893±60.78)μmol·L-1。此外,如Fig 1B所示,LDH漏出率实验结果也表明Pb(Ac)2可明显引起PC12细胞损伤。

Fig 1 Treatment with Pb(Ac)2decreases viability in PC12 cells(±s,n=5)

Fig 2 Pb(Ac)2decreases SOD activity and increases MDA level in PC12 cells(±s,n=5)
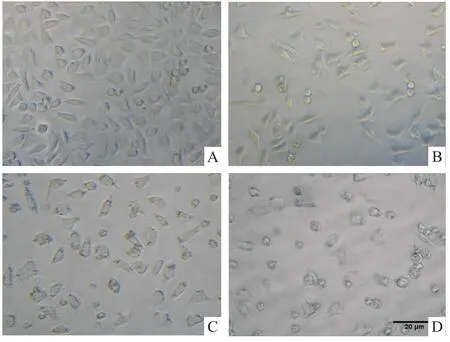
Fig 3 Morphological changes induced by Pb(Ac)2in PC12 cells
2.2Pb(Ac)2损伤PC12细胞后SOD和MDA的水平变化 本实验采用比色法检测了Pb(Ac)2诱导PC12细胞损伤后,细胞内SOD、MDA含量的变化。结果如Fig 2所示,PC12细胞经不同浓度Pb (Ac)2处理24 h后,随着药物浓度的逐渐加大,细胞内SOD含量明显下降,而MDA的含量明显增加。
2.3Pb(Ac)2对PC12细胞形态的影响 如Fig 3所示,对照组PC12细胞形态完整且饱满,并且轴突
较长。经100 μmol·L-1Pb(Ac)2损伤24 h后,PC12细胞密度减少并开始出现死亡;而400 μmol·L-1Pb(Ac)2则使细胞的胞体明显皱缩成圆形,轴突变短变少,导致大量细胞死亡。
2.4Pb(Ac)2对PC12细胞凋亡的影响 荧光染料Hoechst 33342能少许透过正常细胞的细胞膜,产生的蓝色荧光也较弱;而凋亡细胞由于膜通透性增强,从而进入细胞膜内的染料比正常细胞多,故荧光强度加强。如Fig 4A所示,经不同浓度的Pb(Ac)2处理细胞24 h后,对照组细胞核呈现均匀弥散荧光,200 μmol·L-1的Pb(Ac)2可导致细胞的细胞核浓缩碎裂,出现凋亡小体,蓝色荧光增强;而400 μmol·L-1的Pb(Ac)2则可导致大量细胞出现凋亡,蓝色荧光进一步增强,荧光强度和Hoechst阳性细胞数目经统计学分析与对照组相比差异有统计学意义(Fig 4B、C)。
2.5Pb(Ac)2对PC12细胞HIF-1α、ROCK-2、FoxM1、Bcl-2、Bax蛋白表达的影响 Bcl-2家族基因与细胞凋亡关系密切,其中Bcl-2和Bax是一对正负凋亡的调节基因,通过表达的蛋白发挥促进或抑制细胞凋亡的作用[9]。在细胞出现损伤的过程中,可造成Bax/Bcl-2表达比例增高,进而导致细胞凋亡。本实验通过Western blot的方法检测了HIF-1α、ROCK-2、FoxM1、Bax、Bcl-2的蛋白表达变化。如Fig 5所示,细胞经不同浓度Pb(Ac)2处理24 h后,HIF-1α和ROCK-2表达明显上调,而FoxM1表达明显降低,同时Bax/Bcl-2表达比例明显升高。
3 讨论
长期暴露于铅,可引起成人神经系统的损伤[10]。在阿尔茨海默病的相关神经病理学的研究中,将猴子和大鼠暴露于低浓度的铅中,可导致认知功能的下降[11]。目前已知的关于铅神经毒性机制的研究有很多,如铅可以诱导氧化应激引起细胞损伤,诱导细胞凋亡,诱导兴奋性毒性,损伤血管内皮细胞和中枢神经屏障系统等[12]。本实验结果显示,Pb(Ac)2(100~400 μmol·L-1)可剂量依赖性地引起大鼠PC12细胞损伤,导致细胞内氧自由基水平升高,出现凋亡。此外,Pb(Ac)2诱导了PC12细胞HIF-1α、ROCK-2的表达上调、Bax/Bcl-2的表达比例增加,FoxM1的表达下调。提示Pb(Ac)2可通过激活HIF-1α及ROCK-2,进而启动细胞凋亡程序,导致PC12细胞发生凋亡。
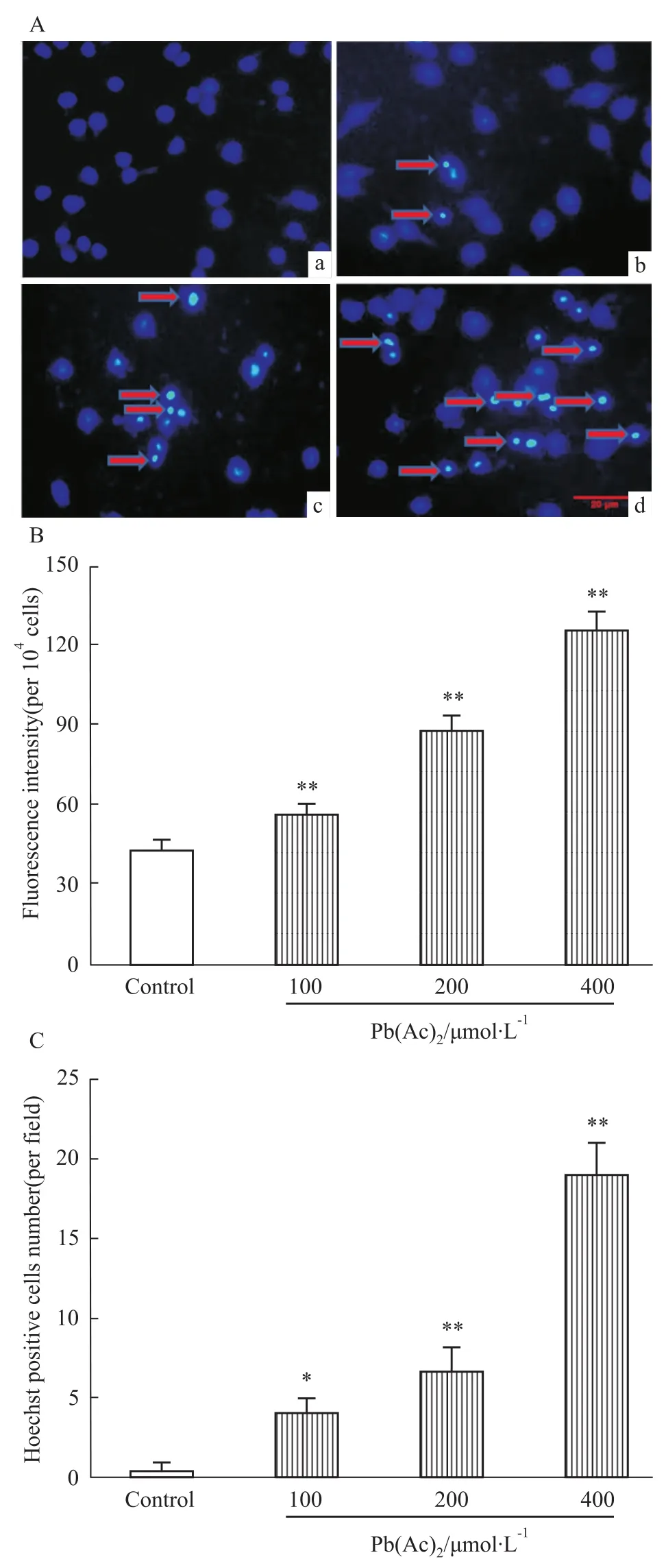
Fig 4 Pb(Ac)2enhances the cell apoptosis in PC12 cells
Pb(Ac)2可激动神经元膜上NMDA受体,导致钙离子内流使细胞钙超载,引起细胞损伤[13-14]。同时,铅可引起活性氧大量释放,导致神经组织氧化损伤,如Pb(Ac)2可引起大鼠脑组织大量产生活性氧,导致脂质过氧化损伤[15];而NMDA受体拮抗剂MK-801可减少活性氧产生,起到神经保护作用[16]。
本实验中,将PC12细胞暴露于不同浓度的Pb(Ac)224 h,存活率明显降低,LDH漏出率提高,细胞轴突缩短减少,胞体变圆。此外,Pb(Ac)2还能引起细胞内SOD和MDA含量水平的变化。SOD是一种蛋白酶,可清除氧自由基,发挥抗氧化作用,保护细胞免受损伤。当机体抗氧化体系能力降低时,过量氧自由基攻击生物膜而引发脂质过氧化反应,导致过氧化产物如MDA大量产生。因而SOD活性降低和MDA含量增加均提示氧自由基水平的增加,可间接反映细胞氧化应激的程度,说明细胞损伤可能与细胞内氧自由基水平的增加有关。
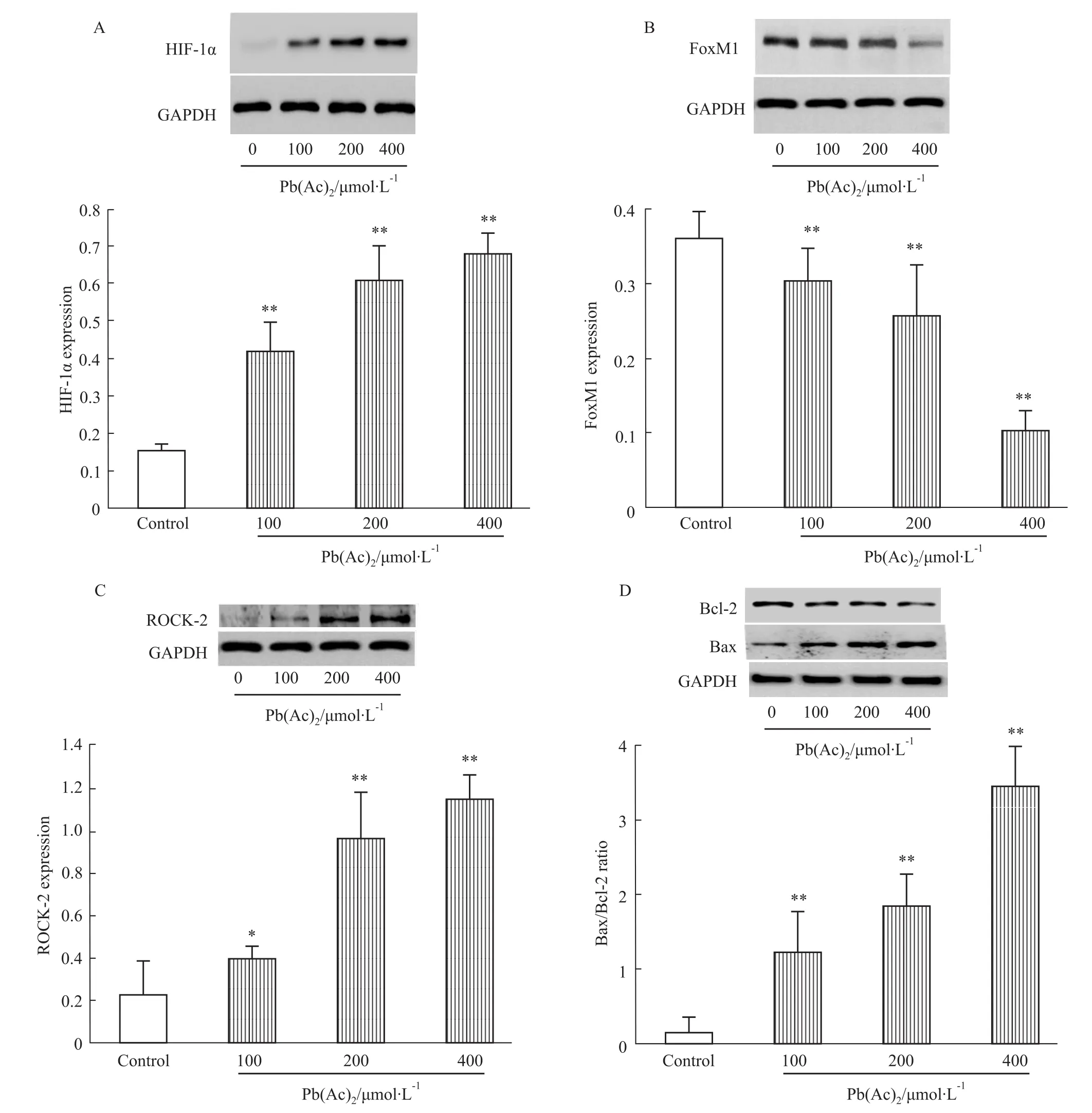
Fig 5 Pb(Ac)2increases expressions of HIF-1α,ROCK-2 and Bax/Bcl-2 ratio and decreases expression of FoxM1 in PC12 cells(±s,n=4)
HIF-1α是机体缺氧适应性反应过程中的一种
极其重要的核转录因子,HIF-1α及其介导的信号通路在神经细胞损伤过程中发挥了重要作用。离体培养的大鼠神经元在遭受缺血样损伤后,HIF-1α表达明显上调并集中于核内,最终因HIF-1α过表达导致细胞死亡[17];2-甲氧雌甾二醇作为HIF-1α的抑制剂可发挥保护作用[18],表明HIF-1α可能参与了神经损伤。在本实验中,100~400 μmol·L-1Pb(Ac)2作用PC12细胞24 h后,发现细胞内活性氧水平升高,进而导致HIF-1α表达明显增加,并且呈现出剂量依赖性,表明HIF-1α信号通路可能参与了PC12细胞损伤过程。同时,荧光染色的实验结果也证实,PC12细胞损伤后表现出形态的缩小,轴突缩短,细胞核皱缩等典型凋亡现象,表明Pb(Ac)2可诱导细胞出现凋亡性死亡。细胞凋亡是一种复杂的生化过程,有许多蛋白质参与了这一过程,包括凋亡前体蛋白Bax和抗凋亡蛋白Bcl-2,Bax/Bcl-2比值成为凋亡的重要生化指标[9]。HIF-1α的激活也可引起Bax/Bcl-2比值上升,进而诱导细胞发生凋亡[19]。与以上结果相一致,本实验中PC12细胞经Pb(Ac)2处理后Bax/Bcl-2表达比值增加,确认Pb(Ac)2可上调Bax/Bcl-2表达比例,诱导细胞凋亡。
在很多精神异常以及中枢神经系统损伤中,RhoA/ROCK-2通路都会被激活,从而影响细胞骨架的稳定性,抑制生长锥的形成以及轴突的恢复与再生,导致阿尔茨海默病、帕金森病、亨廷顿舞蹈病等多种退行性变的发生[20]。ROCK是一种丝氨酸/苏氨酸蛋白激酶,包括ROCK-1和ROCK-2两种亚型,其中ROCK-2与调整细胞骨架成分运动和基因表达调控有关。神经元轴突损伤后,ROCK表达增加,抑制ROCK的活化有利于神经突的再生以及神经元的上树突的分化,可保护神经元[21]。在海人藻酸诱导HT22神经细胞的退行性病变中,抑制ROCK-2可稳定神经丝,保护神经元的结构[22]。本实验的结果表明,Pb(Ac)2浓度200 μmol·L-1时就可引起PC12细胞内ROCK-2蛋白表达明显上调,推断ROCK-2的激活参与了铅神经毒性损伤的调节。
此外,FoxM1在细胞增殖和凋亡中也发挥重要作用。下调FoxM1可抑制乳腺癌细胞的生长、增殖和迁移侵袭[23];在紫花牡荆素诱导乳腺癌细胞凋亡过程中,FoxM1及下游靶分子生存素表达均下调[24];下调FoxM1抑制生存素也可诱导宫颈癌细胞凋亡[25],表明细胞增殖与凋亡的机制可能与FoxM1有关。但FoxM1大多用于肿瘤细胞的研究,神经细胞的研究报道较少。本实验结果发现,正常组细胞FoxM1高表达,Pb(Ac)2作用PC12细胞24 h后,FoxM1表达明显降低,表明FoxM1可能正性调节了神经细胞的存活。
综上所述,本研究证明了Pb(Ac)2可剂量性导致PC12细胞出现损伤,同时诱导HIF-1α、ROCK-2高表达,FoxM1低表达。表明HIF-1α/ROCK-2/FoxM1信号可能参与了该损伤过程。该结果提示,HIF-1α参与了铅的神经毒性,抑制HIF-1α及其下游信号通路可能具有减轻神经细胞损伤的作用。
参考文献:
[1] Chen A,Cai B,Dietrich K N,et al.Lead exposure,IQ,and be-havior in urban 5-to 7-year-olds:does lead affect behavior only by lowering IQ[J].Pediatrics,2007,119(3):e650-8.
[2] Pacary E,Tixier E,Coulet F,et al.Crosstalk between HIF-1 and ROCK pathways in neuronal differentiation of mesenchymal stem cells,neurospheres and in PC12 neurite outgrowth[J].Mol Cell Neurosci,2007,35(3):409-23.
[3] 袁 聪.Rho/ROCK-2及shROCK-2对缺氧性大鼠脊髓神经细胞凋亡的影响[D].昆明:昆明医科大学第一临床医学院,2013.
[3] Yuan C.The effect of Rho/ROCK-2 and shROCK-2 on apoptosis of spinal cord neurons in rats induced by hypoxia[D].Kunming:No.1 School of Clinical Medicine,Kunming Medical University,2013.
[4] Katoh M,Katoh M.Human FOX gene family(review)[J].Int J Oncol,2004,25(5):1495-500.
[5] Wang I C,Chen Y J,Hughes D,et al.Forkhead box Ml regulates the transcriptional network of genes essential for mitotic progression and genes encoding the SCF(Skp2-Cksl)ubiquitin ligase[J].Mol Cell Biol,2005,25(24):10875-94.
[6] Ye H,Kelly T F,Samadani U,et al.Hepatocyte nuclear factor 3/fork head homolog 11 is expressed in proliferating epithelial and mesenchymal cells of embryonic and adult tissues[J].Mol Cell Biol,1997,17(3):1626-41.
[7] Ueno H,Nakajo N,Watanabe M,et al.FoxM1-driven cell divi-sion is required for neuronal differentiation in early Xenopus em-bryos[J].Development,2008,135(11):2023-30.
[8] Bhat U G,Halasi M,Gartel A L.Thiazole antibiotics target FoxM1 and induce apoptosis in human cancer cells[J].PLoS One,2009,4(5):e5592.
[9] 吴文宁,王玉婵,董六一,等.青藤碱对大鼠海马神经元缺血损伤的保护作用[J].中国药理学通报,2014,30(4):527-31.
[9] Wu W N,Wang Y C,Dong L Y,et al.Sinomenine protects a-gainst ischemic injury in rat hippocampal neurons[J].Chin Pharmacol Bull,2014,30(4):527-31.
[10]van Wijngaarden E,Campbell J R,Cory-Slechta D A.Bone lead levels are associated with measures of memory impairment in older adults[J].Neurotoxicology,2009,30(4):572-80.
[11]Wu J,Basha M R,Brock B,et al.Alzheimer’s disease(AD)-like pathology in aged monkeys after infantile exposure to environ-
mental metal lead(Pb):evidence for a developmental origin and environmental link for AD[J].J Neurosci,2008,28(1):3-9.
[12]Marchetti C.Molecular targets of lead in brain neurotoxicity[J].Neurotox Res,2003,5(3):221-35.
[13]Neal A P,Worley P F,Guilarte T R.Lead exposure during synap-togenesis alters NMDA receptor targeting via NMDA receptor inhi-bition[J].Neurotoxicology,2011,32(2):281-9.
[14]Lee K Y,Chung H J.NMDA receptors and L-type voltage-gated Ca2+channels mediate the expression of bidirectional homeostatic intrinsic plasticity in cultured hippocampal neurons[J].Neuro-science,2014,277:610-23.
[15]Patra R C,Swarup D,Dwivedi S K.Antioxidant effects of α to-copherol,ascorbic acid and L-methionine on lead induced oxida-tive stress to the liver,kidney and brain in rats[J].Toxicology,2001,162(2):81-8.
[16]Müller A C,Maharaj H,Maharaj D S,Daya S.Aciclovir protects against quinolinic-acid-induced oxidative neurotoxicity[J].J Pharm Pharmacol,2005,57(7):883-8.
[17]姚 娟,马慧萍,杨 燕,等.缺氧环境对PC12细胞损伤及HIF-1 mRNA表达水平的影响[J].中国药理学通报,2011,27(2):162-6.
[17]Yao J,Ma H P,Yang Y,et al.Anoxic injury and HIF-1 mRNA expression changes after hypoxia in PC12 cell[J].Chin Pharma-col Bull,2011,27(2):162-6.
[18]Schaible E V,Windschügl J,Bobkiewicz W,et al.2-Me-thoxyestradiol confers neuroprotection and inhibits a maladaptive HIF-1alpha response after traumatic brain injury in mice[J].J Neurochem,2014,129(6):940-54.
[19]Naldini A,Morena E,Pucci A,et al.Hypoxia affects dendritic cell survival:role of the hypoxia-inducible factor-1α and lipopo-lysaccharide[J].J Cell Physiol,2012,227(2):587-95.
[20]Wishart T M,Rooney T M,Lamont D J,et al.Combining com-parative proteomics and molecular genetics uncovers regulators of synaptic and axonal stability and degeneration in vivo[J].PLoS Genet,2012,8(8):e1002936.
[21]Zhang Z,Ottens A K,Lamer S F,et al.Direct Rho-associated ki-nase inhibition[correction of inhibiton]induces cofilin dephos-phorylation and neurite outgrowth in PC-12 cells[J].Cell Mol Bi-ol Lett,2006,11(1):12-29.
[22]Jeon B T,Jeong E A,Park S Y,et al.The Rho-kinase(ROCK)inhibitor Y-27632 protects against excitotoxicity-induced neuronal death in vivo and in vitro[J].Neurotox Res,2013,23(3):238 -48.
[23]Ahmad A,Wang Z,Kong D,et al.FoxM1 down-regulation leads to inhibition of proliferation,migration and invasion of breast canc-er cells through the modulation of extra-cellular matrix degrading factors[J].Breast Cancer Res Treat,2010,122(2):337-46.
[24]刘莉萍,欧阳取长,曹建国,等.紫花牡荆素抑制FoxMl诱导乳腺癌细胞凋亡的研究[J].中国癌症杂志,2012,22(12):898-902.
[24]Liu L L,OuYang Q C,Cao J G,et al.Casticin induces breast cancer cell apoptosis by inhibition of FoxM1[J].China Oncol,2012,22(12):898-902.
[25]Chan D W,Yu S Y,Chiu P M,et al.Over-expression of FoxM1 transcription factor is associated with cervical cancer progression and pathogenesis[J].J Pathol,2008,215(3):245-52.
Expression changes of HIF-1α,ROCK-2,FoxM1 in the lead acetate-induced injury in PC12 cells
LI Yong-jin,ZHANG Yi,YANG Kai-yong,XI Ke,LI Shao-qiu,ZHU Chun-xue,CHEN Yue-fang,HUANG Xiao-jia
(Dept of Pharmacology,School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Abstract:Aim To investigate the expression and im-plication of HIF-1α,ROCK-2,FoxM1 in PC12 cell in-jury induced by lead acetate.Methods PC12 cells were treated with lead acetate at the doses of 100,200 and 400 μmol·L-1.The cell viability was determined by MTT reduction assay and LDH assay,the intracellu-lar production of oxygen species was measured by as-sessing SOD and MDA levels,cell apoptosis was deter-mined by Hoechst 33342 staining,the expressions of HIF-1α,ROCK-2,FoxM1,Bcl-2 and Bax were deter-mined by immunoblotting analysis.Results Lead ac- etate induced cell injury in PC12 cells in a dose-de-pendent manner,and it potentiated oxygen radical pro-duction and cell apoptosis.In addition,lead acetate enhanced HIF-1α and ROCK-2 expressions,increased Bax/Bcl-2 ratio and decreased FoxM1 expression.Conclusion Lead acetate can induce PC12 cell apop-tosis,which may be related with the expressions of HIF-1α,ROCK-2 and FoxM1.Cellular oxidative stress may contribute to the injury as well.
Key words:lead acetate;PC12 cells;cell injury;HIF-1α;ROCK-2;FoxM1
作者简介:李永金(1968-),男,博士,副教授,硕士生导师,研究方向:神经药理学,E-mail:lyj3600@163.com;黄晓佳(1980-),男,博士,副教授,研究方向:神经药理学,通讯作者,Tel:0511-88791201,E-mail:harold1980@163.com
基金项目:国家自然科学基金资助项目(No 81300059);江苏大学高级人才基金项目(No 08JDG005,11JDG092)
收稿日期:2015-07-01,修回日期:2015-08-03
文献标志码:A
文章编号:1001-1978(2015)11-1562-07
doi:10.3969/j.issn.1001-1978.2015.11.017