钩吻总碱对肝癌细胞氯通道的激活作用
王海波,孙晓雪,邓志钦,吕瑞玲,赖周毅,孟 龙,朱林燕,陈丽新,王立伟
(暨南大学医学院1.药理学系、2.生理学系,广东广州 510632)
钩吻总碱对肝癌细胞氯通道的激活作用
王海波1,孙晓雪2,邓志钦1,吕瑞玲2,赖周毅2,孟 龙2,朱林燕1,陈丽新1,王立伟2
(暨南大学医学院1.药理学系、2.生理学系,广东广州 510632)
中国图书分类号:R284.1;R329.25;R735.702.2
摘要:目的 探讨钩吻总碱对肝癌(HepG2)细胞氯通道的激活作用及对细胞容积的影响。方法 活细胞图像法观察记录钩吻总碱作用后HepG2细胞容积的变化;全细胞膜片钳技术记录钩吻总碱对HepG2细胞膜电流的作用,通过细胞外灌流高渗液,氯通道阻断剂tamoxifen和5-硝基-2-(3-苯丙胺)苯甲酸(NPPB)研究电流的生理学及药理学特性。结果 细胞外灌流钩吻总碱50 min,细胞体积减小(12.48± 2.2)%(P<0.01),该现象可被氯通道阻断剂tamoxifen抑制。膜片钳结果显示,细胞外灌流钩吻总碱(2 μmol·L-1)可激活HepG2细胞膜氯电流,该电流有明显外向优势,无电压及时间依赖性失活,其翻转电位为(-3.21±0.67)mV,接近氯离子平衡电位(-0.9 mV),可被氯通道阻断剂tamox-ifen和NPPB抑制,细胞外灌流47%高渗溶液亦可明显抑制该电流。结论 钩吻总碱可引起肝癌HepG2细胞体积缩小,诱导凋亡性容积缩小(AVD)发生,该作用可被氯通道阻断剂明显抑制,提示氯通道可能为钩吻总碱抗癌作用的靶点之一。
关键词:钩吻总碱;肝癌细胞;凋亡性容积缩小;膜片钳技术;氯通道;氯通道阻断剂
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.022.html
钩吻(gelsemium),又名大茶药、断肠草等,是马钱科植物葫蔓藤的根、叶及全草,全株有剧毒。长期以来,钩吻用于治疗湿疹、皮鞽、创伤性损伤、骨折、炎症、溃疡、慢性疼痛、焦虑等疾病[1]。近年来,人们开始关注钩吻的抗肿瘤作用。研究显示,钩吻总碱(gelsemium alkaloids)可抑制肝癌HepG2细胞、卵巢癌细胞、乳腺癌细胞等细胞增殖,时间依赖性和浓度依赖性诱导细胞凋亡[2-4]。
氯通道是人体各种细胞广泛分布的阴离子通道,参与细胞包括增殖、迁移等多种生理功能的调节,具有广泛而重要的生理意义。我们实验室的前期研究发现,氯通道参与多种抗肿瘤药物诱导细胞凋亡的过程,激活容积敏感性氯通道产生凋亡性容积缩小(apoptotic volume decrease,AVD)以启动细胞凋亡[5-7]。同时,研究发现,多种生物碱如长春新碱、小檗碱等均具有高效低毒的抗肿瘤作用[8-9]。钩吻总碱是提取于马钱科植物的一类吲哚生物碱,文献报道,其可浓度依赖性和时间依赖性诱导肝癌HepG2细胞凋亡,从而发挥抗肿瘤作用。然而,系统性的文献回顾,并未发现对钩吻总碱抗肿瘤作用离子机制的研究。本实验拟使用膜片钳技术研究钩吻总碱能否激活氯通道,进而探讨钩吻总碱的抗肿瘤作用是否与氯通道有关。
1 材料与方法
1.1细胞培养 人肝癌细胞(HepG2)培养于含10%胎牛血清的DMEM培养基,培养基加入双抗(10万IU·L-1青霉素、0.1 g·L-1链霉素),常规培养于37℃,饱和湿度,含体积分数为0.05的CO2细胞培养箱中,隔天传代1次。实验时使用0.25%胰酶常规消化并重悬细胞,将细胞悬液收集于4 mL EP管中,每次取200 μL接种于直径为22 mm的圆形玻片,于室温下静置30 min,待细胞贴壁后进行实验。
1.2药物与试剂 钩吻总碱由暨南大学药学院提供,溶解于二甲基亚砜(dimethyl sulpoxide,DMSO)配制成浓度为10 mmol·L-1的储存液,实验时用等渗灌流液稀释成终浓度为2 μmol·L-1的工作液。Tamoxifen购于Sigma公司,溶解于DMSO中,配制成浓度为20 mmol·L-1的储存液,实验时用相应的细胞外灌流液稀释成终浓度为20 μmol·L-1的工作液;NPPB购于Sigma公司,使用甲醇配制成100 mmol·L-1储存液,实验时稀释至100 μmol·L-1工作液。
1.3细胞容积测量 将附有贴壁细胞的玻片放入特制灌流浴槽中,于倒置显微镜下寻找合适的视野,设置拍摄程序,通过Image Pro Plus软件控制数字式摄像机动态拍摄,拍摄的图片使用ScIon Image图像分析软件进行处理。通过测量细胞面积,进行面积与体积的转换,转换公式为:V=4/3×π×(S/π)3/2。实验分为3组:对照组灌流1 h等渗液;加药组在灌流5 min等渗液后,在等渗液中加入2 μmol ·L-1钩吻总碱,继续记录55 min;阻断剂组在灌流5 min等渗液后,在等渗液中加入20 μmol·L-1tamoxifen预处理5 min后,再加入钩吻总碱与tamoxifen混合液继续记录50 min。对细胞体积进行标准化处理:Vst=(Vb÷Vi)×100%;Vb为钩吻总碱处理后的细胞体积,Vi为等渗情况下的细胞体积。运用公式计算出细胞容积缩小率:ΔV%=[(Vi-Vmin)÷Vi]×100%,Vmin为钩吻总碱处理后细胞的最小体积。
1.4膜片钳实验
1.4.1细胞外灌流液 等渗灌流液(isotonic solu-tion)渗透压为300 mOsmol·L-1,含(mmol·L-1):70 NaCl,2 CaCl2,0.5 MgCl2,10 HEPES,140 D-man-nitol;高渗液(47%hyper)渗透压为440 mOsmol· L-1,配方为等渗液中加入140 mmol·L-1的D-man-nitol。使用Osmomat 030冰点渗透压计(Osmomat 030;Gonotec,Germany)测定配制溶液的渗透压,用Tris碱调pH值至7.4。
1.4.2电极内液 电极内液含(mmol·L-1):70 N-methyl-D-glucamine chloride(NMDG-Cl),1 EGTA,1.2 MgCl2,10 HEPES,140 D-mannitol,2 ATP,用Tris碱调pH值为7.20。
1.4.3全细胞膜片钳记录 取指数生长期的HepG2细胞,用0.25%胰酶消化重悬,将细胞悬液收集于4 mL EP管中,使用移液器每次取200 μL接种于直径为22 mm的圆形玻片上,室温下静置30 min,待细胞贴壁后,将玻片黏附于特制浴槽并置于倒置显微镜进行实验。膜片钳参数设置及记录方法见参考文献[10]。
将贴有细胞的圆形玻片置于特制灌流系统中,采用全细胞记录模式记录HepG2细胞膜电流。在灌流等渗液时,记录下2~4 min的稳定背景电流,随后加入2 μmol·L-1钩吻总碱灌流细胞,保持灌流液面的平稳,观察并记录激活电流的潜伏期、电流密度等参量。待激活电流达峰并平稳后,分别加入47%高渗液、tamoxifen、NPPB,观察高渗液和氯通道阻断剂对钩吻总碱激活电流的影响,分别计算电流抑制率。抑制率计算公式:抑制率/%=[(Cmax-CIso)-(CBlockers-CIso)]/(Cmax-CIso)×100%,其中CIso为灌流等渗液时基础电流,Cmax为加入总碱后激活的最大电流,CBlockers为加入阻断剂后的最大电流。
1.5统计学处理 实验所得数据采用SPSS 13.0软件进行统计学分析,数据用±s表示,根据实验情况的不同,选择配对t检验或独立样本t检验进行显著性检验,每项实验至少重复3次。
2 结果
2.1钩吻总碱诱导HepG2细胞产生AVD 将贴壁的细胞玻片置于特制的灌流浴槽中持续细胞外灌流2 μmol·L-1钩吻总碱溶液,在倒置相差显微镜下选择合适的视野,通过拍图软件连续拍摄细胞图像,观察钩吻总碱对细胞容积的影响。如Fig 1A、C所示,细胞外灌流等渗液时HepG2细胞体积比较稳定,在观察的60 min内细胞体积无明显变化(n=15,P>0.05)。当细胞外灌流2 μmol·L-1钩吻总碱溶液时,可见细胞容积明显缩小,出现AVD现象(Fig 1B、D)。在细胞外灌流钩吻总碱溶液50 min后,细胞容积减小(12.48±2.2)%(n=15,P<0.01)。
2.2钩吻总碱诱导HepG2细胞产生的AVD可被氯通道阻断剂tamoxifen明显抑制 为了探讨AVD的出现是否与氯离子通道有关,本实验在细胞外预先灌流氯通道阻断剂tamoxifen后,继而灌流同等浓度的tamoxifen和钩吻总碱混合液。如Fig 2所示,
细胞外灌流tamoxifen 5 min后,细胞体积增大3.28%(n=15,P>0.05),继而灌流tamoxifen与钩吻总碱混合液后,细胞体积相比于tamoxifen灌流后的最大体积减小5.06%(n=15,P>0.05),相比于等渗液仅减小0.79%(n=15,P>0.05)。与单纯灌流钩吻总碱(细胞体积减小12.48%)相比,细胞体积缩小被明显抑制(n=15,P<0.01),这提示钩吻总碱引起HepG2细胞产生AVD可能与氯通道有关。
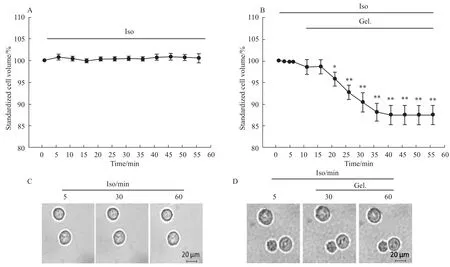
Fig 1 Changes of HepG2cell volume induced by gelsemium alkaloids(±s,n=15)
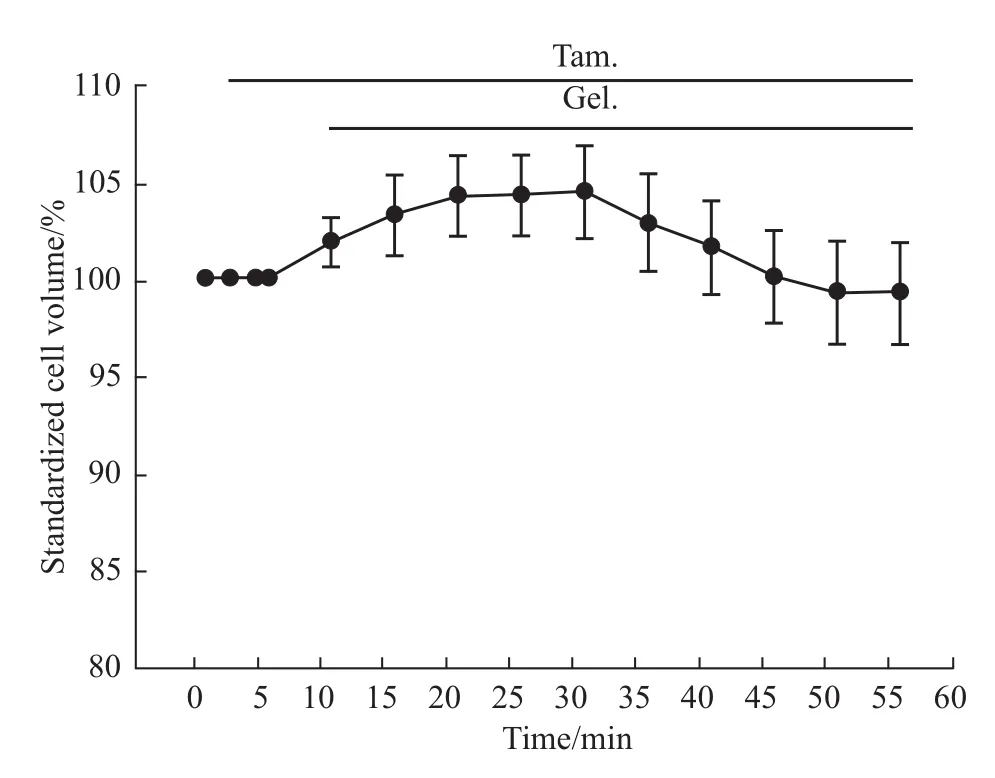
Fig 2 Effects of tamoxifen on AVD induced by gelsemium alkaloids in HepG2cell(±s,n=15)
2.3钩吻总碱可以激活HepG2细胞电流 钩吻总碱引起HepG2细胞产生AVD与氯通道有关,而AVD又是多种抗肿瘤药物诱导癌细胞凋亡的特征性事件。为了进一步探讨钩吻总碱是否可以开放氯通道,通过细胞内水外流最终引起细胞体积缩小,我们采用全细胞膜片钳技术记录细胞外灌流钩吻总碱后,HepG2细胞膜电流的变化。如Fig 3A所示,钩吻总碱可以激活肝癌HepG2细胞电流。Fig 3B所示,当细胞外灌流等渗液时,细胞基础电流较小,在+80 mV电压钳制下,外向电流密度为(3.18±0.72)pA ·pF-1,在-80 mV电压钳制模式下,内向电流密度为(3.30±0.79)pA·pF-1。当在等渗液中加入2 μmol·L-1钩吻总碱后,可以激活电流,其平均潜伏期为2.50 min(n=15)。在+80 mV电压钳制下,该激活电流外向电流密度为(33.20±2.85)pA· pF-1,内向电流密度为(21.94±3.03)pA·pF-1,呈
明显的外向优势(Fig 3B),无明显的时间和电压依赖性失活,该电流的翻转电位为(-3.21±0.67)mV,接近本实验条件下氯离子平衡电位理论值(-0.9 mV),这提示钩吻总碱激活的电流为氯电流。

Fig 3 Currents induced by gelsemium alkaloids in HepG2cell(±s,n=5)
2.4钩吻总碱激活的电流可被氯通道阻断剂tamoxifen和NPPB阻断 tamoxifen和NPPB是常用的氯通道阻断剂,为了证实钩吻总碱激活的膜电流为氯电流,我们观察了氯通道阻断剂tamoxifen和NPPB对该激活电流的作用。如Fig 4A所示,细胞外灌流2 μmol·L-1钩吻总碱可以激活一具有明显外向优势的电流,当细胞外灌流20 μmol·L-1tamoxifen后,可以完全抑制该电流。Fig 4B所示,在+80 mV电压钳制下,tamoxifen可使外向电流由(32.82±2.48)pA·pF-1下降至(2.81±0.83)pA ·pF-1(n=5,P<0.01),抑制率为(111.07± 5.58)%;在-80 mV电压钳制下,内向电流由(22.13±4.71)pA·pF-1下降至(1.99±0.42)pA ·pF-1(n=5,P<0.01),抑制率为(106.09± 2.25)%,tamoxifen对内、外向电流的抑制率差异没有统计学意义(n=5,P>0.05)。同样,NPPB对钩吻总碱激活的电流也有明显抑制(Fig 4C、D)。100 μmol·L-1NPPB作用后,外向电流由(31.20± 2.85)pA·pF-1下降至(4.64±0.39)pA·pF-1(n =5,P<0.01)抑制率为(95.24±5.97)%,内向电流由(21.94±3.30)pA·pF-1下降至(3.34±0.32)pA·pF-1(n=5,P<0.01),抑制率为(98.36± 5.60)%,NPPB对内、外向电流的抑制差异亦无统计学意义(n=5,P>0.05)(Fig 4C、D)。
2.5钩吻总碱激活的氯电流具有容积敏感性 上述实验证实了钩吻总碱引起HepG2细胞产生AVD的同时,可以激活HepG2细胞氯电流,这两种现象均可被氯通道阻断剂tamoxifen明显抑制。为了明确钩吻总碱激活的氯电流与细胞容积变化的关系,我们观察并记录了47%高渗溶液对钩吻总碱激活的氯电流的作用,以明晰氯通道在AVD中所起的作用。Fig 5A显示钩吻总碱激活的氯电流可被47%高渗溶液明显抑制。如图所示,细胞外灌流2 μmol ·L-1钩吻总碱可以激活一有外向优势的氯电流,当该电流达峰并稳定后,将钩吻总碱换为47%高渗液后,可见外向电流由(29.94±3.59)pA·pF-1下降为(4.32±0.80)pA·pF-1,抑制率为(92.86± 7.69)%,内向电流由(24.10±1.85)pA·pF-1下降至(2.92±0.24)pA·pF-1,抑制率为(93.96± 5.78)%,内、外向电流抑制率差异无统计学意义(n =5,P>0.05)。Fig 5B I/V曲线显示在加入钩吻总碱后,电流明显激活,激活的电流达峰稳定后,加入47%高渗液可明显抑制该电流(n=5,P<0.01)。
3 讨论
钩吻是马钱科植物葫蔓藤的全草,其全株有剧毒,以根、叶为主,钩吻总碱为其总生物碱提取物。在中国,钩吻长期用于治疗慢性疼痛、皮肤溃疡等疾病。
近年来,钩吻的抗肿瘤作用被广泛研究,研究表明钩吻可浓度依赖性和时间依赖性诱导多种肿瘤细胞凋亡。研究显示,多种钩吻碱单体如钩吻素子、钩吻碱甲及钩吻素己可明显抑制肝癌HepG2细胞增殖,其中钩吻素己对HepG2细胞有明显的时间和浓度依赖性抑制作用,而对正常的猴肾细胞无明显细胞毒性[2]。该研究发现,用钩吻碱处理48 h后的
HepG2细胞出现明显形态学改变,细胞明显皱缩并且漂浮,同时细胞周期被阻滞于S期,细胞凋亡率明显增加,caspase-3、caspase-8和caspase-9活性呈浓度依赖性增加。而Zhang等[11]在研究钩吻素子对人乳腺癌细胞(MCF-7)作用时发现,钩吻素子可明显诱导细胞凋亡,并阻滞细胞周期于G2/M期,同时发现,钩吻素子处理后的MCF-7细胞Bcl-2的表达下调,而Bax和caspase-3的表达上调。

Fig 4 Inhibition of gelsemium alkaloids activated currents by tamoxifen and NPPB(±s,n=5)

Fig 5 Inhibition of gelsemium alkaloids activated currents by 47%hypertonic solution(±s,n=5)
我们实验室前期工作表明,氯通道作为人体最为广泛的阴离子,参与多种细胞生理活动调节,包括细胞凋亡[12]、细胞容积调节[13]、细胞迁移[14]等。研究显示,抗肿瘤药物可通过诱导细胞凋亡而发挥抗肿瘤作用。紫杉醇可诱导人低分化鼻咽癌细胞(CNE-2Z)凋亡[6],顺铂可诱导人卵巢癌SKOV3/DDP细胞凋亡[15],这些研究发现,当细胞外灌流抗肿瘤药物时,细胞体积会缓慢减小,出现AVD,是细胞凋亡早期的特征性事件,离子流动在AVD中的作用已被普遍接受[16]。我们前期实验发现,在PC12细胞外灌流H2O2溶液时会引起细胞容积缩小,而氯通道阻断剂NPPB可以抑制H2O2引起的膜通透性增加和细胞皱缩,从而保护细胞免于凋亡[5],可见Cl-和水外流是AVD的主要机制之一。
本实验使用全细胞膜片钳技术直接观察钩吻总碱对人肝癌细胞(HepG2)氯电流的作用。实验结果表明,细胞外灌流含有钩吻总碱的等渗溶液可以激活一具有明显外向优势的电流,该电流无明显时间和电压依赖性失活,翻转电位为(-3.21±0.67)mV,接近于本实验条件下Cl-理论上的平衡电位(-0.9 mV),该电流可被氯通道阻断剂tamoxifen 和NPPB阻断,故确定这一电流为氯电流。我们发现,tamoxifen对钩吻总碱激活的内、外向氯电流抑制率均超过100%,这是因为tamoxifen不仅抑制了钩吻总碱激活的氯电流,同时阻断了基础状态下开放的氯通道,即阻断了背景氯电流,故抑制率超过100%。另一方面,在tamoxifen抑制钩吻总碱诱导的AVD实验中,我们看到,加入tamoxifen预处理的HepG2细胞容积略微增加(n=15,P>0.05),这也说明tamoxifen可以阻断基础状态下开放的氯通道,使水外流减少,从而引起细胞体积相对增加。在细胞AVD实验中似乎提示钩吻总碱激活的氯通道与细胞容积存在关系,为了验证这一猜想,在钩吻总碱激活的电流达峰并稳定后加入47%高渗溶液,我们发现,HepG2细胞明显皱缩,与此同时,钩吻总碱激活的氯电流几乎被完全抑制。我们前期工作发现,当细胞外灌流低渗溶液时,由于渗透压差,水分子跨细胞膜进入细胞引起细胞膨胀,细胞膨胀可激活容积敏感性氯通道,在电位差与浓度差的综合作用下,氯离子外流带走部分水,引起细胞体积缩小,即RVD(regulatory volume decrease)[17]。同理,当细胞外灌流高渗液后,由于细胞内外渗透压差,细胞失水皱缩,容积缩小,关闭了容积敏感性氯通道,这说明钩吻总碱激活的氯电流具有明显的容积敏感性。
综上所述,细胞外灌流钩吻总碱溶液可引起细胞容积减小,产生AVD现象,而氯通道阻断剂tamoxifen可以明显抑制这一现象。钩吻总碱激活的电流可被细胞外灌流47%高渗溶液抑制,显示出与低渗激活容积敏感性氯电流相似的特征[17],这说明该激活通道具有明显的容积敏感性,通过开放氯通道引起氯离子和水的外流,最终导致细胞容积缩小。而细胞容积缩小是细胞凋亡早期的特征性事件,这提示了钩吻总碱可能是通过诱导细胞凋亡性容积缩小过程而发挥抗肿瘤作用,而氯通道可能由于参与AVD的形成而作为钩吻总碱抗肿瘤作用的靶点之一。然而,容积敏感性氯通道是钩吻总碱抗肿瘤的直接靶点还是作为调节蛋白仍不清楚,有待进一步研究。
(致谢:本论文所涉及的所有实验均在暨南大学医学院501药理学实验室完成,在此对该实验室提供的实验帮助予以衷心的感谢。)
参考文献:
[1] Jin G L,Su Y P,Liu M,et al.Medicinal plants of the genus gel-semium(Gelsemiaceae,Gentianales)-a review of their phyto-chemistry,pharmacology,toxicology and traditional use[J].J Ethnopharmacol,2014,152(1):33-52.
[2] Gao M Y,Shen W Z,Wu Y H,et al.Study on anti-proliferation activity and the mechanisms of alkaloid monomers from gelsemium elegans on HepG2cell in vitro[J].J Chin Med Mat,2012,35 (3):438-42.
[3] Bhattacharyya S,Mandal S K,Biswas R,et al.In vitro studies demonstrate anticancer activity of an alkaloid of the plant gelsemi-um sempervirens[J].Exp Biol Med,2008,233(12):1591-601.
[4] Wahab K A,Ahmad F B,Din L B,et al.A study of the in vitro cytotoxic activity of gelsemium elegans using human ovarian and breast cancer cell lines[J].Trop Biomed,2004,21(2):139-44.
[5] Zuo W H,Zhu L Y,Bai Z Q,et al.Chloride channels involve in hydrogen peroxide-induced apoptosis of PC12 cells[J].Biochem Biophy Res Commun,2009,387(4):666-70.
[6] Zhang H F,Li H R,Yang L J,et al.The ClC-3 chloride channel associated with microtubules is a target of paclitaxel in its induced-apoptosis[J].Sci Rep,2013,3:2615.
[7] 柏志权,李华荣,张海峰,等.氯通道在藤黄酸诱导低分化鼻咽癌细胞凋亡中的作用[J].南方医科大学学报,2011,31(8):1304-8.
[7] Bai Z Q,Li H R,Zhang H F,et al.Role of chloride channels in gambogic acid-induced apoptosis of poorly differentiated nasopha-ryngeal carcinoma cells[J].J South Med Univ,2011,31(8):
1304-8.
[8] Ozdemir F,Akalin G,Sen M.Towards novel anti-tumor strategies for hepatic cancer:varepsilon-viniferin in combination with vin-cristine displays pharmacodynamic synergy at lower doses in HepG2cells[J].OMICS,2014,18(5):324-34.
[9] 刘善文,李 媛,李华荣,等.小檗碱激活人结肠癌细胞容积敏感的氯通道[J].生理学报,2011,63(6):517-24.
[9] Liu S W,Li Y,Li H R,et al.Berberine activates volume-sensi-tive chloride channel in human colorectal carcinoma cells[J].Ac-ta Physiol Sin,2011,63(6):517-24.
[10]孟 龙,王海波,邓志钦,等.冰片对鼻咽癌细胞容积敏感性氯通道的激活作用[J].中国药理学通报,2014,30(12):1671-6.
[10]Meng L,Wang H B,Deng Z Q,et al.Borneol activated volume-sensitive chloride channels in poorly differentiated nasopharyngeal carcinoma cells[J].Chin Pharmacol Bull,2014,30(12):1671-6.
[11]Zhang X,Chen Y,Gao B,et al.Apoptotic effect of koumine on human breast cancer cells and the mechanism involved[J].Cell Biochem Biophys,2015,72(2):411-6.
[12]Zhu L Y,Zuo W H,Yang H F,et al.Involvement of volume-acti-vated chloride channels in H2O2preconditioning against oxidant-induced injury through modulating cell volume regulation mecha-nisms and membrane permeability in PC12 cells[J].Mol Neurobi- ol,2013,48(1):205-16.
[13]Sun X R,Chen L X,Luo H B,et al.Volume-activated chloride currents in fetal human nasopharyngeal epithelial cells[J].J Membr Biol,2012,245(2):107-15.
[14]Mao J W,Yuan J,Wang L W,et al.Tamoxifen inhibits migration of estrogen receptor-negative hepatocellular carcinoma cells by blocking the swelling-activated chloride current[J].J Cell Physi-ol,2013,228(5):991-1001.
[15]余春燕,韩命龙,钟加滕,等.抑制ClC-3表达对顺铂诱导人卵巢癌SKOV3-DDP细胞凋亡的促进作用[J].吉林大学学报,2012,38(6):1016-9.
[15]Yu C Y,Han M L,Zhong J T,et al.Promoting effects of inhibi-ting ClC-3 expression on apoptosis induced by cisplatin in human ovarian cancer SKOV3/DDP cells[J].J Jilin Univ,2012,38 (6):1016-9.
[16]Hernandez-Enriquez B,Arellano R O,Moran J.Role for ionic flu-xes on cell death and apoptotic volume decrease in cultured cere-bellar granule neurons[J].Neuroscience,2010,167(2):298-311.
[17]Chen L X,Wang L W,Zhu L Y,et al.Cell cycle-dependent ex-pression of volume-activated chloride currents in nasopharyngeal carcinoma cells[J].Am J Physiol Cell Physiol,2002,283(4):C1313-23.
Activation effects of gelsemium alkaloids on chloride channels in hepatic carcinoma cells
WANG Hai-bo1,SUN Xiao-xue2,DENG Zhi-qin1,LYU Rui-ling2,LAI Zhou-yi2,MENG Long2,ZHU Lin-yan1,CHEN Li-xin1,WANG Li-wei2
(1.Dept of Pharmacology,2.Dept of Physiology,Medical College,Jinan University,Guangzhou 510632,China)
Abstract:Aim To investigate the effect of gelsemium alkaloids on chloride channels and cell volume in he-patic carcinoma cells.Methods The time-lapse live cell imaging and whole-cell patch clamp techniques were used respectively to detect the volume changes and currents induced by gelsemium alkaloids in HepG2cells.Results It was found that the cell volume was decreased by(12.48±2.2)%(P<0.01)when ex-posed to gelsemium alkaloids for 50 min and this phe-nomenon could be inhibited by the chloride channel blocker tamoxifen.It was shown by whole-cell patch clamping that a chloride current could be evoked by extracellular application of gelsemium alkaloids(2 μmol·L-1).The current was outward-rectified with-out obvious voltage-and time-dependent inactivation.The reversal potential of the current was(-3.21± 0.67)mV,which was close to the equilibrium poten-tial of chloride.The extracellular application of the chloride blockers,tamoxifen and 5-notro-2-(3-phenyl-propylamino)benzoic acid(NPPB),and 47%hyper-tonic solution inhibited the current significantly(P<0.01).Conclusion Gelsemium alkaloids could acti-vate chloride channels and induce a volume decrease (named apoptotic volume decrease,AVD),and these effect could be inhibited by chloride channel blockers.The results suggest that the chloride channel can be one of the targets of gelsemium alkaloids in their anti-cancer action.
Key words:gelsemium alkaloids;hepatic carcinoma cells;apoptotic volume decrease;patch clamp tech-niques;chloride channels;chloride channel blockers
作者简介:王海波(1991-),男,硕士生,研究方向:离子通道药理学,E-mail:931074539@qq.com;陈丽新(1955-),女,博士,教授,博士生导师,研究方向:肿瘤药理学、细胞生理与病理学,通讯作者,Tel:020-85228865,E-mail:chenlixinw@sohu.com;王立伟(1959-),男,博士,教授,博士生导师,研究方向:细胞生理学,通讯作者,Tel:020-85226565,E-mail:wangli-weic@sohu.com
基金项目:国家自然科学基金资助项目(No 81273539,81173064);教育部基金资助项目(No 20124401110009);广州市科技计划基金资助项目(No 2013J450015);东莞科技计划基金资助项目(No 2011108102006)
收稿日期:2015-07-15,修回日期:2015-08-26
文献标志码:A
文章编号:1001-1978(2015)11-1529-07
doi:10.3969/j.issn.1001-1978.2015.11.011

