异甘草素抗肿瘤活性及初步机制研究
王志强,张秀英,李文广,黄双盛,刘圆圆,胡腊梅,侯翠兰,张小郁
(1.兰州大学基础医学院;2.甘肃省妇幼保健院生殖医学中心;3.甘肃省人民医院急诊科;4.西北民族大学医学院,甘肃兰州 730000)
异甘草素抗肿瘤活性及初步机制研究
王志强1,2,张秀英3*,李文广1*,黄双盛4,刘圆圆1,胡腊梅1,侯翠兰1,张小郁1
(1.兰州大学基础医学院;2.甘肃省妇幼保健院生殖医学中心;
3.甘肃省人民医院急诊科;4.西北民族大学医学院,甘肃兰州 730000)
中国图书分类号:R284.1;R329.24;R364.3;R979.1
摘要:目的 探讨异甘草素(isoliquiritigenin,ISL)抗肿瘤活性及初步机制。方法 采用SRB法检测ISL对A549、SW620和HMEC-1细胞增殖的抑制作用;Transwell小室检测ISL对HMEC-1细胞迁移能力的影响;明胶酶谱法检测ISL 对HMEC-1细胞MMP-2和MMP-9的表达;管样结构形成实验测定ISL对HMEC-1细胞管样结构形成能力;细胞内活性氧(ROS)通过荧光探针DCFH-DA进行测定;流式细胞术检测ISL对HMEC-1的细胞周期。鸡胚绒毛尿囊膜血管生成实验检测ISL体内抗血管生成作用。结果 ISL可明显抑制A549、SW620和HMEC-1细胞的增殖、HMEC-1细胞的迁移、管样结构形成以及细胞内MMP-2和MMP-9的表达,且均呈现浓度依赖关系。同时,ISL还可抑制HMEC-1细胞内由VEGF诱导产生的ROS量,且存在浓度依赖关系。流式细胞术检测发现高浓度ISL可将HMEC-1细胞阻滞于S期,而低浓度ISL通过诱导细胞凋亡来抑制HMEC-1细胞的增殖。ISL能明显抑制鸡胚尿囊膜新生毛细血管的生成。结论
ISL具有明显的抗肿瘤活性,能抑制血管生成,其机制可能与清除HMEC-1细胞内ROS生成,诱导细胞凋亡有关。
关键词:异甘草素;抗肿瘤;血管生成;人微血管内皮细胞;血管内皮生长因子;细胞凋亡
网络出版时间:2015-7-22 10:42 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.029.html
血管生成(angiogenesis)在肿瘤的生长和发展过程中起着十分重要的作用[1-3],血管生成过程是一系列复杂的生物学过程,且受多种因子的调节,通过血管生成过程形成的新生毛细血管为肿瘤细胞提供生长所需的氧气和其他营养物质,是肿瘤生长和代谢的有力保障。因此,通过阻断肿瘤的血管生成过程来抑制肿瘤的生长成为抗肿瘤药物开发的一条有效的途径。
异甘草素(isoliquiritigenin,ISL)为甘草中异黄酮类化合物,主要存在于甘草及许多植物的根部,已被证明具有广泛的生物学活性,尤其在抗炎、抗氧化、抗肿瘤等方面具有良好的效果[2,4-5]。研究表明[6-10],ISL发挥其抗肿瘤作用是通过抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡,以及通过阻断与肿瘤进展密切相关的信号转导途径来抑制肿瘤的生长。但尚未见有关ISL对肿瘤血管生成方面的研究。因此,本实验将在前期研究的基础上,通过人微血管内皮细胞HMEC-1,研究ISL对肿瘤血管生成的作用及其机制。
1 材料
1.1试剂 异甘草素购自江西中草药天工科技有限公司,纯度>98%,溶解于二甲基亚砜(DMSO),DMSO在各实验组与阴性对照组中终浓度均为0.5%(V∶V)。重组人血管内皮生长因子(VEGF165)购自Peprotech公司;MCDB 131培养基、表皮生长因子(EGF)、氢化可的松、SRB和DCFH-DA均购自Sigma公司;DMEM培养基和L-15培养基为Invitrogen公司生产;Matrigel购自BD Biosci-ence公司。
1.2细胞株 人微血管内皮细胞(human microvas-cular endothelial cell-1,HMEC-1)、肺癌细胞A549和结肠癌细胞SW620均购自中国科学院上海细胞研究所。
2 方法
2.1细胞培养 HMEC-1细胞培养用含有20%胎牛血清的MCDB 131完全培养基;A549细胞用10%胎牛血清的DMEM完全培养基;SW620细胞用10%胎牛血清的L-15完全培养基。各细胞的培养均在37℃、5%CO2的条件下进行。
2.2细胞增殖活性 细胞增殖活性实验采用SRB法。将细胞消化处理,吹打成单细胞悬液并稀释到所需密度后,接种到96孔板,每孔100 μL。放至CO2培养箱继续培养24 h,待细胞贴壁,再分别加入各浓度的ISL处理,待药物作用24、48、72 h之后,分别取出96孔板,用预冷的10%三氯乙酸固定,1 ~2 h后用蒸馏水洗3~4次,自然晾干后SRB染色30 min,1%醋酸洗涤,室温干燥,再每孔加入10 mmol·L-1Tris碱溶液150 μL溶解,酶标仪570 nm波长测定其吸光度值。
2.3迁移实验 使用改良的博伊登Transwell小室测定ISL对HMEC-1细胞迁移能力的影响。取对数生长期的细胞消化、计数,调整细胞数至5×108· L-1,将Transwell小室装配到24孔板中,分别在上室中加入360 μL细胞悬液和40 μL不同浓度的ISL,下室则均为20%血清的MCDB 131培养基,置CO2培养箱继续培养,24 h后取出小室,PBS缓冲液洗涤3次,棉棒轻轻擦去上室细胞,甲醇固定30 min,结晶紫染色6 min,最后再用PBS洗去结合的结晶紫,镜下观察迁移情况并记录结果。
2.4管样结构形成实验 将预先放入4℃冰箱的Matrigel取出置于冰浴,用MCDB 131培养基稀释Matrigel至所需浓度后,每孔60 μL铺到96孔板中,37℃凝固30 min。取对数生长期细胞消化、计数,调整细胞数至大约8×108·L-1,取出已凝固的Matri-gel,每孔加HMEC-1细胞悬液90 μL,待细胞沉降后,各孔分别加入相应浓度ISL,然后将96孔板在37℃、5%CO2继续培养,8 h后照相记录。
2.5明胶酶谱检测 HMEC-1细胞内基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)的表达采用明胶酶谱法进行。取对数生长期细胞,D-hanks洗涤3次,加入已配制好的各浓度ISL无血清培养。24 h后收集各浓度下细胞培养液,离心(4℃、2 000 r·min-1、10 min)、分装。实验时,取上述样品,37℃处理30 min,聚丙烯酰胺凝胶电泳分析,电泳结束后,洗涤缓冲液洗涤2 h,37℃水浴孵育至少24 h,考马斯亮蓝R-250染色,脱色液适当脱色,照相记录。
2.6VEGF诱导细胞内ROS的生成检测 取对数生长期细胞接种于6孔板中,待细胞贴壁后继续培养至铺满6孔板底面40%~60%时,各孔加入各浓度ISL,无血清处理4 h。处理完毕后,6孔板各孔(除外溶媒对照)分别加入50 μg·L-1的VEGF作用10 min,再用DCFH-DA染色30 min,PBS洗涤3 ~5次,荧光显微镜下观察结果并照相记录。
2.7细胞周期测定 HMEC-1细胞周期的测定是经PI染色后流式细胞仪检测,取对数生长期细胞并用各浓度ISL处理24 h后,收集细胞并用PBS洗3次,无水乙醇固定,上机测定并记录数据,分析ISL对细胞周期的影响。
2.8鸡胚绒毛尿囊膜检测血管生成 取7日龄鸡胚,在相应位置开窗(1 cm×1 cm),制备鸡胚绒毛尿囊膜模型。再用已制备好的无菌硝酸纤维素膜吸附各浓度ISL并放置到相对无小血管区域继续孵化,每隔24 h更换纤维素膜并重新加药,72 h后取出鸡胚,镜下观察ISL对鸡胚尿囊膜血管生成的影响,并照相记录。
2.9统计学处理 所有数据均采用Excel建立数据库,数值资料用±s表示,多组之间的比较采用单因素方差分析(ANOVA)。图片资料的处理使用Image pro plus 6.0软件。
3 结果
3.1ISL对细胞增殖活性的影响 SRB结果显示(Fig 1),ISL可明显抑制A549、SW620和HMEC-1细胞的增殖活性,且呈现明显的浓度、时间依赖关系(P<0.05)。ISL对A549在24、48、72 h的IC50分别为123.05、60.46、39.09 μmol·L-1;对SW620在24、48、72 h的IC50分别为41.73、27.78、26.98 μmol ·L-1;对HMEC-1细胞在24、48、72 h的IC50分别为161.36、54.30、39.40 μmol·L-1。
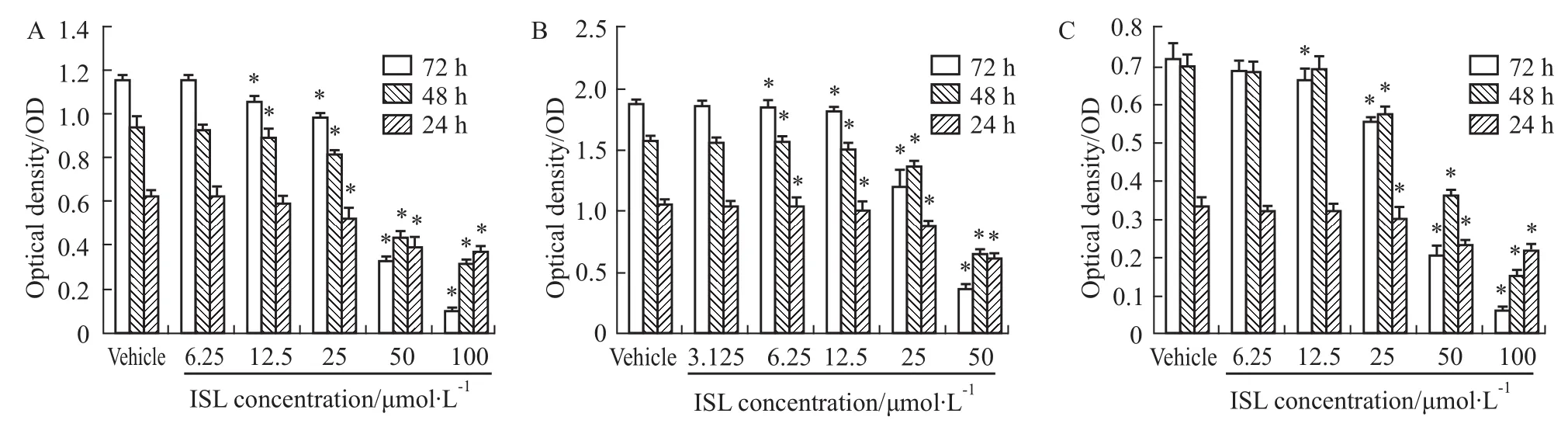
Fig 1 Inhibitory effects of ISL on proliferation viability of SW620,A549 and HMEC-1 cells for 24,48 and 72 h by SRB assay
3.2ISL对HMEC-1细胞迁移活性的影响 迁移实验结果表明(Fig 2),ISL可明显抑制HMEC-1细胞的迁移能力,溶媒对照组HMEC-1细胞迁移数目最多,而ISL处理组中,随着浓度的不断增加,发生迁移的细胞数越来越少,且呈明显的浓度依赖关系(P<0.05)。ISL在6.25~100 μmol·L-1范围内对HMEC-1细胞的迁移抑制率在不断增加,分别为21.35%、40.38%、49.72%、64.38%和75.80%。
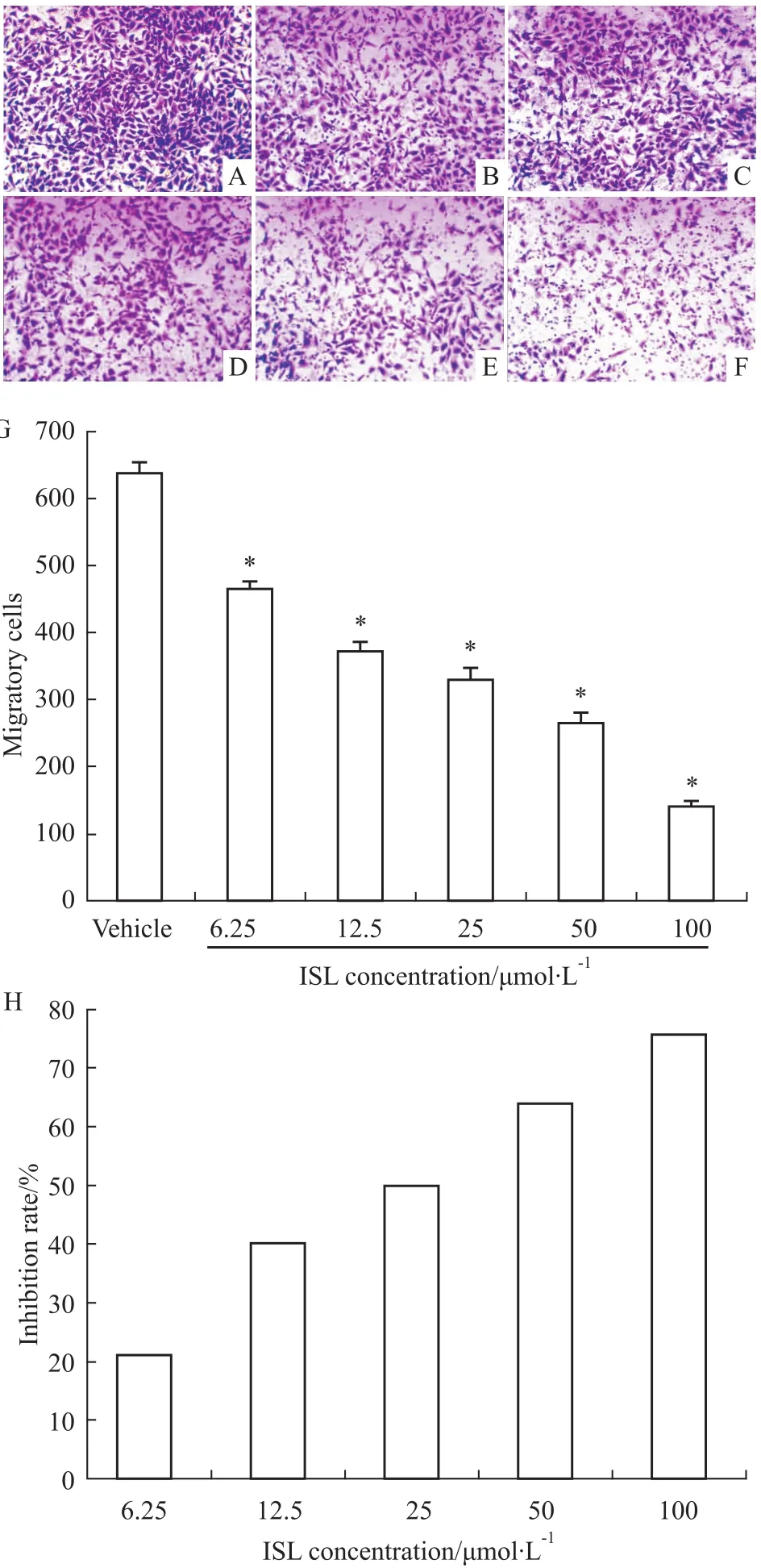
Fig 2 Effects of ISL on HMEC-1 cell migration activity
3.3ISL对细胞管样结构的影响 通过3次实验,结果如Fig 3显示,对照组中HMEC-1细胞所形成管腔样结构较多且管壁比较完整,而ISL处理组中随着ISL浓度的增加,管腔样结构数量不断减少,且管壁越来越不完整,当浓度达到100 μmol·L-1时,基本没有管样结构形成,说明ISL能够明显抑制管样结构的形成(P<0.05)。在ISL浓度为25、50、100 μmol·L-1时,其抑制率分别为20.96%、51.85%、80.91%。
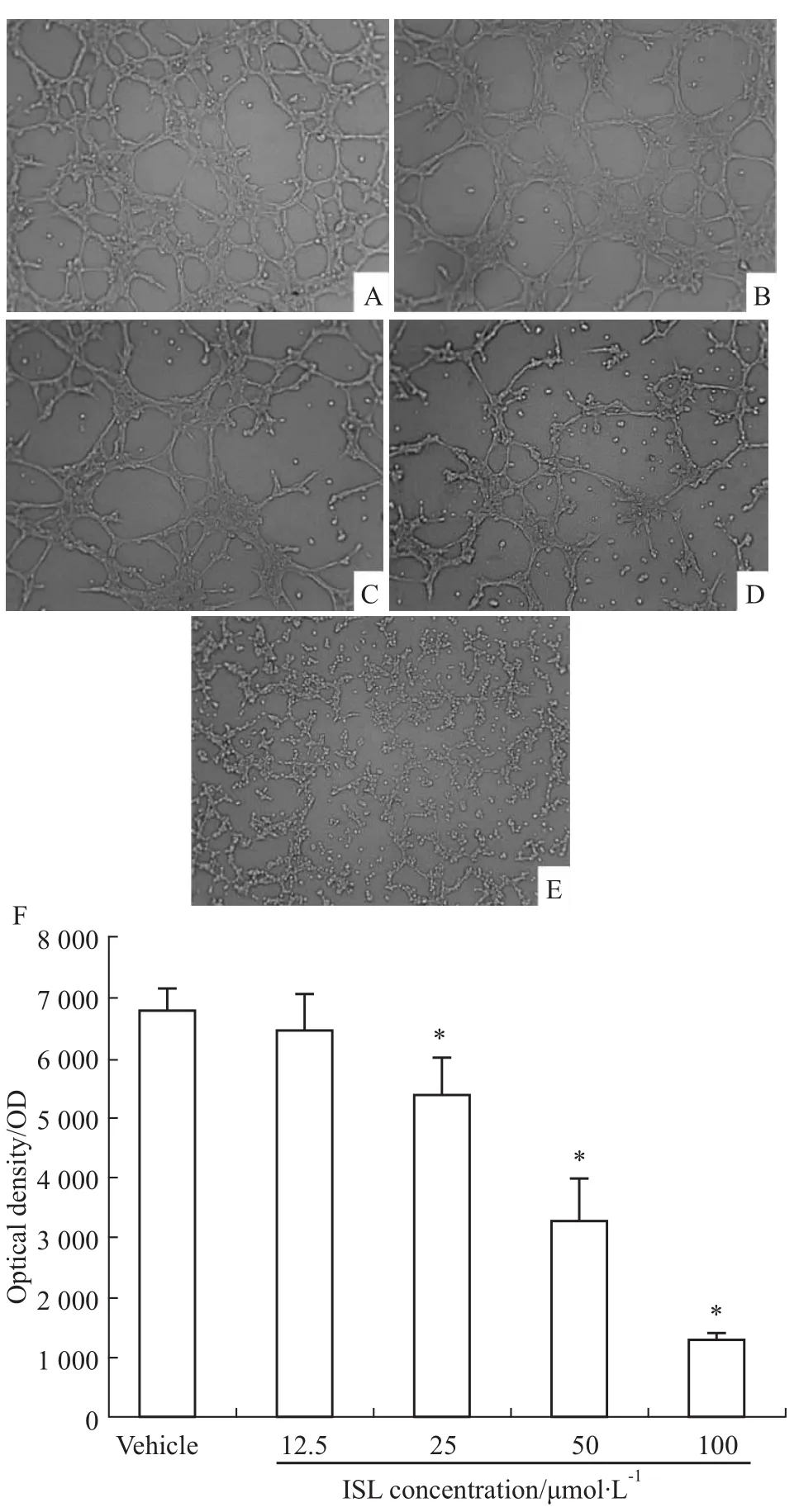
Fig 3 Inhibitory effects of ISL on tube formation of HMEC-1 cells
3.4ISL对HMEC-1细胞表达MMP-2和MMP-9的影响 明胶酶谱法检测结果显示,ISL对MMP-2和MMP-9的表达产生明显的抑制作用(Fig 4)。
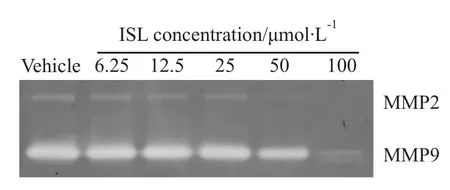
Fig 4 Effects of ISL on MMP-2 and MMP-9 expression in HMEC-1 cells for 24 h by gelatin zymographic detection
3.5ISL对HMEC-1细胞内ROS生成的影响VEGF可明显刺激细胞内ROS的生成,而ISL可明显抑制VEGF诱导的细胞内ROS的生成,且呈现明显的浓度依赖关系(P<0.05)。ISL为12.5~100 μmol·L-1时,其抑制率分别为34.00%、58.27%、75.74%、87.94%(Fig 5)。
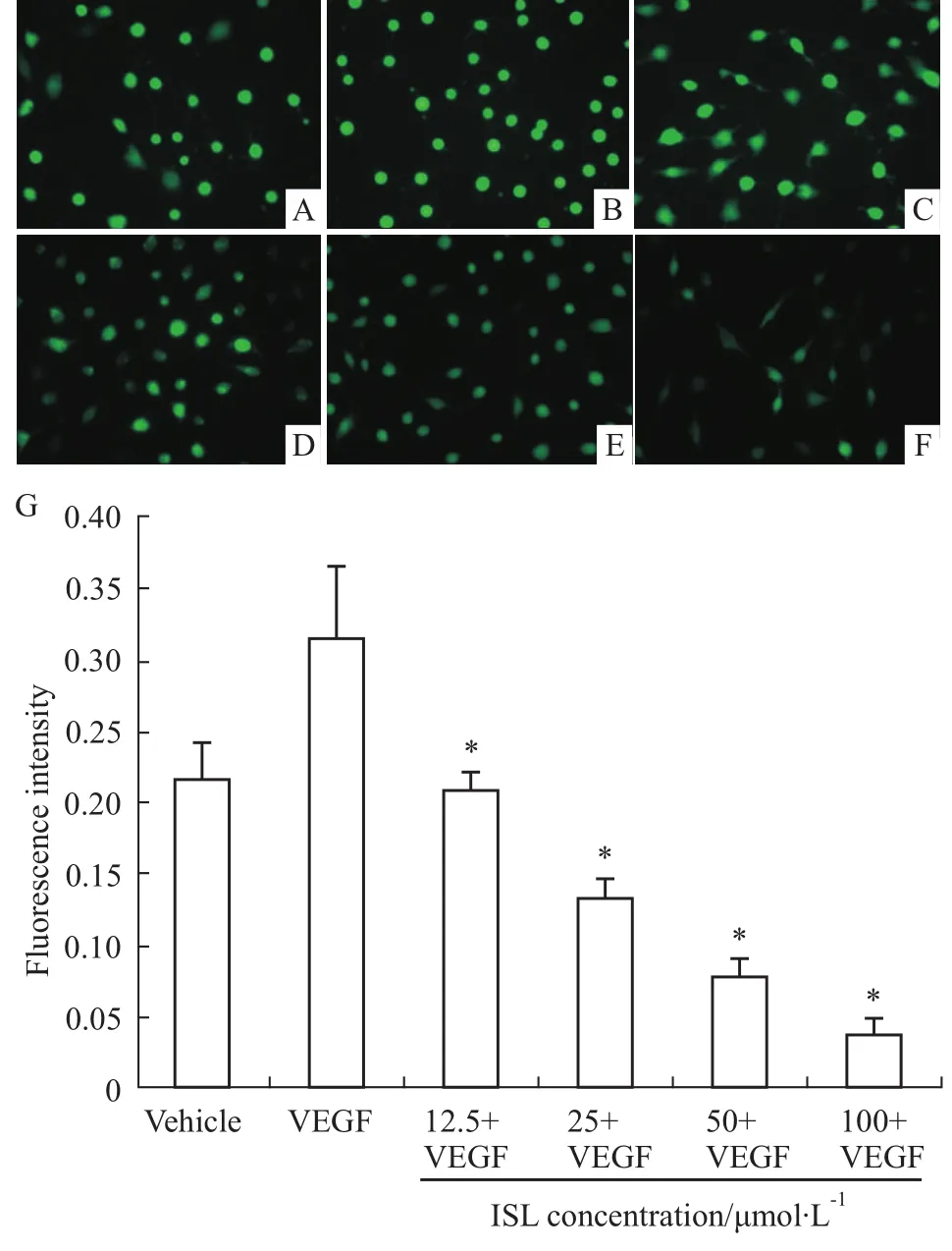
Fig 5 Inhibitory effects of ISL on VEGF-induced ROS generation in HMEC-1 cells under a contrast fluorescence microscope(200×)
3.6ISL对细胞周期的影响 流式细胞术结果显示(Fig 6),给药组随着药物浓度的增加,其处于S期的细胞明显增多,而ISL为12.5 μmol·L-1时,则出现凋亡峰,说明ISL在高浓度(>25 μmol·L-1)时,主要将HMEC-1细胞阻滞在S期,而低浓度ISL则是通过诱导细胞凋亡来实现其抑制作用的。
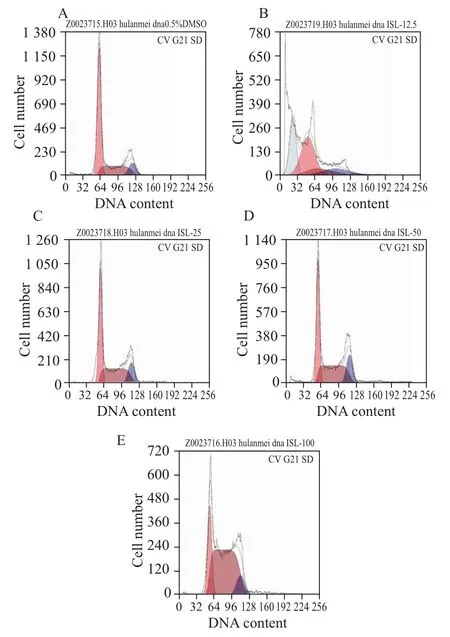
Fig 6 Effects of ISL on HMEC-1 cell cycle for 24 h by flow cytometry
3.7ISL对鸡胚绒毛尿囊膜血管生成的影响 如Fig 7所示,对照组给药区域周围可见大量丰富的新生毛细血管,而ISL给药组随着ISL浓度的增大,其新生毛细血管密度明显减少,当ISL为2 μg·egg-1时,给药区域基本无新生毛细血管生成。
4 讨论
血管生成与肿瘤的发生发展密不可分,新生血管可为肿瘤细胞的增殖、代谢和浸润提供必需的营养物质,是肿瘤生长和转移的保障[11]。肿瘤为了获得快速生长所需的各种养分,必须建立强大的血管网系统,这就要求肿瘤本身具有一套特殊、完整的血管形成机制来调节其血管生成。因此,近年来,与肿瘤血管生成有关的调节、诱导因子以及信号转导通路成为抗肿瘤药物研究的焦点。国内外许多研究报道[12-13],ISL在抗肿瘤、抗炎、抗氧化等方面具有强大的潜能,但极少有在抑制肿瘤血管生成方面的报道。本研究即从肿瘤血管生成的各个环节出发,探讨ISL对肿瘤血管生成过程的影响以及ISL在抗肿瘤方面的应用价值。
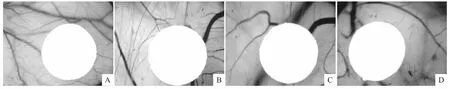
Fig 7 Antiangiogenesis effect of ISL on chorioallantoic membrane
本实验结果发现,ISL可明显抑制A549和SW620细胞的增殖,证实了ISL的抗肿瘤活性,同时,ISL可以明显地阻滞血管内皮细胞的增殖,说明ISL发挥其抗肿瘤作用不仅通过直接抑制肿瘤细胞的生长,还具有抗肿瘤血管生成作用。随着ISL作用时间的延长和浓度的增加,ISL对肿瘤细胞和HMEC-1细胞增殖的抑制作用也越来越明显。此外,本实验还通过流式细胞方法分析ISL对HMEC-1细胞增殖周期的影响,结果表明,在较高浓度时,ISL主要通过将细胞阻滞于S期来抑制HMEC-1细胞增殖,而在低浓度时,其主要是通过诱导细胞凋亡来发挥作用的。
内皮细胞的出芽是血管生成的启动步骤,在出芽过程中,内皮细胞需要迁移到基膜下细胞外基质形成管样结构来作为血管骨架,而HMEC-1细胞可以分泌一系列生物蛋白酶来降解细胞外基质,帮助HMEC-1细胞顺利地向细胞外基质迁移。体内与降解细胞外基质有关的酶主要为基质金属蛋白酶家族(MMPs)。研究发现,大多数肿瘤细胞和内皮细胞中都有MMPs的表达,尤其以MMP-2和MMP-9为代表的明胶酶在血管生成过程中扮演着十分重要的角色,其表达量可明显影响HMEC-1细胞对细胞外基质的降解能力,从而影响细胞的迁移活性和肿瘤血管生成过程。本研究发现,ISL可以明显抑制HMEC-1细胞表达MMP-2和MMP-9,且呈现出明显的浓度依赖关系。同时,本研究还通过迁移实验发现,HMEC-1细胞可在VEGF的诱导下发生自发性迁移,促进血管生成过程,而ISL可明显降低HMEC-1细胞的自发性迁移。以上研究说明ISL不仅可以直接抑制HMEC-1细胞的迁移,而且还通过抑制HMEC-1细胞对MMP-2和MMP-9的表达而影响HMEC-1细胞的迁移活性。
肿瘤的发生、转移和浸润生长都有体内ROS的参与和调节,同时,肿瘤血管生成也与体内ROS的调节密切相关。许多体内外实验表明[14-15],ROS能够在血管生成过程发挥明显的刺激作用,但是其作用的具体机制目前仍然没有被完全阐明。大多数学者认为,NADPH氧化酶作用产生的ROS可以刺激黏附分子、细胞因子以及MMPs的表达,而ROS对血管生成的影响可能是通过ROS刺激MMPs的活性,以及刺激产生一些可以促进基膜降解和内皮细胞迁移的血管生成整联蛋白而发挥作用的。除此之外,ROS可增强与血管生成过程密切相关的细胞因子的作用,如VEGF、FGF等,从而加强内皮细胞增殖和管样结构形成能力,促进血管生成过程的顺利进行。本实验表明,ISL可明显抑制HMEC-1细胞由VEGF诱导产生的ROS量,且具有明显的浓度依赖关系,说明ISL可通过干扰细胞内ROS生成来抑制肿瘤的血管新生。
本实验还通过鸡胚绒毛尿囊膜探讨了ISL的体内抗血管生成活性,结果显示,随着ISL剂量的不断增加,尿囊膜新生毛细血管也相应减少,说明ISL在体内抗血管生成方面具有很大的潜力,但其具体量效关系还有待进一步实验加以证明。
本研究的创新点在于首次将ISL的抗肿瘤活性同人微血管内皮细胞血管生成过程相结合,深入探讨了ISL对血管生成过程中VEGF介导的血管新生的抑制作用,为证实其抗肿瘤活性提供了可靠的实验依据。
综上所述,ISL是一种新的肿瘤血管生成抑制剂,其抗肿瘤作用是一个综合效应。虽然目前对ISL抗肿瘤活性已经有了初步的认识,但如何将其开发成可用于临床的抗肿瘤药物及其临床应用的实用价值,仍需进一步研究进行探讨。
(致谢:本实验是在西北民族大学医学院分子生物室黄双盛教授帮助下完成,感谢兰州大学医学实验中心的大力帮助。)
参考文献:
[1] Kaneshiro T,Morioka T,Inamine M,et al.Anthraquinone deriv-ative emodin inhibits tumor-associated angiogenesis through inhibi-tion of extracellular signal-270 regulated kinase 1/2 phosphoryla-tion[J].Europ J Pharmacol,2006,553(1-3):46-53.
[2] Sun Z J,Chen G,Zhang W,et al.Mammalian target of rapamy-cin pathway promotes tumor-induced angiogenesis in adenoid cystic carcinoma:its suppression by isoliquiritigenin through dual activa-tion of c-Jun NH2-terminal kinase and inhibition of extracellular signal-regulated kinase[J].J Pharmacol Exp Ther,2010,334 (2):500-12.
[3] Hendriksen E M,Span P N,Schuuring J,et al.Angiogenesis,hypoxia and VEGF expression during tumour growth in a human xenograft tumour model[J].Microvasc Res,2009,77(2):96-103.
[4] Sano S,Okubo Y,Handa A,et al.Reinvestigation of the synthe-sis of isoliquiritigenin:application of Horner-Wadsworth-Emmons reaction and Claisen-Schmidt condensation[J].Chem Pharm Bull (Tokyo),2011,59(7):885-8.
[5] Zhang X,Yeung E D,Wang J,et al.Isoliquiritigenin,a natural anti-oxidant,selectively inhibits the proliferation of prostate cancer cells[J].Clin Exp Pharmacol Physiol,2010,37(8):841-7.
[6] Cuendet M,Guo J,Luo Y,et al.Cancer chemopreventive activity and metabolism of isoliquiritigenin,a compound found in licorice [J].Cancer Prev Res,2010,3(2):221-32.
[7] Yoshida T,Hhorinaka M,Takara M,et al.Combination of isoliquiritigenin and tumor necrosis factor-related apoptosis-indu-cing ligand induces apoptosis in colon cancer HT29 cells[J].Envi-ron Health Prev Med,2008,13(5):281-7.
[8] Hsu Y L,Kuo P L,Chiang L C,et al.Isoliquiritigenin inhibits the proliferation and induces the apoptosis of human non-small cell lung cancer A549 cells[J].Clin Exp Pharmacol Physiol,2004,31(7):414-8.
[9] Jung J I,Chung E,Seon M R,et al.Isoliquiritigenin(ISL)in-hibits ErbB3 signaling in prostate cancer cells[J].Biofactors,2006,28(3-4):159-68.
[10]Kumar S,Sharma A,Madan B,et al.Isoliquiritigenin inhibits Ikappa B kinase activity and ROS generation to block TNF-alpha induced expression of cell adhesion molecules on human endotheli-al cells[J].Biochem Pharmacol,2007,73(10):1602-12.
[11]Pircher A,Hilbe W,Heidegger I,et al.Biomarkers in tumor an-giogenesis and anti-angiogenic therapy[J].Int J Mol Sci,2011,12(10):7077-99.
[12]Sun Z J,Chen G,Zhang W,et al.Mammalian target of rapamy-cin pathway promotes tumor-induced angiogenesis in adenoid cystic carcinoma:its suppression by isoliquiritigenin through dual activa-tion of c-Jun NH2-terminal kinase and inhibition of extracellular signal-regulated kinase[J].J Pharmacol Exp Ther,2010,334 (2):500-12.
[13]Lee C K,Son S H,Park K K,et al.Isoliquiritigenin inhibits tumor growth and protects the kidney and liver against chemothera-py-induced toxicity in a mouse xenograft model of colon carcinoma [J].J Pharmacol Sci,2008,106(3):444-51.
[14]Gu W,Weihrauch D,Tanaka K,et al.Reactive oxygen species are critical mediators of coronary collateral development in a canine model[J].Am J Physiol Heart Circ Physiol,2003,285(4):H1582-9.
[15]Zhao W,Zhao T,Chen Y,et al.Reactive oxygen species promote angiogenesis in the infarcted rat heart[J].Int J Exp Pathol,2009,90(6):621-9.
Antitumor activities and mechanisms of isoliquiritigenin
WANG Zhi-qiang1,2,ZHANG Xiu-ying3*,LI Wen-guang1*,HUANG Shuang-sheng4,LIU Yuan-yuan1,HU La-mei1,HOU Cui-lan1,ZHANG Xiao-yu1
(1.School of Basic Medicine,Lanzhou University;2.Reproductive Medical Center of Gansu Provincial Maternal and Child-care Hopital;3.Dept of Emergency,Gansu Provincial Hospital;4.Medical College,Northwest University for Nationalities,Lanzhou 730000,China)
Abstract:Aim To investigate the effects of isoliquiri-tigenin(ISL)on anti-angiogenesis both in vitro and in vivo and its mechanisms.Methods We assessed the antiangiogenic activities of ISL on proliferation viabili-ty,migration and tube formation of human microvascu-lar endothelial cell line-1(HMEC-1)in vitro.The cell proliferation viability was assessed using the Sulforho-damine B(SRB)assay.Modified Boyden Transwell chamber assay was done to study the effect of ISL on HMEC-1 cells migration.2′,7′-dichlorofluorescein di-acetate(DCFH-DA)was used to measure the levels of intracellular reactive oxygen species(ROS),which was induced by VEGF.Metalloproteinase-2(MMP-2) and metalloproteinase-9(MMP-9)expressions by HMEC-1 cells were assessed through gelatin zymogra-phy assay.HMEC-1 cells cycle was detected by flow cytometry.Moreover,we investigated the in vivo anti-angiogenic activity of ISL on chicken embryos nap al-lantoic membrane model(CAM).Results ISL con-centration-dependently inhibited the growth of HMEC-1 cells as well as SW620 and A549 cells.ISL signifi-cantly and concentration-dependently suppressed the migration activity of HMEC-1 cells.Tube sample struc-ture formation further confirmed the effect of ISL on an-ti-angiogenesis.Moreover,ISL also inhibited intracel-lular ROS level,MMP-2 and MMP-9 expression bybook=1165,ebook=134HMEC-1 cells.ISL induced endothelial cell apoptosis at a low concentration(ISL 12.5 μmol·L-1)and blocked the cells in S phase of mitosis at higher con-centrations(ISL 25~100 μmol·L-1).Furthermore,ISL distinctly inhibited the angiogenesis of chick em-bryos in vivo.Conclusions ISL has anti-tumor and angiogenesis effects on HMEC-1 cells.The mechanism may be related to intracellular ROS scavenging and ap-optosis induction of HMEC-1 cells.
Key words:isoliquiritignin(ISL);antitumor;angio-genesis;HMEC-1 cells;vascular endothelial growth factor(VEGF);apoptosis
作者简介:王志强(1986-),男,硕士生,研究方向:细胞生理学、生殖医学,E-mail:babaral_w@163.com;*与第一作者对本文有同等贡献张小郁(1966-),女,博士,教授,硕士生导师,研究方向:细胞生理学、肿瘤药理学,通讯作者,E-mail:zhangxyu@lzu.edu.cn
基金项目:甘肃省自然科学研究基金计划项目(No 1208RJZA231)
收稿日期:2015-04-13,修回日期:2015-05-16
文献标志码:A
文章编号:1001-1978(2015)08-1159-07
doi:10.3969/j.issn.1001-1978.2015.08.026