DWI及ADC值在胃癌淋巴结性质判断及化疗疗效评估中的作用
赵娓娓,全志永,陈燕,王珂,任芳,赵青川,任静,宦怡
DWI及ADC值在胃癌淋巴结性质判断及化疗疗效评估中的作用
赵娓娓,全志永,陈燕,王珂,任芳,赵青川,任静,宦怡
【摘要】目的:探讨扩散加权成像(DWI)及表观扩散系数(ADC)值在进展期胃癌淋巴结性质判断中的价值,进一步探讨其在化疗疗效动态监测中的应用价值。方法:44例伴有可测淋巴结的进展期胃癌患者,分别于化疗前、化疗后3、7、30和60d行MRI-DWI检查,测量化疗前和化疗后60d每个淋巴结的长径、垂直短径,以及化疗前和化疗后各时间点每个淋巴结的ADC值,化疗后60d行手术切除及淋巴结清扫,分组切除淋巴结共1258枚送病理活检,标记淋巴结组别,按照病理结果分为全阳性组(231枚,整组切除之淋巴结均有转移)和全阴性组(495枚,整组切除之淋巴结均无转移),分析比较两组间化疗前淋巴结长径、短径及ADC值差异,分析全阳性组中各疗效组化疗前后不同时间点ADC值差异并进行统计学处理。结果:化疗前全阳性组与全阴性组淋巴结长径、短径及ADC值差异均有统计学意义(P<0.05)。全阳性组中部分有效组(PR组)及稳定组(SD组)化疗前、化疗后3、7、30和60dADC值均呈上升趋势,化疗前与化疗后各时间点的ADC值差异均有统计学意义(P<0.05);完全有效组(CR组)可测时间点内随时间进展ADC值也呈上升趋势,化疗前与化疗后各可测时间点的ADC值差异均有统计学意义(P<0.05)。结论:DWI及ADC值可初步判断胃癌患者可测淋巴结的性质,并可动态观察和早期定量监测胃癌患者转移性淋巴结的化疗疗效。
【关键词】胃肿瘤;淋巴结;扩散加权成像;磁共振成像
作者单位:710032 西安,第四军医大学西京医院放射科(赵娓娓、王珂、任芳、任静、宦怡),核医学科(全志永),消化病医院(赵青川);518000 广东,香港大学深圳医院(陈燕)
胃癌是第二常见的恶性肿瘤,容易发生淋巴结转移,引流区淋巴结转移是最重要的独立胃癌预后预测因子[1]。胃癌的标准术式是局部病灶切除加扩大淋巴结清扫[1],但是由于扩大淋巴结清扫增加了手术相关病死率和并发症的发生率而备受争议[2],因此术前准
确判断是否有淋巴结转移至关重要[1],而目前评估淋巴结转移的影像学方法均存在一定的局限性,未得到一致的研究结果[3-5]。
术前有效化疗可使胃癌周围肿大淋巴结缩小、减少,提高手术成功率。如何早期预测和评估胃癌转移淋巴结的化疗敏感性是临床医师普遍关注的问题,也是近年来消化道肿瘤临床研究的热点。目前评价化疗疗效的CT、超声、常规MRI、PET等影像学方法均存在不同程度的局限性[6]。
扩散加权成像(diffusion-weighted imaging,DWI)可通过表观扩散系数(apparent diffusion coefficient,ADC)值量化组织内水分子的扩散程度,从而对组织细胞结构进行间接的定量评估[7]。本研究旨在通过影像-病理对照,分析进展期胃癌转移性淋巴结和良性淋巴结的大小及ADC值差异,分析不同疗效组转移性淋巴结化疗前后不同时间点ADC值的动态变化趋势,对DWI及ADC值判断肿大淋巴结性质、预测并评估疗效的可行性和临床价值进行初步探讨。
材料与方法
1.病例资料
搜集2011年3月-2014年3月经胃镜活检病理证实为胃癌且伴有可测淋巴结的患者44例,确诊后接受FOLFOX6化疗方案治疗,化疗后60d行全胃或部分胃手术切除并行淋巴结清扫。44例患者中男29例,女15例,年龄33~83岁,中位年龄56岁。本实验征得了所有患者及本院伦理委员会同意。
2.淋巴结性质分组及疗效分组
44例患者于化疗后60d行全胃或部分胃手术切除及淋巴结清扫,分组切除淋巴结共1258枚,标记淋巴结组别送病理活检,按照病理结果分为全阳性组(231枚,整组切除之淋巴结均有转移)和全阴性组(495枚,整组切除之淋巴结均无转移)。
将RECIST标准[8]引入淋巴结疗效评估中并做了相应调整,按照全阳性组患者淋巴结最大面积缩小率将其分为四组:完全有效(complete response,CR)组,淋巴结完全消失,部分有效(partial response,PR)组,淋巴结最大面积减小至少30%;稳定(stable disease,SD)组,淋巴结最大面积变化介于PR与PD之间;进展(progressive disease,PD)组:淋巴结最大面积增长至少20%。
3.检查方法
每位患者均于化疗前、化疗后3、7、30和60d行MRI-DWI检查。MRI检查采用Siemens Magnetom Trio Tim 3.0T超导型磁共振成像仪,18通道体部相控阵线圈,扫描范围从膈顶至肝右下缘,扫描前10min肌注山茛菪碱(654-2)10mg以减少胃蠕动。常规T2WI平扫后行DWI检查,DWI扫描采用单次激发EPI序列,b值为0和1000s/mm2,TR 7400ms,TE 66ms,层厚5mm,层间距1mm,矩阵112×128,视野330mm×330mm~380mm×380mm,激励次数8次,在308s内完成30层扫描,定位参数均直接复制T2WI参数,保证图像的一致性。图像传送至Siemens Leonardo工作站以测量ADC值。
4.ADC值及淋巴结长短径测量
由2位高年资腹部影像诊断医师采用盲法分析图像,观察T2WI平扫图像确定淋巴结位置、组别、大小、形态,对照DWI在ADC图上手动选择ROI,避开坏死、囊变区并尽量选择同层面淋巴结进行测量,分别测量化疗前后各个时间点淋巴结最大层面ADC值,每个淋巴结取3个ROI测ADC值,然后取其平均值。分别测量化疗前和化疗后60d各淋巴结长径和垂直短径,最大面积为淋巴结长径与短径的乘积,按照公式(1)计算淋巴结最大面积缩小率:

5.统计学处理
使用SPSS 17.0统计软件进行统计学分析。淋巴结长径、短径、ADC值均用均数±标准差(x±s)表示,采用独立样本t检验、混合线性模型分析和One-Way ANOVA分析进行组间比较及分析,以P<0.05为差异有统计学意义。
结 果
1.化疗前全阳性组与全阴性组淋巴结影像表现、ADC值及长短径
化疗前全阳性组及全阴性组淋巴结在T2WI上均呈稍高信号,全阳性组淋巴结在DWI上均呈高信号,ADC上均呈低信号;而全阴性组淋巴结在DWI上部分呈等信号,部分呈稍高信号,ADC上部分呈等信号,部分呈稍低信号。全阳性组淋巴结ADC值低于全阴性组,差异有统计学意义(P<0.05,表1)。全阳性组淋巴结长径、垂直短径均高于全阴性组,差异有统计学意义(P<0.05,表1)。
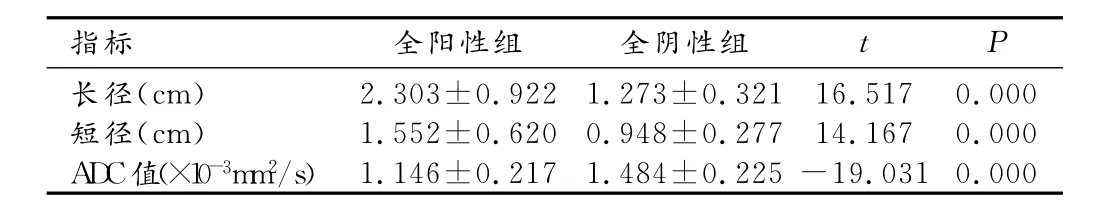
表1 化疗前不同组别间淋巴结情况比较
2.全阳性组中不同疗效组化疗前后各时间点转移淋巴结影像表现及ADC值
全阳性组共切除淋巴结231枚,共42组,分属于
23例患者,其中贲门癌3例,胃底癌4例,胃体癌5例,胃角癌2例,胃窦癌6例,幽门癌2例,弥漫浸润癌1例,累及11个淋巴结分区(表2)。

表2 全阳性组转移淋巴结分区统计表 (枚)
CR组83枚淋巴结,PR组90枚,SD组58枚,PD 组0枚。CR组、PR组及SD组化疗前淋巴结与同层面肝实质相比在T2WI上表现为类圆形、类椭圆形、结节状稍高信号影,DWI上呈高信号,ADC上呈低信号,随着化疗各时间点的变化T2WI信号变化不大,DWI信号逐渐减低,ADC信号逐渐升高(图1)。
CR组随化疗进展淋巴结逐渐缩小直至后期在影像图像上完全消失,但经含缺失数据的混合线性模型分析发现其ADC值随化疗进展呈依次上升趋势(图2)。除化疗后60d(此时该组淋巴结在影像图像上完全消失,无法测量ADC值),其余各时间点ADC值两两比较差异均有统计学意义(P<0.05,图2)。
PR组化疗前、化疗后3、7、30和60dADC值呈依次上升趋势(图3)。化疗前分别与化疗后各时间点相比,其ADC值差异均有统计学意义(P<0.05);化疗后3d与化疗后7dADC值差异无统计学意义(P>0.05);其余化疗后各时间点两两比较,其ADC值差异均有统计学意义(P<0.05,图3)。

图1 患者,男,71岁。a~e)分别为化疗前、化疗后3d、7d、30d、60d上腹部T2WI图像,示腹主动脉周围、肝门区多发肿大淋巴结,部分融合,与同层面正常肝实质相比呈稍高信号影,信号欠均匀,各时间点信号强度差别不大但淋巴结逐渐缩小、减少,归为PR组;f~j)分别为化疗前、化疗后3d、7d、30d、60d上腹部DWI图像,示转移性淋巴结与同层面正常肝实质相比呈高信号,且随着时间推移信号强度逐渐降低,以化疗后30d、60d最为明显;k~o)分别为化疗前、化疗后3d、7d、30d、60d上腹部ADC图像,示转移性淋巴结与同层面正常肝实质相比呈等、低信号,且随着时间推移信号强度逐渐升高,以化疗后30d、60d最为明显。
SD组化疗前、化疗后3、7、30和60dADC值呈上升趋势(图4)。化疗前分别与化疗后各时间点相比,其ADC值差异均有统计学意义(P<0.05);化疗后3d与化疗后7d相比、化疗后30d与化疗后60d相比,其ADC值差异无统计学意义(P>0.05);其余化疗后各时间点两两比较,其ADC值差异均有统计学意义(P<0.05,图4)。
讨 论
胃癌淋巴结转移是影响其预后的独立危险因子,胃周淋巴结可详分为23个不同的组别[9],术前准确判断胃癌转移淋巴结是精确手术治疗胃癌的前提。传统的影像检查方法包括超声、CT、常规MRI、FDG-PETCT等,已广泛用于胃癌患者的常规筛查和术前检查。但是有学者对1990-2008年间PubMed/MEDLINE 和Embase数据库中所有关于胃癌淋巴结转移影像学检查的近2000篇文献数据进行综合分析,发现目前的影像学检查并不能得到让人满意的结果[4]。而且,国际上对胃癌淋巴结转移状态的影像学诊断至今尚无统一标准,结果的判定多依赖于医生的临床经验,漏诊或误诊率相对较高。

图2 CR组化疗前后各时间点ADC值变化趋势(1表示化疗前,2表示化疗后3d,3表示化疗后7d,4表示化疗后30d)。图3 PR组化疗前后各时间点ADC值变化趋势(before表示化疗前,3d表示化疗后3d,7d表示化疗后7d,30d表示化疗后30d)。 图4 SD组化疗前后各时间点ADC值变化趋势(before表示化疗前,3d表示化疗后3d,7d表示化疗后7d,30d表示化疗后30d)。
DWI是基于活体组织内水分子布朗运动的磁共振功能成像,是一种安全有效的非侵入性检查方法,不仅可反映病灶形态学改变,并且能够提供组织结构的功能信息,用2个或多个b值行DWI扫描可测量ADC值,ADC值可定量评估组织内水分子的活动度[7]。现已有DWI用于鉴别子宫内膜癌、头颈部恶性肿瘤中转移性和良性淋巴结的相关报道[10,11],也有用于鉴别直肠癌中良恶性淋巴结的报道,与良性淋巴结相比,转移性淋巴结的ADC值降低,诊断敏感度和特异度分别为97%和81%[12]。Chen等[13]研究发现,胃癌转移性淋巴结的ADC值低于良性淋巴结,其敏感度和特异度分别为85.7%和79.4%,与淋巴结直径、淋巴结边缘以及强化方式相比,ADC值鉴别诊断转移性和良性淋巴结有更高的符合率。本研究发现胃癌患者化疗前转移性淋巴结的ADC值低于良性淋巴结,差异有统计学意义,与Chen[13]的研究结果基本一致,且本研究进一步发现随着化疗的进行,转移性淋巴结的ADC值呈逐渐升高趋势。转移性淋巴结ADC值降低的原因可能与其组织结构特征有关,其更高的细胞密度、恶性间质成分及细胞异型性、有丝分裂增加,均会导致细胞内外间隙缩小,从而限制了水分子的自由运动,导致ADC值降低[12,13];除此之外,胶原、糖类物质等沉积引起的纤维化也会引起水分子扩散受限,导致ADC值降低[14]。随着化疗的进行,ADC值升高的原因可能与肿瘤细胞数量减少、细胞密度减低、坏死囊变增加等有关。
常规T2WI结合DWI可发现更多的淋巴结,尤其是亚厘米级的淋巴结。Vandecaveye等[15]发现与T2WI相比,DWI在发现直径为4~9mm的淋巴结方面有更高的敏感度,且可行ADC值测量的淋巴结最小短径为4mm。短轴直径>8mm的淋巴结可用CT和常规MRI预测是否转移[16],本研究发现化疗前全阳性组淋巴结短径及长径均大于全阴性组淋巴结,差异有统计学意义,因此淋巴结大小变化在判断淋巴结性质方面有一定价值。但是,相关研究发现仅仅依靠淋巴结的直径鉴别其是否为转移性是不充分的,尤其是胃癌患者[17]。所以本研究不仅观察了转移性及良性淋巴结大小的差异,还观察了其ADC值的差异,发现转移性淋巴结的ADC值低于良性淋巴结,且差异有统计学意义,此为判断胃癌患者胃引流区肿大淋巴结的性质提供了一定参考。
当淋巴结较小时,测量者间及测量者个人每次测量所得ADC值均会有一定的误差,是本研究的不足之一,也是ADC值测量中普遍存在的问题及技术方面的一个瓶颈,相信随着图像分辨力的进一步提高和测量方法的改进,这一问题将得以解决。另外本研究发现部分患者胃周淋巴结数目较多且部分淋巴结较小,不能做到影像与病理的一一对照,所以我们把整组切除的淋巴结均有转移和整组切除的淋巴结均无转移的组群作为研究对象,这样既能实现解剖与影像的对照,又能较全面地分析转移性淋巴结和良性淋巴结的大小、直径和ADC值差异,但是该分组方法会舍弃非全阳性组及非全阴性组淋巴结,所以不能完全代表所有良恶性淋巴结的整体情况,这也是今后研究需弥补的不足之一,相信随着技术的进步,今后的研究能够做到每个淋巴结病理与影像的完全对照。
国内外研究表明术前化疗可提高进展期胃癌,尤其是伴有淋巴结转移的胃癌的手术切除率及患者生存时间[18]。但是,对胃癌转移性淋巴结化疗疗效的评价至今尚缺乏统一的标准,而术前进行客观、准确的疗效评价对于下一步治疗方案的选择及判断预后至关重要。以往的评价手段主要依赖于治疗前后淋巴结形态学改变,然而单凭病灶大小变化不足以说明治疗效果,如相关文献报道胃肠道间质瘤的转移灶在治疗后可能由于囊变出血变得更大[19]。DWI可得到细胞重塑信息,且无电离辐射,不需要注射对比剂,经济、方便、无风险,有望作为一种从病理生理角度预测治疗效果的
无创影像学检查方法。目前动物及临床实验均表明DWI可用于早期评价肿瘤疗效[20],如鼻咽癌[21]、乳腺癌[22]、肝肿瘤(原发性和转移性)[23]、卵巢癌的腹膜后转移[24]等,但未见DWI及ADC值评估胃癌转移性淋巴结多时间点疗效情况的报道。本研究评估胃癌转移性淋巴结不同疗效组化疗效果,发现随着化疗的进展,ADC值均逐渐升高,尤其在化疗后3dADC值升高最明显,而此时形态学并未出现改变。由此可见ADC值变化在形态学变化之前,通过病灶组织结构及组织内水分子的变化能早期反映病灶对化疗的敏感性及疗效,进而可能预测预后,对后续治疗有一定的指导意义。
总之,DWI扫描和ADC值测量结合淋巴结大小变化可初步判断胃癌患者引流区淋巴结的性质,ADC值变化可早期检测、评估胃癌转移性淋巴结的化疗敏感性,有助于临床优化治疗方案,一定程度上降低手术病死率和并发症发生率。
参考文献:
[1] 权继传,解亦斌,田艳涛.国际抗癌联盟TNM分期系统第七版解读[J].中华诊断学电子杂志,2014,2(1):59-61.
[2] De Bree E,Charalampakis V,Melissas J,et al.The extent of lymph node dissection for gastric cancer:a critical appraisal[J].J Surg Oncol,2010,102(6):552-62.
[3] Ozkan E,Araz M,Soydal C,et al.The role of18F-FDG-PET/CT in the preoperative staging and posttherapy follow up of gastric cancer:comparison with spiral CT[J].Word J Surg Oncol,2011,9 (1):75.
[4] Kwee RM,Kwee TC.Imaging in assessing lymph node status in gastric cancer[J].Gastric Cancer,2009,12(1):6-22.
[5] 李婷,朱凯,郭玉林,等.3.0T MR扩散加权成像在不同分化程度胃癌中的诊断价值[J].磁共振成像,2014,5(3):193-197.
[6] 杨凤娇,郑玄中,杨晓棠.进展期胃癌新辅助化疗疗效评价的影像学方法研究进展[J].实用医学影像杂志,2012;13(2):134-136.
[7] Sinkus R,Van Beers BE,Vilgrain V,et al.Apparent diffusion coefficient from magnetic resonance imaging as a biomarker in oncology drug development[J].Eur J Cancer,2012;48(4):425-431.
[8] Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guidelines(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[9] 何裕隆,蔡世荣.胃癌淋巴转移[M].北京:人民卫生出版社,2011:15.
[10] 郭靖,汪俊萍,李威.扩散加权成像在鉴别诊断子宫内膜癌盆腔淋巴结转移性质中的应用[J].中国医学影像学杂志,2013,21 (3):227-230.
[11] De Bondt RB,Hoeberigs MC,Nelemans PJ,et al.Diagnostic accuracy and additional value of diffusion-weighted imaging for discrimination of malignant cervical lymph nodes in head and neck squamous cell carcinoma[J].Neuroradiology,2009,51(3):183-192.
[12] Mizukami Y,Ueda S,Mizumoto A,et al.Diffusion-weighted magnetic resonance imaging for detecting lymph node metastasis of rectal cancer[J].World J Surg,2011,35(4):895-899.
[13] Cheng J,Wang Y,Deng J,et al.Discrimination of metastatic lymph nodes in patients with gastric carcinoma using diffusionweighted imaging[J].J Magn Reson Imaging,2013;37(6): 1436-1444.
[14] Georges PC,Hui JJ,Gombos Z,et al.Increased stiffness of the rat liver precedes matrix deposition:implications for fibrosis[J]. Am J Physiol Gastrointest Liver Physiol,2007,293(6):G1147-1154.
[15] Vandecaveye V,De Keyzer F,Vander Poorten V,et al.Head and neck squamous cell carcinoma:value of diffusion-weighted MR imaging for nodal staging[J].Radiology,2009,251(1):134-146.
[16] Chen CY,Hsu JS,Wu DC,et al.Gastric cancer:preoperative local staging with 3D multi-detector row CT-correlation with surgical and histopathologic results[J].Radiology,2007,242(2): 472-482.
[17] Dicken BJ,Bigam DL,Cass C,et al.Gastric adenocarcinoma:review and considerations for future directions[J].Ann Surg,2005,241(1):27-39.
[18] Xiong BH,Cheng Y,Ma L,et al.An updated meta-analysis of randomized controlled trial assessing the effect of neoadjuvant chemotherapy in advanced gastric cancer[J].Cancer Invest,2014,32(6):272-284.
[19] Shankar S,vanSonnenberg E,Desai J,et al.Gastrointestinal stromal tumour:new nodule-within-a-mass pattern of recurrence after partial response to imatinib mesylate[J].Radiology,2005,235 (3):892-898.
[20] 张妍,王峻,王晞星.MR扩散加权成像在恶性肿瘤疗效预测与评价中的研究进展[J].中华放射学杂志,2013,47(7):666-668.
[21] 钟兴,史长征,弓健,等.MR扩散加权成像在体评估人钠碘转运体转染鼻咽癌介导^131I治疗效果的实验研究[J].中华放射学杂志,2012;46(10):937-942.
[22] Zhai G,Grubbs CJ,Stockard CR,et al.Diffusion weighted imaging evaluated the early therapy effect of tamoxifen in an MNU-induced mammary cancer rat model[J].PLoS One,2013,8(5): e64445.
[23] Lewis S,Dyvorne H,Cui Y,et al.Diffusion-weighted imaging of the liver:techniques and applications[J].Magn Reson Imaging Clin Am,2014;22(3):373-395.
[24] Kyriazi S,Collins DJ,Messiou C,et al.Metastatic ovarian and primary peritoneal cancer:assessing chemotherapy response with diffusion-weighted MR imaging-value of histogram analysis of apparent diffusion coefficients[J].Radiology,2011,261(1):182-192.
•腹部影像学•
The role of DWI and ADC value in judging the nature of lymph nodes in gastric cancer and monitoring the chemotherapy effect
ZHAO Wei-wei,QUAN Zhi-yong,CHEN Yan,et al.Department of Radiology,Xijing Hospital,Fourth Military Medical University,Xi'an 710032,P.R.China
【Abstract】Objectives:To investigate the value of diffusion weighted imaging(DWI)and apparent diffusion coefficient (ADC)value in judging the nature of lymph nodes in advanced gastric cancer and further to investigate the application value in monitoring the curative effect dynamically after chemotherapy.Methods:44patients with advanced gastric cancer having measurable lymph nodes.MRI-DWI were carried out before and 3d,7d,30d,60dafter chemotherapy respectively.The long dimension and vertical short dimension of each lymph node were measured before and 60dafter chemotherapy,also the ADC value of each lymph node was measured before and at various time points after chemotherapy.Gastrectomy and lymphadenectomy were performed 60dafter chemotherapy.Altogether 1258lymph nodes were excised and marked in groups,then pathology exanimation were performed.According to pathology results,there were totally positive group(231lymph nodes,all had metastases)and totally negative group(495lymph nodes,all without metastases).The differences of long dimension,vertical short dimension and ADC values between the two groups of lymph nodes before chemotherapy were analyzed,as well as the differences of lymph node ADC values in the totally positive groups with curative effect before and at different time-points after chemotherapy.Statistic analysis were performed.Results:The long dimension,vertical short dimension and ADC values of lymph nodes in the totally positive group and totally negative group before chemotherapy showed significant statistic differences(P<0.05).Of the totally positive group,the ADC values in PR and SD sub-groups showed a tendency of increasing before and 3d,7d,30d,60dafter chemotherapy,with significant statistic difference(P<0.05).The ADC values of lymph nodes in CR group also showed an upward trend at various measurable time points,with significant statistics differences before and at each measurable time point after chemotherapy(P<0.05).Conclusion:DWI and ADC values can be used to preliminarily judge the nature of measurable lymph node for gastric cancer patients and can be used to early and dynamically observe as well as quantitatively monitor the chemotherapy effect of metastatic lymph node in gastric cancer.
【Key words】Stomach neoplasms;Lymph nodes;Diffusion weighted imaging;Magnetic resonance imaging
收稿日期:(2014-10-27 修回日期:2015-01-05)
基金项目:国家自然科学基金资助项目(81220108011,81370039)
通讯作者:宦怡,E-mail:huanyi3000@163.com
作者简介:赵娓娓(1984),女,河南洛阳人,博士研究生,主治医师,主要从事腹部影像成像及诊断工作。
DOI:10.13609/j.cnki.1000-0313.2015.05.014
【中图分类号】R735.2;R445.2
【文献标识码】A
【文章编号】1000-0313(2015)05-0566-05

