基于MRI技术定量测量单侧肾动脉狭窄动物模型肾脏氧摄取分数的初步研究
张晓东,米悦,王晶,孙艳,张锐,吴静云,王成彦,赵凯,罗健,杨学东,张珏,王霄英
基于MRI技术定量测量单侧肾动脉狭窄动物模型肾脏氧摄取分数的初步研究
张晓东,米悦,王晶,孙艳,张锐,吴静云,王成彦,赵凯,罗健,杨学东,张珏,王霄英
【摘要】目的:验证基于血氧水平依赖(BOLD)的多回波梯度自旋回波(MEGSE)序列无创定量测量肾脏氧摄取分数(OEF)等氧代谢指标参数的可行性。方法:15只健康新西兰大白兔入组研究。对每只兔子施行左肾动脉部分结扎手术以造成单侧肾动脉狭窄(RAS)动物模型。行MRI扫描采集3个不同时刻的MEGSE数据,分别为基础状态、RAS术后30min(RAS-30min)和RAS术后60min(RAS-60min),以获得肾脏动脉狭窄造模前后的肾脏OEF值。结果:15只兔子均造模成功。在RAS术前测得的肾脏基础状态下OEF值为(0.36±0.08)(皮质)和(0.39±0.11)(髓质)。RAS术后30min和60min测得的OEF显著增大分别为(0.46±0.14)(皮质,RAS-30min,P<0.05)、(0.51±0.12)(髓质,RAS-30min,P<0.05)、(0.46±0.13)(皮质,RAS-60min,P<0.05)、(0.56±0.09)(髓质,RAS-60min,P<0.05)。结论:本研究验证了MEGSE序列可以无创、定量测量肾缺血状态下的OEF改变,为将来进一步应用于人类肾脏氧摄取分数的测量奠定了基础。
【关键词】氧摄取分数;肾动脉狭窄;磁共振成像
作者单位:100034 北京,北京大学第一医院医学影像科(张晓东、孙艳、吴静云、赵凯、罗健、杨学东、王霄英),泌尿外科(米悦);100044北京,国家食品药品监督管理总局医疗器械技术评审中心(王晶);100871 北京,北京大学前沿交叉学科研究院功能成像中心(张锐、王成彦、张珏、王霄英)
在正常的生理条件下,相对于肾皮质区域,肾髓质区域处于相对低氧的状态,因此肾脏髓质区域易于受到由于肾脏氧供给和需求不平衡造成的急性或慢性损伤[1],所以定量测量肾脏特别是肾髓质区域的氧代谢水平对于肾脏疾病的诊断和治疗非常重要。相关学者用微电极直接测量已麻醉动物模型的肾脏髓质和皮质区域的氧代谢指标-氧分压(partial pressure of oxygen,pO2)[2],但是基于微电极的方法不能提供空间分布的信息,而且这种方法是有创的,无法用来在临床条件下测量人体的肾脏氧代谢水平。因此,开发一种可以无创地、定量测量人体肾脏氧代谢水平的方法非常必要。
基于血氧水平依赖信号对比(blood oxygenation level dependent contrast,BOLD)的原理[3-5],梯度回波序列(gradient echo,GRE)可以用来无创地获得健康志愿者及不同病理生理条件下的肾脏R2*值[6-14]。在此基础上,进一步定量描绘出R2′分布图(R2′mapping),也可以用来研究在不同生理条件下肾脏氧代谢
水平的变化[15],但是有一定的局限性。R2*是不可逆和可逆的弛豫率之和(R2*=R2+R2′),而R2已经被证明与多种生理变化相关,其中包括组织水容量、炎症以及组织的氧代谢水平等[16];另一方面,R2′与组织氧代谢线性相关,但其中包括组织脱氧血红蛋白的含量和体积分数的贡献[17],不能直接、明确反映组织的氧代谢水平。
Yablonskiy等[17]提出了基于BOLD对比效应的磁共振信号衰减模型,并在此基础上利用多回波梯度自旋回波(multi-echo gradient and spin echo,MEGSE)序列定量获得直接明确反映大脑组织氧代谢水平的氧摄取分数(oxygen extraction fraction,OEF)等氧代谢指标[18-19]。在本研究中,笔者利用MEGSE序列获得肾脏OEF等氧代谢指标参数,同时利用单侧肾动脉狭窄动物模型,来评估这个方法能否检测到由于急性肾缺血引起的肾脏氧代谢水平的变化。
材料与方法
1.研究对象
15只健康雄性新西兰大白兔入组本次研究,自由采食法饲养,体重2.8~3.5kg。本实验方案得到了医院动物伦理委员会的批准,所有参与实验的动物都要求在实验前禁食12h。
2.单侧肾脏动脉狭窄动物模型制备及实验方案
暴露左肾动静脉,剥离肾静脉,用手术缝合线将24G套管针(Vasofix Safety,B.Braun Melsungen AG,Germany)软管和肾动脉捆绑在一起,抽离套管针软管,造成一定程度的肾缺血(缺血程度取决于套管针软管的直径)。
3.MRI扫描方案
实验在3.0T MR扫描仪(Signa Excite TM;GE Medical Systems,Milwaukee,Wisconsin,USA)上进行,最大梯度场40mT/m,梯度爬升率120T/m/s,采用8通道膝关节相控阵线圈。
实验前5~10min固定兔子,利用呼吸式动物麻醉机(Matrx VME,Midmark Corporation,Versailles,Ohio,USA),通过专用动物面罩使其吸入异氟醚直至麻醉成功。兔子深度麻醉后,先进行基础状态下的肾脏MRI数据采集,然后对麻醉后的兔子行单侧肾动脉结扎手术,并在肾动脉狭窄(renal artery stenosis,RAS)手术后30min、60min分别采集MRI数据。
首先采用冠状面T2加权序列得到肾脏定位像,以保证其成肾脏最大轴位中心平面图像。肾脏轴面MEGSE序列扫描参数:TR 1500ms,TE 56ms,回波数32,带宽62.5kHz,层厚3mm,回波间隔3.748ms,视野150mm×150mm,矩阵大小128×128,图像分辨率1.17mm×1.17mm×3.00mm。本研究为了评估肾脏血流灌注功能,同时采集了FAIR-SSFSE-ASL序列的数据。上述3个序列同时采集3个不同时刻的数据:基础状态(Baseline)、RAS术后30分钟(RAS-30min)和RAS术后60分钟(RAS-60min)(图1)。
4.MEGSE序列设计原理
血液BOLD对比[3-5,20]机制的生理基础是组织血液中脱氧血红蛋白(deoxyhemoglobin,Hb)是顺磁性的,而氧合血红蛋白(oxyhemoglobin,HbO2)是逆磁性的。当含有脱氧血红蛋白的组织置于MRI磁场中时,会产生相应的磁化率差,从而导致MRI信号变化,因此可以利用MRI技术探测到组织氧代谢功能相关的脱氧血红蛋白含量的变化。
组织血液中总的磁化率等于红细胞的磁化率和血浆的磁化率之和。红细胞的磁化率与组织中氧合及脱氧的血红蛋白的含量线性相关[21]:
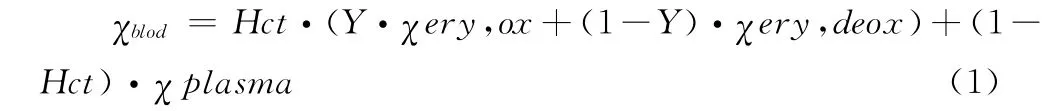
这里χery,ox和χery,deox分别表示完全氧合和完全脱氧的红细胞的磁化率。血浆的磁化率χplasma为-9.05ppm[22],完全氧合的血细胞的磁化率χery,ox大约等于-9.25ppm[23],由于这两个磁化率之间差异很小,故可以认为它们近似相等,即χery,ox≈χplasma。同时,定义完全氧合与完全脱氧的组织血液的磁化率差为:

因为血管通常都嵌在组织网络中,所以对于生物体软组织与血液之间的磁化率之差Δχ的活体测量非常重要。假设生物体组织的磁化率与组织完全氧化的血液的磁化率相等,结合公式(2),可以得到组织与静脉血管网之间的磁化率差的表达式:

在Hct和Δχdo已知的前提下,根据公式(3),可以通过测量组织静脉毛细血管网的磁化率来估计出组织的摄取分数OEF。
假设来自于血管内部的信号贡献以及水分子扩散效应忽略不计,并且在静态磁场下,组织中血管分布是任意朝向的,Yablonskiy等[17]提出了一个磁共振信号衰减理论模型,这个理论模型描述了磁共振信号变化与脱氧血红蛋白的含量及其体积分数之间的关系。根据Yablonskiy等的理论信号模型,由MEGSE序列获得的磁共振信号S(t)可以表示为[18,24]:

这里ρ是质子自旋密度,λ是静脉血容积(venous cerebral blood volume,vCBV),ΔTEi是指自旋回波中心时间TE与各个梯度回波时间之差;δω是指由脱氧
血红蛋白引起的频率偏移,可以表示为:

图1 MEGSE和FAIR-SSFSE-ASL序列定位扫描图像。红线表示轴面MEGSE及FAIR-SSFSE-ASL序列图像的定位位置,以保证其成肾脏最大中心轴位平面图像。3列分别表示图像数据采集的3个不同时刻,即基础状态(BASELINE)、RAS术后30min(RAS-30min)和RAS术后60min(RAS-60min)。a)基础状态下MEGSE序列图像;b)RAS-30min MEGSE序列图象;c)RAS-60min MEGSE序列图象;d)基础状态下T2WI图像;e)RAS-30min T2WI图象;;f)RAS-60min T2WI图象。

这里γ是磁旋比;Hct是血红细胞容积;Δχ0是完全氧合与完全脱氧的血液之间的磁化率差。在我们的实验中根据前人的相关文献报道,选取大血管Hct= 0.42,并且大血管与小血管的Hct之比为0.85[25],选取Δχ0=0.18ppm为每单位Hct[23]。fc(δω•ΔTEi)可根据相关文献的计算公式进行计算[27,29]
5.OEF估算方法
本研究所用的理论信号模型公式(4)是没有解析解的。为了利用这个理论模型估算氧代谢指标参数,需要根据这个模型信号的特点,用近似的解析方程代替原公式(4)[17-18,24]。当采样磁共振信号时间ΔTEi满足条件δω•|ΔTEi|≤1.5时,此时的磁共振信号可以用如下的解析表达式近似代替:

类似地,当采样磁共振信号时间ΔTEi满足条件δω•|ΔTEi|>1.5时,此时的磁共振信号可以用如下的解析表达式近似代替:

这里的SS(t)表示短时间尺度时的信号,SL(t)表示长时间尺度时的信号。
当估算出R2′和λ后,可以得到δω,进一步利用关系式(5)估算出OEF。
在实际估算OEF的过程中,我们按照如下步骤进行运算:第一步,将方程式(6)和(7)的两边取自然对数;第二步,利用最小二乘线性拟和方法,得到R2′、R2、u1、u2和u3的估算值;第三步,根据如下的方程式:

分别得到λ,δω和OEF的估算值。第四步,将所有的参数估算值R2′、R2、λ、δω和OEF代入方程(4)中,得到相应的磁共振信号估算值δ,此时可以得到一个评判估算结果准确度的指标剩余平方和(residual sum of squares,RSS),RSS=(S-δ)。每一个参考氧摄取分数值都有一个相应的评判估算结果准确性的指标剩余平方和,最后我们选择导致最小RSS的参考OEF值为最终的参考OEF值,并把与其相对应的参数估计值作为最终的模型氧代谢指标估计值。
6.肾脏OEF计算及统计方法

图2 一只兔子左侧施行部分结扎手术,肾脏分别在基态、RAS术后30min、60min的OEF和RBF分布图。a)基础状态下OEF分布图;b)RAS-30min OEF分布图;c)RAS-60min OEF分布图;d)基础状态下RBF分布图;e)RAS-30min RBF分布图;f)RAS-60min RBF分布图。
基于MEGSE序列的OEF图像后处理程序在Matlab(MathWorks Inc.Natick,MA,USA)平台编写完成。局部肾脏OEF值及其他氧代谢指标参数采用感兴趣区域(region of interest,ROI)分析法来计算。对于MEGSE序列图像,自旋回波图像具有良好的组织对比,可作为ROI选择的背景图像;而对于FAIR-SSFSE-ASL序列图像,M0图像具有良好的组织对比,可作为ROI选择的背景图像。ROI选择肾脏皮髓质区域,并要求每个手动勾画的ROI至少包括20个像素。
为了比较肾脏单侧动脉狭窄手术前后OEF等氧代谢指标参数的变化,对肾脏皮髓质区的术前/后结果采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
15只兔子动脉狭窄模型均成功完成数据采集,其中MEGSE、FAIR-SSFSE-ASL序列的图像质量可接受,无显著磁敏感伪影或形变,所有MRI序列扫描SAR值都在安全范围之内。
所得氧代谢参数分布图结果如图2所示。经独立样本t检验,RAS术后在肾脏皮髓质区域,肾脏血流量(renal blood flow,RBF)显著降低,而OEF显著升高。其中在RAS术前测得的正常兔子肾脏基础状态下的OEF为(0.36±0.08)(皮质)和(0.39±0.11)(髓质),RBF为(261.80±143.71)mL/ (100g•min)(皮质)和(56.42± 35.29)mL/(100g•min)(髓质),而在RAS术后30min和60min测得的OEF分别为(0.46±0.14)(皮质,RAS-30min,P<0.05)、(0.51±0.12)(髓质,RAS-30min,P<0.05)、(0.46±0.13)(皮质,RAS-60min,P<0.05)、(0.56±0.09)(髓质,RAS-60min,P<0.05)。RBF分别为(63.90±37.93)mL/(100g•min)(皮质,RAS-30min,P<0.05)、(31.29±12.97)mL/(100g•min)(髓质,RAS-30min,P<0.05)、(66.95±39.82)mL/(100g•min)(皮质,RAS-60min,P<0.05)、(31.46±17.23)mL/(100g•min)(髓质,RAS-60min,P<0.05,图3)。
讨 论
1.肾脏动脉狭窄与肾脏RBF、OEF变化之间的病理生理关系及临床意义
RAS会对肾脏的存活能力造成威胁,但其所导致的肾损害甚至肾脏纤维化是否与肾脏氧代谢水平降低和局部组织缺血相关还未知。由于缺乏适当的评估人类肾脏组织氧代谢水平的方法,故上述问题还无定论,所以定量测量肾脏特别是肾髓质区域的氧代谢水平对于肾脏疾病的诊断和治疗非常重要。明确肾动脉狭窄对于肾脏氧代谢功能影响机制对于相关疾病的提早预防、治疗及疗效评估有重要的临床意义。
在正常的生理条件下,相对于肾皮质区域,肾髓质区域处于相对低氧的状态,因此肾脏髓质区域易于受到由于肾脏氧供给和需求不平衡造成的急性或慢性损伤。本研究通过部分结扎单侧肾动脉,模拟肾动脉狭窄,使该侧肾脏动脉血流灌注减少,导致肾脏处于低氧状态,在此病理生理条件下肾脏为了继续维持其活性,将使肾脏OEF升高以补偿其减少的血流灌注;故可以通过观测RAS手术前后RBF和OEF的变化趋势,评判利用MEGSE序列估算肾脏OEF的有效性和敏感性。

图3 15只兔子肾脏氧摄取分数(OEF)和血流灌注(RBF)在基础状态与RAS术后整体均值及标准差示意图。*表示差异有统计学意义(P<0.05)。a)血流灌注(RBF)示意图;b)氧摄取分数(OEF)示意图。
2.MEGSE序列的优势
肾脏缺氧的检测大部分基于有创性的微电极技术[2,26]。其它方法包括乏氧标记物法如低氧诱导因子[21-28]、Pimonidazole法[29]等,但这些方法均无法应用于人体。与其它方法不同的是,MRI对于人体组织病变有很高的空间分辨力,在组织结构、功能、生理和新陈代谢等多方面是一种更为安全、全面的检查方法。临床上MEGSE技术能够无创、定量评估肾脏OEF,是一种评估肾脏氧代谢水平的工具。在本次可行性研究中,由MEGSE序列测得的肾脏OEF在RAS术后比基础状态下显著增加,这与理论预测一致,证实了MEGSE测量肾脏OEF的可行性。
3.磁共振信号衰减理论模型的假设条件适用性分析
Yablonskiy等[17]的磁共振信号衰减理论模型基于如下三个假设:①方向随机性,可以将模型中产生信号的物体假设成随机朝向分布的磁性粒子,用这些粒子来模拟毛细血管网中的细小血管。肾脏实质中这个假设是满足的,因为非常细小的随机分布的毛细血管的直径约为10微米,这个尺度要远远小于毛细血管的长度,满足我们的假设。②在这个模型里,我们将血管外顺磁性的脱氧血红蛋白考虑进模型,假设信号的损失由这些粒子引起,而血管内效应并没有被考虑。③在这个模型中,由质子扩散导致的信号损失被忽略掉了。对于血管内空间来说,Kennan等[30]发现影响扩散效应的因素有序列和干扰源;对于血管外空间效应,我们在模型中对靠近自旋回波附近的信号使用二阶多项式函数进行拟合,据报道这个函数可以将血管外扩散效应降到最小[31]。
4.基于剩余平方和(RSS)估算组织OEF的优势
基于Yablonskiy等[21]提出的信号衰减模型估算组织OEF等氧代谢指标,用两个解析表达式近似替换原始模型,需要预先设定一个参考的OEF值,但通常OEF是未知的,特别是对于病理情况下的OEF,其可能的变化范围为0~1之间,所以选择参考OEF值对于氧代谢参数估算的准确性非常重要。本研究中,我们利用剩余平方和(RSS)作为选择最优参考OEF的判断标准,可以更加准确地估算出肾脏OEF及其他氧代谢指标。
5.本研究的不足
由BOLD机制可知,脱氧血红蛋白作为内源性对比剂,在T2或T2*加权图像上引起信号衰减[5,32],但人体组织中除了脱氧血红蛋白以外,还有其它导致信号衰减的因素,例如在空气和组织交界区域,由于存在不同组织间的磁化率差异,导致磁场不均匀,同样引起信号衰减,此即磁敏感伪影,这将造成氧代谢指标R2 和vCBV的估计值过高,并可能进一步影响到对肾脏OEF估计的准确性。本研究中,腹部器官、肾脏皮质区域由于存在不同组织交界面,较易受到磁敏感伪影的影响。
MEGSE技术在腹部及盆腔的应用受到呼吸、心跳、肠道蠕动等的影响,本研究利用专用气体麻醉机使兔子处于深度麻醉状态中,呼吸平稳,并通过图像后处理将运动导致的MEGSE异常信号所在的MRI层面剔除,进一步减少了运动对PBF估算的影响。
本研究中所用的MEGSE序列只限于单层数据采集模式,由于MEGSE是基于自旋回波序列,故扫描时间较长,平均需要3~5min(基于不同的重复次数)。另外,MEGSE序列的采样时间分辨力受到扫描设备硬件条件限制,不能根据模型信号曲线分布优化分配采样时间。为了更好地应用于临床,我们需要在此基础上开发能自由分配采样时间、具有更高时间分辨力、更短扫描时间的序列、技术来估算肾脏OEF。
总之,本研究验证了MEGSE序列可以无创、定量测量肾缺血状态下的OEF改变,为将来进一步应用于人类肾脏氧摄取分数的测量奠定了基础。
参考文献:
[1] Brezis M,Rosen S.Hypoxia of the renal medulla——its implications for disease[J].N Engl J Med,1995,332(10):647-655.
[2] Brezis M,Agmon Y,Epstein FH.Determinants of intrarenal oxy-
genation.I.Effects of diuretics[J].Am J Physiol,1994,267(6Pt 2):1059-1062.
[3] Ogawa S,Lee TM,Kay AR,et al.Brain magnetic resonance imaging with contrast dependent on blood oxygenation[J].Proc Natl Acad Sci USA,1990,87(24):9868-9872.
[4] Ogawa S,Lee TM,Barrere B.The sensitivity of magnetic resonance image signals of a rat brain to changes in the cerebral venous blood oxygenation[J].Magn Reson Med,1993,29(2):205-210.
[5] Ogawa S,Menom RS,Tank DW,et al.Functional brain mapping by blood oxygenation level-dependent contrast magnetic resonance imaging.A comparison of signal characteristics with a biophysical model[J].Biophysical J,1993,64(3):803-812.
[6] Prasad PV,Edelman RR,Epstein FH.Noninvasive evaluation of intrarenal oxygenation with BOLD MRI[J].Circulation,1996,94 (12):3271-3275.
[7] Prasad PV,Chen Q,Goldfarb JW,et al.Breath-hold R2*mapping with a multiple gradient-recalled echo sequence:application to the evaluation of intrarenal oxygenation[J].J Magn Reson Imaging,1997,7(6):1163-1165.
[8] Li LP,Storey P,Pierchala L,et al.Evaluation of the reproducibility of intrarenal R2*and Delta R2*measurements following administration of furosemide and during waterload[J].J Magn Reson Imaging,2004,19(5):610-616.
[9] Li LP,Vu AT,Li BS,et al.Evaluation of intrarenal oxygenation by BOLD MRI at 3.0T[J].J Magn Reson Imaging,2004,20(5): 901-904.
[10] Prasad PV,Priatna A,Spokes K,et al.Changes in intrarenal oxygenation as evaluated by BOLD MRI in a rat kidney model for radiocontrast nephropathy[J].J Magn Reson Imaging,2001,13 (5):744-747.
[11] Sadowski EA,Fain SB,Alforol SK,et al.Assessment of acute renal transplant rejection with blood oxygen level-dependent MR imaging:initial experience[J].Radiology,2005,236(3):911-919.
[12] Hofmann L,Simon-Zoula S,Nowak A,et al.BOLD-MRI for the assessment of renal oxygenation in humans:acute effect of nephrotoxic xenobiotics[J].Kidney Int,2006,70(1):144-150.
[13] dos Santos EA,Li LP,Ji L,et al.Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging[J].Invest Radiol,2007,42(3):157-162.
[14] Thoeny HC,Kessler TM,Simon-Zoula S,et al.Renal oxygenation changes during acute unilateral ureteral obstruction:assessment with blood oxygen level-dependent mr imaging——initial experience[J].Radiology,2008,247(3):754-761.
[15] Zhang X,Zhang Y,Yang X,et al.Feasibility of noninvasive quantitative measurements of intrarenal R2'in humans using an asymmetric spin echo echo planar imaging sequence[J].NMR Biomed,2013,26(1):91-97.
[16] Bandettini PA,Wong EC,Jesmanowicz A,et al.Spin-echo and gradient-echo EPI of human brain activation using BOLD contrast:a comparative study at 1.5T[J].NMR Biomed,1994,7(1-2):12-20.
[17] Yablonskiy DA,Haacke EM.Theory of NMR signal behavior in magnetically inhomogeneous tissues:the static dephasing regime [J].Magn Reson Med,1994,32(6):749-763.
[18] An H,Lin W.Quantitative measurements of cerebral blood oxygen saturation using magnetic resonance imaging[J].J Cereb Blood Flow Metab,2000,20(8):1225-1236.
[19] He X,Yablonskiy DA.Quantitative BOLD:mapping of human cerebral deoxygenated blood volume and oxygen extraction fraction:default state[J].Magn Reson Med,2007,57(1):115-126.
[20] Ogawa S,Lee TM.Magnetic resonance imaging of blood vessels at high fields:in vivo and in vitro measurements and image simulation[J].Magn Reson Med,1990,16(1):9-18.
[21] Spees WM,Yablonskiy DA,Oswood MC,et al.Water proton MR properties of human blood at 1.5T:magnetic susceptibility,T1,T2,T2*,and non-Lorentzian signal behavior[J].Magn Reson Med,2001,45(4):533-542.
[22] Schenck JF.The role of magnetic susceptibility in magnetic resonance imaging:MRI magnetic compatibility of the first and second kinds[J].Med Phys,1996,23(6):815-850.
[23] Weisskoff RM,Kiihne S.MRI susceptometry:image-based measurement of absolute susceptibility of MR contrast agents and human blood[J].Magn Reson Med,1992,24(2):375-383.
[24] An H,Lin W.Impact of intravascular signal on quantitative measures of cerebral oxygen extraction and blood volume under normo-and hypercapnic conditions using an asymmetric spin echo approach[J].Magn Reson Med,2003,50(4):708-716.
[25] Eichling JO,Raichle ME,Grubb RL,et al.In vivo determination of cerebral blood volume with radioactive oxygen-15in the monkey[J].Circ Res,1975,37(6):707-714.
[26] Brezis M,Heyman SN,Epstein FH.Determinants of intrarenal oxygenation.II.Hemodynamic effects[J].Am J Physiol,1994,267(6):1063-1068.
[27] Zou AP,Yang ZZ,Li PL,et al.Oxygen-dependent expression of hypoxia-inducible factor-1alpha in renal medullary cells of rats [J].Physiol Genomics,2001,6(3):159-168.
[28] Rosenberger C,Mandriota S,Jürgensen JS,et al.Expression of hypoxia-inducible factor-1alpha and-2alpha in hypoxic and ischemic rat kidneys[J].J Am Soc Nephrol,2002,13(7):1721-1732.
[29] Basile DP,Donohoe D,Roethe K,et al.Renal ischemic injury results in permanent damage to peritubular capillaries and influences long-term function[J].Am J Physiol Renal Physiol,2001,281(5):887-899.
[30] Kennan RP,Zhong J,Gore JC.Intravascular susceptibility contrast mechanisms in tissues[J].Magn Reson Med,1994,31(1): 9-21.
[31] Haacke EM.Magnetic resonance imaging:physical principles and sequence design[M].New York:A John Wiley and Sons,1995: 914.
[32] Thulborn KR,Waterton JC,Matthews PM,et al.Oxygenation dependence of the transverse relaxation time of water protons in whole blood at high field[J].Biochim Biophys Acta,1982,714 (2):265-270.
•肾移植影像学专题•
Feasibility of non-invasively quantitative measurements of Intrarenal oxygen extraction fraction(OEF)in rabbits with unilater-al renal artery stenosis using MRI
ZHANG Xiao-dong,MI Yue,WANG Jing,et al.Department of Radiology,Peking University First Hospital,Beijing 100034,P.R.China
【Abstract】Objective:To demonstrate the feasibility of 2Dmulti-echo gradient and spin echo(MEGSE)sequence used for non-invasive quantitative measurements of intrarenal oxygen extraction fraction(OEF)in rabbits with unilateral renal artery stenosis(RAS).Methods:Fifteen New Zealand rabbits with a mean weight of 3.2kg were used in this study.Unilateral partial ligation of left renal artery was performed to create the animal model of acute RAS.Three sequential MEGSE scans were performed pre-RAS operation(baseline:tp1),30min post-RAS operation(tp2)and 60min post-RAS operation (tp3)respectively,to acquire the OEF before and after the renal artery stenosis.Results:Significant increments of OEF in the renal cortex and medulla were obtained(Cortex,OEF=0.36±0.08at baseline vs 0.46±0.14at post-RAS 30min,0.46±0.13at post-RAS 60min,P<0.05;Medulla,OEF=0.39±0.11at baseline vs 0.51±0.12at post-RAS 30min,0.56±0.09at post-RAS 60min,P<0.05),suggesting an increase of oxygen consumption in the cortex and medulla region after the renal artery stenosis.Conclusion:Our results demonstrate a consistent and significant increase of renal OEF in rabbits post renal artery stenosis,suggesting that MEGSE technique can be utilized to noninvasively detect pathophysiological changes in intrarenal OEF during an reduction of renal blood flow,which may be potentially applicable in humans in the future.
【Key words】Oxygen extraction fraction;Renal artery stenosis;Magnetic resonance imaging
收稿日期:(2015-03-11)
基金项目:高等学校博士学科点专项科研基金(20110001120053);首都卫生发展科研专项项目(2011-4021-02)资助
通讯作者:王霄英,E-mail:cjr.wangxiaoying@vip.163.com
作者简介:张晓东(1979-),男,山西人,博士,技师,主要从事医学物理师工作。
DOI:10.13609/j.cnki.1000-0313.2015.05.005
【中图分类号】R692.9;R445.2
【文献标识码】A
【文章编号】1000-0313(2015)05-0519-06

