五厂家维C银翘片对乙酰氨基酚的体外溶出度评价
王 翼,王 伟,张 倩,卞华晴
五厂家维C银翘片对乙酰氨基酚的体外溶出度评价
王 翼*,王 伟,张 倩,卞华晴
目的 测定市售维C银翘片对乙酰氨基酚的体外溶出度,反映产品的内在质量。方法 采用高效液相色谱法,根据我国药典和日本橙皮书对对乙酰氨基酚片的体外溶出要求,分别在5种介质中测定其体外溶出度。结果 5个厂家的维C银翘片对乙酰氨基酚片的体外溶出均达不到要求。结论 维C银翘片应增加体外溶出度检测,以提高产品质量。
维C银翘片;对乙酰氨基酚;溶出;高效液相色谱
0 引言
维C银翘片为中西药复方制剂,疏风解表,清热解毒,临床上常用于外感风热所致的流行性感冒[1]。到目前为止,国家食品药品监督管理局已陆续颁布了338个生产批文[2],生产厂家众多。但在其质量控制(2010版中国药典一部)上,对发挥药效的主要成分对乙酰氨基酚(每片含105 mg)仅有含量要求。而对于口服固体制剂,体外溶出度是评价药品质量非常重要的一个指标,且在我国和日本的药品质量标准[3-4]中,对“单方制剂”——对乙酰氨基酚片均有溶出度要求,且后者更加严格。目前已有文献[5-8]报道了维C银翘片的溶出度相关问题,但其共同点都是采用单一溶出介质来评价产品的溶出情况。鉴于此,本文分别按照我国和日本对对乙酰氨基酚片的溶出要求,以上市的5个不同厂家生产的维C银翘片为对象,采用高效液相色谱法,在不同溶出介质中,对其主要成分——对乙酰氨基酚进行体外溶出测定,以反映不同厂家产品间的内在质量差异,也进一步说明溶出度检测的必要性。
1 仪器与试药
高效液相色谱仪(日本岛津公司,包括LC-20AT泵,DGU-20A3在线脱气机,CTO-10AS VP柱温箱,SPD-20A紫外检测器),AL-104电子天平[梅特勒-托利多仪器(上海)有限公司],ZRS-8L智能溶出试验仪(天津市天大天发科技有限公司)。
维C银翘片(A、B、C、D、E共5个厂家,批号:130310、20140124、130602、130906、20131202),对乙酰氨基酚对照品[批号:71302229,河北冀衡(集团)药业有限公司];甲醇(色谱纯,批号:20130115,上海强顺化学试剂有限公司),盐酸、氯化钠、冰醋酸、醋酸钠、磷酸氢二钠、磷酸二氢钾均为分析纯。
2 方法与结果
2.1 对乙酰氨基酚的含量测定
2.1.1 对照品和供试品溶液的制备 对照品溶液的制备:精密称定对乙酰氨基酚对照品20 mg于100 mL容量瓶中,加流动相超声溶解并稀释至刻度,摇匀,得浓度为200 μg/mL的对照品储备液。精密移取对照品储备液5 mL于100 mL容量瓶,加流动相稀释至刻度,摇匀,即得浓度为10 μg/mL的对照品溶液。
供试品溶液的制备:取本品20片,去包衣,精密称定,研细。精密称取细粉约0.03 g至100 mL容量瓶中,加流动相超声溶解,并稀释至刻度,摇匀,过滤。精密移取续滤液1 mL至10 mL容量瓶中,用流动相稀释至刻度,摇匀,经0.45 μm微孔滤膜过滤,即得供试品溶液。
2.1.2 色谱条件及系统适应性试验 色谱柱:Inertsil ODS-SP(4.6 mm×250 mm,5 μm);流动相:磷酸盐缓冲液(pH 4.5)-甲醇(50∶50);柱温:30.0 ℃;流速:0.800 mL/min;检测波长:243 nm;进样体积:20 μL。分别取对照品溶液和供试品溶液注入色谱仪,色谱图见图1,理论塔板数按对乙酰氨基酚计算不低于3 500,拖尾因子为1.09、分离度为2.18。

图1 对照品(A)及供试品(B)色谱图
2.1.3 线性关系考察 以流动相为溶剂对对照品储备液进行系列稀释,得不同浓度的对照品溶液,分别注入色谱仪,以峰面积对浓度进行线性回归,得回归方程为A=122 543 C-50 147,相关系数r=0.999 9,在2~140 μg/mL范围内,线性关系良好。
2.1.4 精密度试验 取对照品溶液,连续进样6次,记录峰面积,结果对乙酰氨基酚的峰面积RSD值为1.1%。
2.1.5 重复性试验 按“2.1.1”项方法平行制备6份供试品,分别进样,记录对乙酰氨基酚的峰面积,计算对乙酰氨基酚的含量,结果RSD为0.8%。
2.1.6 稳定性试验 取供试品溶液,室温放置,每隔2 h进样,记录峰面积,结果12 h内对乙酰氨基酚峰面积RSD为1.3%。
2.1.7 样品含量测定 取待测样品,按“2.1.1”项方法制备供试品溶液,进样,记录峰面积,根据标准曲线方程计算样品含量。结果,5个厂家(A、B、C、D、E)产品的对乙酰氨基酚的含量均符合要求,分别为标示量的106.7%±1.2%、104.0%±0.4%、99.7%±0.3%、92.8%±0.8%、105.4%±1.6%(n=3)。
2.1.8 回收率试验 分别称取已知含量(约相当于对乙酰氨基酚12 mg)的样品细粉9份,精密称定,置100 mL容量瓶中,分别按80%(约10 mg)、100%(约12 mg)、120%(约14 mg)加入对乙酰氨基酚对照品,用流动相超声溶解,并稀释至刻度,摇匀,过滤。精密移取续滤液1 mL至10 mL容量瓶,用流动相稀释至刻度,经0.45 μm微孔滤膜过滤,进样,记录峰面积,根据标准曲线方程,计算含量,结果平均回收率为98.3%±2.1%(n=9)。
2.2 对乙酰氨基酚的溶出度测定 根据对乙酰氨基酚片的我国现行质量标准[3],采用转篮法,转速为100 r/min,以稀盐酸(取盐酸234 mL稀释至1 000 mL)24 mL加水至1 000 mL为溶出介质。
根据对乙酰氨基酚片的日本橙皮书标准,采用桨法,转速为50 r/min,介质分别为pH 1.2的溶液(pH=1.2盐酸溶液:取氯化钠2.0 g,加水适量使溶解,加盐酸7 mL,再加水稀释至1 000 mL,即得)、pH 4.0醋酸盐缓冲液(0.05 mol/L醋酸溶液∶0.05 mol/L醋酸钠溶液=16.4∶3.6)、pH 6.8磷酸盐缓冲液(称取磷酸二氢钾3.4 g,十二水合磷酸氢二钠8.96 g,加水溶解,稀释至1 000 mL,再用水稀释一倍,即得)和水,体积均为900 mL。
照中国药典溶出度测定法(附录XC),分别于5、10、15、30、45、60 min取样10 mL,经0.45 μm微孔滤膜过滤,取续滤液进样,测得对乙酰氨基酚的峰面积,代入标准曲线方程,求得对应的溶出度,溶出曲线见图2。
根据我国对乙酰氨基酚片现行的质量标准,要求在30 min时的溶出度不低于80%,而根据日本橙皮书的要求,要求在以上4种不同的溶出介质中,在15 min时,溶出度均不低于80%。所以,从溶出度测定结果可以看出,所考察的5个厂家产品的对乙酰氨基酚的溶出度均十分不理想,且各厂家之间差异较大。
3 讨论
体外溶出度的测定是反映口服固体制剂内在质量的一个非常重要的指标。笔者认为,既然“单方制剂”对乙酰氨基酚片有溶出度要求,则以对乙酰氨基酚作为主要发挥药效的口服复方固体制剂,也应把“对乙酰氨基酚的体外溶出”作为其一项质量要求。从本文中可以看出,5个厂家产品的含量均合格,但溶出度却差强人意。
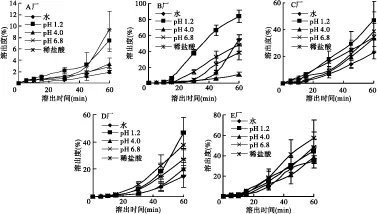
图2 五厂家(A、B、C、D、E)维C银翘片体外溶出曲线图
目前,我国正在开展仿制药质量一致性评价工作[9],测定产品在不同介质中的体外溶出行为,以更好地反映和控制产品质量,但其主要是针对“西药”的口服固体仿制制剂。对于口服中药固体制剂,笔者认为不仅应尽快增加“溶出度测定”这一检测项目,也应根据“药品质量一致性评价”的方法思路对市售的不同厂家生产的同一中成药进行内在质量评价,督促生产厂家提高产品质量,保证患者用药的疗效一致。
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:1141.
[2]国家食品药品监督管理总局.药品查询.[EB/OL].http://app1.sfda.gov.cn/datasearch/face3/base.jsp.
[3]国家药典委员会.中华人民共和国药典(二部)[S].北京,中国医药科技出版社,2010:235.
[4]国家食品药品监督管理总局药品审评中心.药品体外溶出试验信息库[EB/OL].http://www.cde.org.cn/recommend.do?method=view&id=8.
[5]辛勋,朱辉.维C银翘片的体外溶出度检测[J].基层中药杂志,1999,13(2):6-7.
[6]沈春鸣.双波长分光光度法测定维C银翘片溶出速率[J].中国药业,2003,12(9):35-36.
[7]王彤,孙冶.HPLC法测定维C银翘片中对乙酰氨基酚的溶出度[J].中国药事,2005,19(10):617-618.
[8]郭怀忠,庞晓敏,王进文,等.高效液相色谱法测定维C银翘片溶出度的研究[J].中成药,2011,33(7):1178-1182.
[9]国家食品药品监督管理总局.国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知[EB/OL].2013-2-16.http://www.sda.gov.cn/WS01/CL0844/78516.html
Dissolution of paracetamol from 5 different brands of Vitamin C Yinqiao Tablets
WANG Yi*,WANG Wei,ZHANG Qian,BIAN Hua-qing
(Department of Chemistry,Taizhou Institute of Sci.&Tech.,NUST,Taizhou 225300,China)
Objective To determine the dissolution of paracetamol from 5 different brands of Vitamin C Yinqiao Tablets and to reflect the intrinsic quality.Methods The dissolution was determined in 5 different medium using HPLC according to the dissolution requirements of paracetamol tablets.Results The dissolution of Vitamin C Yinqiao Tablets from 5 factories failed to achieve the standards of Ch.P.and orange book.Conclusion The dissolution should be detected so as to improve the quality of Vitamin C Yinqiao Tablets.
Vitamin C Yinqiao Tablets; Paracetamol; Dissolution; HPLC
2014-12-09
南京理工大学泰州科技学院化工学院,江苏 泰州 225300
江苏省大学生实践创新训练计划项目(201413842015Y)
10.14053/j.cnki.ppcr.201507018
*通信作者

