红三叶ISSR-PCR反应体系的建立与优化
孟丽娟,赵桂琴
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
红三叶ISSR-PCR反应体系的建立与优化
孟丽娟,赵桂琴
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
采用正交试验设计,对影响红三叶ISSR-PCR反应较大的4个因素(TaqDNA 聚合酶、Mg2+、dNTP及引物)在4个水平上进行筛选,建立并优化了适合红三叶ISSR分析的最佳反应体系。在25 μL反应体系中各反应物的最适含量为40 ng模板DNA,10×PCR-buffer 2.5 μL,2.5 mmol/L Mg2+,2.5 UTaqDNA聚合酶,引物1 μmol/L,0.2 mmol/L dNTP。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,引物退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min,4 ℃保存。优化体系的建立为采用ISSR分子标记技术进行红三叶种质资源遗传多样性分析提供了技术参考。
红三叶;ISSR-PCR;正交优化
红三叶(Trifoliumpratense)为豆科三叶草属多年生草本植物,生存5~8年。中国新疆、吉林、云贵高原、湖北鄂西山地都有野生分布,江淮流域、华南、西南和西北等地均有栽培,是长江流域以南及甘肃二阴区优良的豆科牧草[1,2]。红三叶生长速度快、再生力强、产草量高、草质柔嫩多汁、适口性好、营养价值高,各种畜禽和鱼类均喜食[3]。目前,三叶草遗传多样性研究主要采用RAPD[4,5]、SRAP[6]、SSR[7]等技术,而且大多集中于白三叶。对红三叶种质资源的研究主要集中在栽培技术[8],株型结构[9],营养价值[10],转基因[11],异黄酮[12]等方面,利用ISSR标记研究红三叶遗传多样性具有实际价值。
ISSR标记是在微卫星分子标记基础上发展起来的一种分子标记[13]。该技术利用简单重复序列(SSR)来设计引物,无需预先克隆和测序,操作简单易行。ISSR引物序列长、退火温度高、特异性和稳定性增强,可检测到更丰富的遗传变异[14]。ISSR标记结合了RAPD和SSR的优点,具有模板需要量少,多态性丰富,无需试剂盒,结果记录方便,试验成本低,操作简单,试验稳定性高等优点而倍受青睐[15],广泛应用于生物研究的各个领域。近年来,ISSR分子标记技术已开始应用于草种质资源遗传多样性研究,在早熟禾(Poaannua)[16]、鹅观草(Roegneriakamoji)[17]、燕麦(Avenasativa)[18]、披碱草(Elymusnutans)[19]、紫花苜蓿(Medicagosativa)[20]、昆仑锦鸡儿(Caraganapolourensis)[21]、小花棘豆(Oxytropisglabra)[22]和扁蓄豆(Ruthenianmedic)[23]等牧草上均有报道。但由于ISSR-PCR是基于PCR 的一种标记,其反应条件易受到各因素浓度的影响,反应体系不同也可产生不同的结果。为了确保ISSR分析结果的可靠性和重复性,进行ISSR-PCR反应体系的优化非常必要。利用ISSR分子标记技术,以国外引进的10份红三叶种质为材料,以红三叶基因组DNA为模板,采用正交实验设计[24]对ISSR-PCR反应体系进行优化,探讨反应体系中随机引物、dNTP、TaqDNA聚合酶、Mg2+等的浓度以及反应的退火温度和循环次数等因子对红三叶基因组的ISSR扩增效果的影响,旨在建立一种用于红三叶的ISSR-PCR反应体系,为进一步开展红三叶遗传多样性研究奠定基础。
1 材料和方法
1.1 试验材料
供试的10份红三叶材料(表1),均种植于甘肃省中部的榆中县良种场,在生长期采集新鲜叶片,置于-80 ℃冰箱保存备用。

表1 试验材料及来源Table1 The sampled materials and source
1.2 试剂
TaqDNA 聚合酶、dNTPs、PCR Buffer、引物、MgCl2、Maker 均来自上海生工。ISSR引物参照加拿大哥伦比亚大学(UBC)提供的ISSR引物序列,由上海生物工程有限公司合成。
1.3 基因组DNA的提取与检测
采用改良的CTAB法[25]提取红三叶叶片总DNA,用1%的琼脂糖凝胶电泳检测质量,并用Gene Spec核酸检测仪检测DNA 质量浓度。最后将样品稀释为20 ng/μL,-20 ℃保存备用。
1.4 ISSR-PCR正交试验设计
在PCR反应体系建立过程中,dNTP浓度、引物浓度、Mg2+浓度以及TaqDNA聚合酶用量、退火温度和循环次数等均影响PCR扩增结果。针对TaqDNA聚合酶用量、Mg2+浓度、dNTP浓度、引物浓度等4个主要因素,选用L16(44)正交表[26],设计PCR各反应成分的因素水平(表2)及正交试验(表3)。反应体系总体积为25 μL,除上述4个变化因素外,每管包括10×PCR Buffer 2.5 μL,模板DNA 2 μL。采用筛选的最佳引物UBC841作为固定引物,用1号红三叶种质的DNA作为固定模板,进行PCR扩增条件的优化,初始反应程序为:94 ℃预变性5 min;94 ℃变性30 s,引物退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min,4 ℃保存。PCR扩增完成后,取8 μL扩增产物在1.7%的琼脂糖凝胶上电泳,在1×TBE 缓冲液中电泳约1 h(电压为100 V),检测后置于UVP 紫外凝胶成像系统中观察拍照。
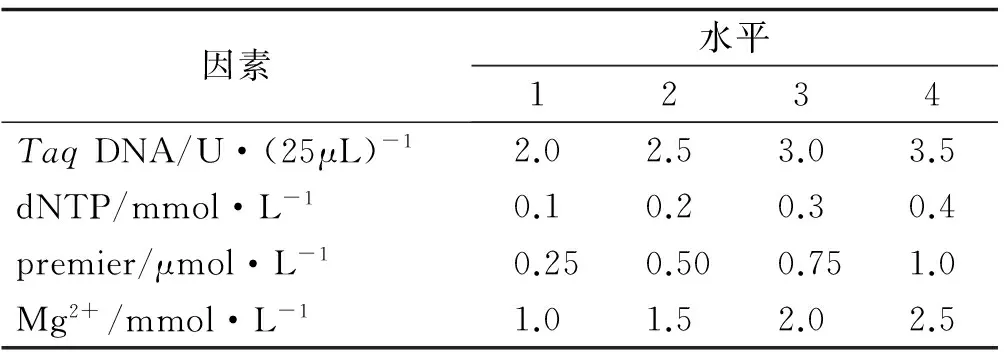
表2 ISSR-PCR反应的因素与水平Table2 Factors and levels of ISSR-PCR reaction
1.5 退火温度和循环次数的确定
根据正交试验结果找出最佳处理,应用最佳处理从20条引物中筛选出多态性丰富的引物。根据所选引物的理论退火温度Tm[Tm=4(G+C)+2(A+T)],对每个引物的退火温度进行梯度试验,设定退火温度为47~57 ℃,由PCR扩增仪自动生成8个温度梯度。即47.0、47.7、48.9、50.7、53.0、54.9、56.2、57.0 ℃。用基础反应程序筛选引物的最佳退火温度。根据最佳反应体系和最适退火温度对循环次数进行3个梯度试验。即30、35、40次,每个梯度设2个重复。
1.6 优化体系稳定性检测
随机筛选其他ISSR引物,对优化确定的红三叶ISSR-PCR反应体系、退火温度及循环次数进行扩增,对优化体系的稳定性进行检测。
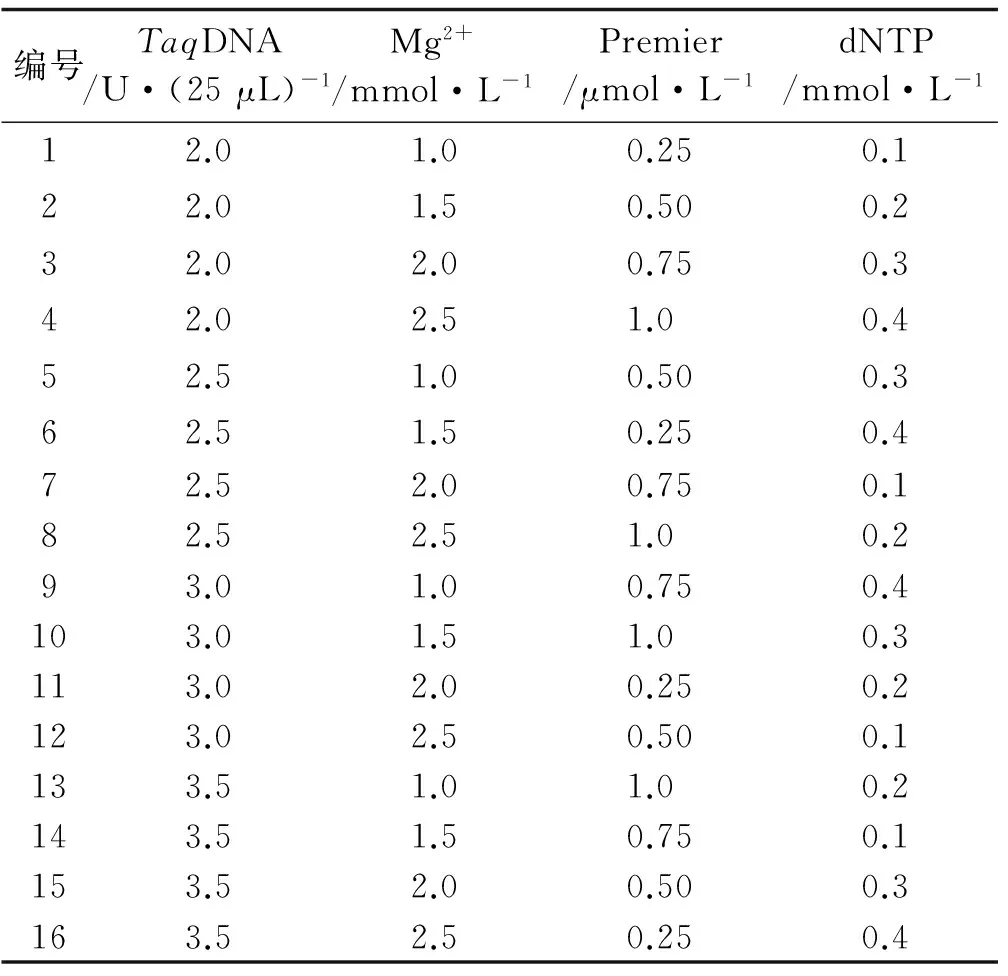
表3 ISSR-PCR正交试验设计方案Table3 Orthogonal design[L16(44)]for ISSR-PCR reaction
2 结果与分析
2.1 红三叶基因组DNA的提取与检测
提取高质量的红三叶基因组DNA是ISSR扩增成功与否的关键,试验采用了改进的CTAB法提取DNA。所提取DNA无色透明,可溶性好,谱带清晰,无拖带现象,表明DNA并未发生降解,点样孔无荧光出现,蛋白质、酚类和其他杂质较少,符合PCR要求(图1)。

图1 10个红三叶品系基因组DNA电泳图Fig.1 Electrophoresis of genetic DNA of 10 red clover accessions
注:1~10为10个红三叶种质的DNA电泳检测,顺序与表1一致
2.2 ISSR反应体系的正交优化
按表3设计的16个处理进行PCR反应后,将扩增产物进行1.7%琼脂糖凝胶电泳(图2)。从ISSR-PCR扩增结果可以直观看出,在16个处理组合中,由于引物、dNTP、Mg2+、TaqDNA 聚合酶4大影响因素浓度组合的不同,扩增效果存在明显的差异。第1、4、7、11组合无条带;第2、5、6、12、15组合扩增效果较差,谱带弱且多态性低;第3、9、10、14、16组合扩增谱带较多,但部分信号较弱,且条带不清晰;第8、13组合扩增谱带清晰,多态性高(图2)。最佳组合应选择特异性强、谱带多态性高、谱带清晰且谱带较稳定的组合。根据谱带数、特异性和经济性的原则,确定8号组合为最佳组合。由此得出,红三叶ISSR-PCR反应体系中,总体积25 μL的最佳反应体系为:TaqDNA聚合酶2.5 U,dNTP 0.2 mmol/L,Mg2+2.5 mmol/L,引物1.0 μmol/L。
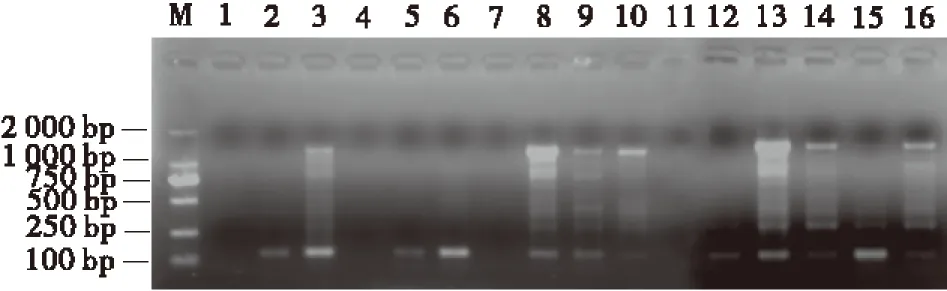
图2 正交设计ISSR-PCR反应体系扩增Fig.2 The amplification result of ISSR-PCR with orthogonal design
注:M为Marker ,1~16为表3的处理组合编号
2.3 引物筛选和退火温度的确定
根据正交设计试验结果,选择8号处理组合,对20条引物进行初步筛选和复筛,最终将扩增条带清晰、多态性丰富、重复性好的5条引物用于全部样品的扩增和不同引物退火温度的筛选。ISSR-PCR反应中,退火温度的高低直接影响引物与模板DNA的特异性结合。引物的碱基构成不同,适宜的退火温度就不同。因此,确定不同引物的最佳退火温度非常必要。为了得到重复性好、分辨率高的扩增谱带,根据所选引物碱基组成估算理论退火温度Tm[Tm=4(G+C)+2(A+T)],在理论退火温度上下设置8个梯度,在梯度PCR仪上进行退火温度筛选。从20条引物中筛选出5条适宜红三叶ISSR分析的引物及最佳的退火温度(表4)。
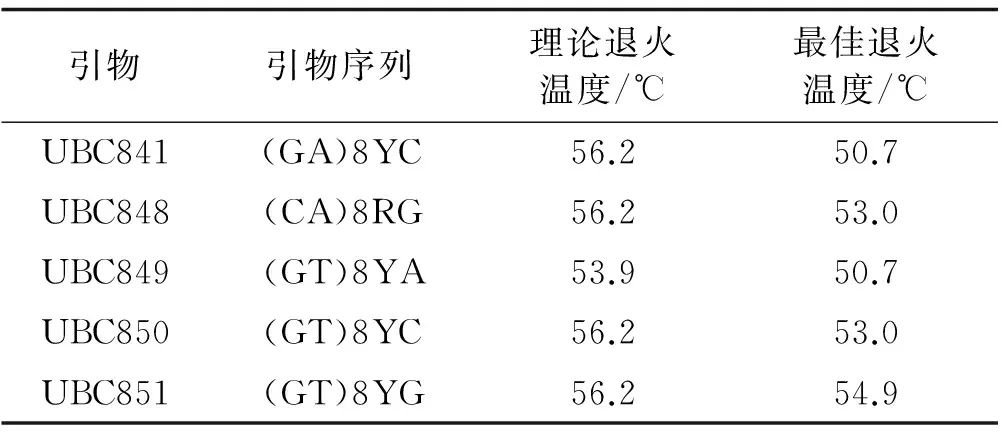
表4 ISSR引物序列和最佳退火温度Table4 ISSR primer sequences and suiTableannealing temperature
采用最佳反应体系对引物UBC841进行温度梯度PCR试验。退火温度较低时,扩增条带较弱,47.7 ℃和48.9 ℃时扩增条带相同,但50.7 ℃时扩增的条带最清晰,最稳定。53.0 ℃和54.9 ℃时扩增特异带减少, 随着退火温度的提高,扩增条带明显减少(图3)。故引物UBC841的最佳退火温度为50.7 ℃ 。由于ISSR引物较长,可适当提高退火温度以提高扩增产物的特异性。
2.4 循环次数对ISSR扩增的影响
循环次数对扩增产物量有明显的影响。循环次数太少,产物量较低;循环次数太多,则达到反应平台后,循环不会使产物量增加,反而引起非特异性扩增。因此,选择适宜的循环次数将会获得良好的扩增效果。在确立了以上各影响因素最适条件的基础上,分别试验了不同循环次数(30、35、40)对扩增结果的影响。所有的循环次数都可扩增出谱带,30个循环时,部分谱带较弱,产率低;35个循环时,扩增谱带强弱合适,清晰稳定;40个循环时,扩增谱带少,部分带型较弱或缺失(图4)。因此,试验的循环次数确定为35次。

图3 引物UBC841退火温度对扩增结果的影响Fig.3 Effect of annealing temperature of UBC 851 primer on amplification pattern
注:M为Marker,1~8为退火温度47.0 ℃、47.7 ℃、48.9 ℃、50.7 ℃、53.0 ℃、54.9 ℃、56.2 ℃、57.0 ℃
2.5 ISSR-PCR反应体系的稳定性检测
通过对反应体系、退火温度、循环次数和程序的优化,建立了适合红三叶ISSR分子标记的最优体系。即25 μL 体系中,2.5 μL 10×PCR buffer,TaqDNA 聚合酶2.5 U,0.2 mmol/L dNTP,2.5 mmol/L Mg2+,1 μmol/L引物和模板DNA 2 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,引物退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min,4 ℃保存。
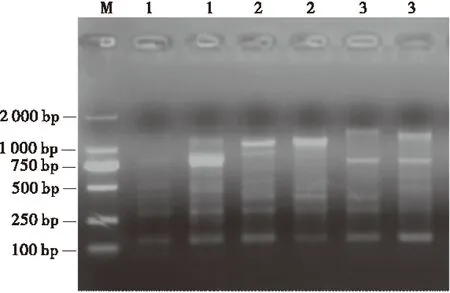
图4 循环次数对扩增结果的影响Fig.4 Effect of cycle number on amplification
注:M为Marker,1~3为循环次数,分别为30,35和40
利用正交试验优化的反应体系、最适退火温度和最佳循环次数,选择其他引物UBC851对10份红三叶种质进行PCR扩增,以检测所优化的ISSR-PCR反应体系的稳定性和可靠性。结果表明,引物UBC851在10份红三叶种质上扩增出的条带清晰、明亮、重复性好、多态性丰富(图5)。说明该反应体系适合于红三叶种质资源的ISSR-PCR反应,可用于红三叶遗传多样性分析和研究。
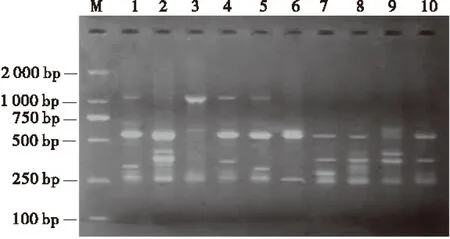
图5 红三叶种质DNA的ISSR 扩增结果Fig.1 ISSR amplification results of red clover
注:M为Marker,1~10与表1的序号一致
3 讨论
ISSR结合了RAPD和SSR的优点,重复性好、稳定性高、快速灵敏,但是扩增条件和扩增程序变化及物种不同会对ISSR扩增图谱产生较大的影响[27],尤其是体系中TaqDNA聚合酶,Mg2+,dNTP及引物浓度相互影响,这与文献[15]所研究的内容一致。因此,为了获得重复性好、可靠性高的ISSR谱带,保证试验结果的准确性并找到合适红三叶的最佳反应程序,同时兼顾节约成本和缩短试验周期,对红三叶进行引物的筛选、ISSR-PCR反应体系的优化及退火温度和循环次数的确定十分必要。考虑各因素之间的相互作用,采用正交设计方法确定了红三叶ISSR-PCR的最佳反应体系,并对结果的可靠性和稳定性进行了验证。与以往的单因素PCR优化设计相比,正交设计试验兼顾各因素间的交互作用,省时省力,能够较快地获得最优的水平组合[24],避免了单因素试验顾此失彼、试验规模大的不足[28]。
在ISSR-PCR反应体系中,影响PCR扩增反应的各种因素(TaqDNA聚合酶、Mg2+、dNTP和引物等)同样影响ISSR-PCR的扩增效果。TaqDNA聚合酶的种类以及用量直接影响扩增反应成功与否。不同厂家或不同批次的酶活性有一定的差异,选择同一厂家同一批次的酶,可保证在试验过程中试验结果的稳定性。找出适合试验的用量,以2.5 U/25.0 μL为最佳用量。Mg2+浓度是影响ISSR-PCR结果的一个重要因素。游离Mg2+是激活TaqDNA聚合酶的必要因子,Mg2+浓度过低对酶的活化作用不够,过高易螯合dNTPs,使dNTPs消耗殆尽,无延伸反应,造成扩增失败。此外,Mg2+还影响引物与模板的结合,从而导致PCR结果的改变[29]。试验优化的Mg2+浓度为2.5 mmol/L。dNTPs是ISSR-PCR反应的基本原料,dNTPs浓度过高,会导致PCR错配,从而出现非特异性扩增;过高会导致扩增不完全,条带少,产物弱。根据试验结果可知,最为理想的dNTP浓度是0.2 mmol/L。引物是PCR特异性反应的关键,引物浓度要适量,浓度过低时扩增产物少、条带弱,过高会出现非特异性条带。结果表明,在25 μL的反应体系中,引物浓度为1 μmol/L时扩增效果最好。虽然模板DNA浓度是ISSR-PCR反应体系的影响因素之一,但ISSR-PCR反应对DNA模板浓度的要求范围较宽,相关试验[30]也证明了模板浓度对PCR扩增结果影响不敏感。因此,未对模板DNA的浓度进行梯度试验,直接采用模板DNA的浓度为40 ng/μL,取得了较为理想的结果。
PCR反应中,退火温度和循环次数对扩增结果都有一定的影响。退火温度的高低直接影响引物与模板的特异性结合。退火温度较低时虽然能保证模板与引物稳定结合,但也会产生错误扩增[31]。退火温度过高时,引物与模板结合差,PCR产物少。由于不同的引物有其适宜的退火温度,若选用不同的引物还需通过试验进行优化[26]。因此,对筛选出的5条引物逐个进行退火温度梯度试验,确定每个引物的最适退火温度。该试验所用引物UBC841和UBC851的最适退火温度分别为50.7 ℃和54.9 ℃。循环次数直接影响到PCR反应产量的多少。从理论原则上,循环次数与扩增产物量成正比关系,但实际上循环次数过多会增加非特异扩增产物的数量和复杂性,从而导致条带弥散、带间模糊[32]。采用35个循环就能达到良好的扩增效果,在一定程度上节约了试验时间。
4 结论
对ISSR反应影响较大的4个因素进行了优化,建立了红三叶ISSR-PCR的最优反应体系。在25 μL体系中,包含40 ng模板DNA,10×PCR-buffer 2.5 μL,2.5 mmol/L Mg2+,2.5 UTaqDNA聚合酶,引物1 μmol/L,0.2 mmol/L dNTP。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,引物退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min,4 ℃保存。
[1] 王建丽,申忠宝,潘多锋,等.红三叶种质资源农艺性状的综合评价及聚类分析[J].草原与草坪,2013(2):33-37.
[2] 刘宁芳,徐庆国,杨知建,等.不同三叶草品种的农艺性状与营养特性比较[J].Crop research,2007(2):128-130.
[3] 贾慎修.中国饲用植物志[M].北京:农业出版社,1987:332-337.
[4] Sharmas T R,Singh R K,Chahota R,etal,Analysis of genetic diversity in white clover (TrifoliumrepensL.) accessions using agro-morphological and RAPD markers[J].Journal of Genetics & Breeding,2005,59:3-4.
[5] 张贤,张英俊,吴维群.白三叶RAPD分析条件优化[J].草地学报,2006,14(3):219-222.
[6] 张婧源,彭燕,罗燕,等.不同产地白三叶种质遗传多样性的SRAP分析[J].草地学报,2010,19(5):130-138.
[7] George J,Dobrowolski M P,Van-Zijll-de-Jong E,etal.Assessment of genetic diversity in cultivars of white clover (TrifoliumrepensL.) detected by SSR polymorphisms[J].Genome,2006,49:8.
[8] 杜诗平,段友海.红三叶栽培技术[J].湘西科技,2003(4):5-6.
[9] 孔令慧,赵桂琴.红三叶株型结构与草产量的相关性研究[J].草原与草坪,2013,33(3):11-15.
[10] 赵娜,赵桂琴,胡凯军.不同生长年限红三叶生产性能与营养价值比较[J].草地学报,2011,19(3):468-472.
[11] 赵桂琴,KallaR.AMV和WCMV在转基因红三叶中的基因累集[J].草业学报,2003,12(2):106-111.
[12] 赵娜,赵桂琴,刘欢.基因型对红三叶异黄酮含量的影响[J].草原与草坪,2011(1):66-69.
[13] Zietkiewicz E,Rafalski A,Labudad.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[14] 刘海龙,马锦林.11份山茶属植物亲缘关系的ISSR分析[J].经济林研究,2012,30(4):87-90.
[15] 刘美,赵桂琴,刘欢,等.早熟禾ISSR反应体系的优化[J].中国草地学报,2009,31(5):107-111.
[16] 赵桂琴,刘欢,刘美.ISSR标记的早熟禾遗传多样性分析[J].草地学报,2011,19(5):781-786.
[17] 肖海峻,徐 柱.利用ISSR标记研究鹅观草属种质资源的遗传多样性[J].华北农学报,2007,22(4):146-150.
[18] 刘欢,慕 平,赵桂琴,等.燕麦ISSR反应体系的建立与优化[J].中国草地学报,2010,32(4):80-85.
[19] 李永祥,李斯深,李立会,等.披碱草属12个物种遗传多样性的ISSR和SSR比较分析[J].中国农业科学,2005,38(8):1522-1527.
[20] 魏臻武.利用SSR,ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱[J].草业学报,2004,13(3):62-67.
[21] 刘美华,李忠超,陈海山,等.昆仑锦鸡儿的遗传多样性研究[J].广西植物,2005,25(1):53-57.
[22] 卢萍,赵萌莉,韩国栋,等.内蒙古小花棘豆遗传多样性的ISSR分析[J].西北植物学报,2007,27(6):1102-1107.
[23] 王照兰,杨持,赵丽丽,等.扁蓿豆不同品系ISSR标记遗传差异和遗传多样性[J].中国草地学报,2010,32(1):11-17.
[24] 盖钧镒.试验统计方法[M].北京:中国农业出版社,2000.
[25] Doyle J J,Doyle J L.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[26] 曾兵,张新全,兰英.鸭茅种质遗传多样性的ISSR研究[J].遗传,2006,28:1093-1100.
[27] Joshi S P,Gupta V S,Aggarwal R K,etal.Genetic diversity and phylogenetic relationship as revealed by inter simple sequence repeat(ISSR) polymorphism in the genus Oryza[J].Theor Appl Genet,2000,100:1311-1320.
[28] 王家保,刘志媛,徐碧玉,等.用正交设计优化荔枝RAPD反应体系[J].武汉植物学研究,2005,23 (4):363-368.
[29] 郭丁丁,马逾英,唐琳,等.白芷ISSR-PCR反应体系的建立和优化[J].成都中医药大学学报,2008,31(2):45-48.
[30] 李璇,王晓东.AFLP的研究[J].甘肃教育学院学报(自然科学版),2004,18(1):58-61.
[31] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[32] 张志红,谈月笑,何航航,等.红树植物海漆ISSR条件的优化[J].中山大学学报,2004,43(2):63-66.
Establishment and optimization of ISSR-PCR amplification system for red clover
MENG Li-juan1,ZHAO Gui-qin1
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
With a orthogonal design,the paper studied four main factors(TaqDNA polymerase,Mg2+,premier and dNTP)at four level that infulence ISSR-PCR amplification system for red clover and finally established an optimal reaction system.In the amplification system with 25 μL solution,the appropriate containing of reactants were 40 ng template DNA,10×PCR-buffer 2.5 μL,2.5 mmol/L Mg2+,2.5 UTaqDNA polymerase,1 μmol/L premier and 0.2 mmol/L dNTP.The optimized reaction program was 94 ℃ for 5min,followed by 35 cycles of 94 ℃ for 30 s,annealing 30 s,1 min at 72 ℃ and a final extension at 72 ℃ for 7 min,then preservation at 4 ℃.The establishment of the optimized amplification system provides a technical references for the analysis of genetic diversity of red clover with ISSR markers.
red clover;ISSR-PCR;orthogonal optimization
2014-10-15;
2015-03-23
农业部牧草种质资源保护项目(2013014)和甘肃高校基本科研业务费项目(2012009)资助
孟丽娟(1990-),女,甘肃镇原人,在读硕士。 E-mail:menglijuan01180026@163.com 赵桂琴为通讯作者。
S 541;Q 75
A
1009-5500(2015)02-0021-06

