中东呼吸综合征冠状病毒的实验室检测技术
王蔚,田棣,胡芸文,2
1. 上海市(复旦大学附属)公共卫生临床中心病原体检测与生物安全部,上海 201508;2. 复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032

中东呼吸综合征冠状病毒的实验室检测技术
王蔚1,田棣1,胡芸文1,2
1. 上海市(复旦大学附属)公共卫生临床中心病原体检测与生物安全部,上海 201508;2. 复旦大学基础医学院病原生物学系,教育部/卫生部医学分子病毒学重点实验室,上海 200032
摘要:中东呼吸综合征(MERS)是一种由中东呼吸综合征冠状病毒(MERS-CoV)感染所致的急性呼吸道传染病,其临床诊断需依据实验室病原学检测结果。本文就MERS-CoV的核酸检测、抗原和抗体检测、病毒分离鉴定及基因变异监测等方面的最新研究进展作一综述。
关键词:中东呼吸综合征冠状病毒;实验室诊断;反转录-聚合酶链反应
中东呼吸综合征(Middle East respiratory syndrome,MERS)是一种由中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)感染所致的急性呼吸道传染病。MERS-CoV是继严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)后一种新发现的传播力强、病死率高、可感染人的冠状病毒。该病毒是有包膜的单股正链RNA病毒,基因组全长约30 kb,基因组结构与其他已知的人类冠状病毒相似,至少含有10个开放读码框架(open reading frame,ORF),编码病毒的多种结构蛋白和非结构蛋白[1]。从遗传进化上看,MERS-CoV属于乙型冠状病毒属 C组成员,病毒溯源分析提示其可能来源于蝙蝠或中东沙漠地区的单峰骆驼[2]。人因接触感染了MERS-CoV的动物而被感染,已有证据表明该病毒在人与人之间可通过密切接触而传播。
与其他常见呼吸道病原所致肺部感染相比,MERS-CoV感染的临床表现没有特征性差异,因此MERS确诊病例的诊断需依据实验室病原学检测结果。MERS-CoV的实验室检测包括病毒核酸检测、抗原和抗体检测及作为病毒感染诊断“金标准”的病毒分离鉴定。其中,反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)因检测病毒核酸具有周期短、易标准化等优势而广泛应用于MERS的病原学诊断工作。世界卫生组织(World Health Organization,WHO)于2012年12月首次推荐MERS-CoV的实验室诊断标准流程,以指导临床标本的初筛和确认实验。随着人们对该病毒的深入研究和逐步了解,WHO又分别于2013年9月和2014年9月更新了指南内容。以下就MERS-CoV实验室检测方法及流程进行简要综述。
1标本采集
用于MERS-CoV检测的标本来自患者呼吸道、血液、尿液、粪便等。MERS-CoV的受体二肽基肽酶4(dipeptidyl peptidase 4,DPP4;又称CD26)在呼吸道中主要分布于下呼吸道[3],因此痰液、支气管肺泡灌洗液、气管抽吸物等下呼吸道标本中含有高滴度MERS-CoV,是理想的标本类型[4]。然而,在病程初期最易获得的是鼻咽抽吸物或咽拭子,因此这些上呼吸道标本仍为临床主要送检标本类型。WHO建议,在条件允许的情况下,应同时采集患者的上下呼吸道标本,并在采集鼻咽拭子和咽拭子时使用专用的带有病毒转运液的拭子(http://www.who.int/csr/disease/coronavirus_infections/WHO_ interim_recommendations_ lab_detection_ MERSCoV_092014.pdf)。
除肺组织外,DPP4还广泛分布于人体的肾、小肠、肝、前列腺等多种组织器官的上皮和内皮细胞,以及树突细胞、单核-巨噬细胞和T细胞等免疫细胞。这一分布特征导致MERS-CoV感染可累及体内多种脏器,也造成其在呼吸道外的多途径排毒[5]。有研究表明,部分患者的血液标本可通过PCR检测到病毒核酸,在尿和粪便标本中也可检测到病毒存在。尽管上述肺外标本中的病毒载量比呼吸道标本低,但临床如能采集送检可进一步提高病毒的检出率,有利于尽快诊断。
同一病例在多个时间点采样送检对诊断、治疗和疫情控制均有意义。初次采集的上呼吸道标本中MERS-CoV检测如为阴性,有必要进行重复采样送检。有研究认为,MERS-CoV与SARS-CoV相似[6],鼻咽拭子标本中病毒载量高峰可能出现在症状出现后的第2周而非发病初期。对于已确诊的病例,有研究发现重症患者排毒时间往往比轻症患者长,而危重症患者呼吸道及血液的排毒时间可超过3周[7]。因此,在患者隔离治疗过程中,需每2~4 d采集1次上、下呼吸道标本及其他类型标本(如血液、尿液、粪便等)进行病毒核酸的PCR检测。这样,一方面可观察治疗效果,另一方面可跟踪呼吸道排毒和肺外排毒时间,便于医务人员采取相应的感染控制措施。对于恢复期的病例,WHO建议每天进行呼吸道标本的采集和PCR检测,连续2次阴性者可考虑解除隔离(http://www.who.int/csr/disease/ coronavirus_infections/WHO_ interim_recommend ations_lab_detection_ MERSCoV_092014.pdf)。
标本采集后,一般情况下应尽快送实验室检测;如暂时无法送检,应根据标本类型进行适当处理后保存于-80 ℃,避免反复冻融。如在采样环节中存在产生气溶胶的风险,医务人员需在标准防护的基础上增加N95口罩、眼罩、长袖防护服等个人防护装备。
2MERS-CoV的核酸分子检测
自2012年确认首例人感染MERS-CoV病例至2015年6月,全球已有MERS病例1 185例(http://www.who.int/csr/don/05-june-2015-mers-korea/en/)。因此,建立特异、有效的快速分子诊断方法对早期发现和防控疫情十分重要。
WHO推荐将MERS-CoV包被蛋白(envelop protein,E蛋白)基因的5′端上游序列(upstream of envelop gene,UpE)作为初筛检测靶标,ORF1a/1b作为进一步确诊检测靶标。如果患者双靶标检测阳性,则为确诊病例;如果患者初筛靶标阳性但第二靶标检测阴性,则需检测其他基因,包括核衣壳蛋白(nucleocapsid protein,N蛋白)、RNA依赖的RNA聚合酶(RNA-dependant RNA polymerase,RdRp)和刺突蛋白(spike protein,S蛋白)基因,且通过扩增产物测序确定;如果患者临床症状和流行病学史高度符合但仅初筛阳性,缺少其他基因检测结果,则作为疑似病例。所有确诊或疑似病例均需连续采集2次以上标本检测,排除假阳性或假阴性。值得注意的是,对于上呼吸道标本检测阴性而临床及流行病学史高度符合的患者,应积极采集下呼吸道标本送检,降低假阴性(http://www.who.int/csr/disease/coronavirus_infections/WHO_interim_recommendations_lab_detection_MERSCoV_092014.pdf)。
目前,多个研究小组建立了MERS-CoV快速分子检测方法,针对不同基因靶标,分别采用实时RT-PCR、反转录环介导等温扩增(reverse transcription-loop-mediated isothermal amplification,RT-LAMP)或反转录等温重组酶聚合酶扩增(reverse transcription-isothermal recombinase-polymerase amplification,RT-RPA)等技术。适用这些方法检测的样本包括上下呼吸道、粪便和血清样本(表1)。其中,Corman等建立了针对UpE和ORF1b靶标的实时RT-PCR,最低检出限达3.4 RNA拷贝/反应,是目前最广泛采用的MERS-CoV初筛方案[8]。在以N基因作为靶标的检测方法中,实时RT-PCR或RT-RPA的最低检出限为≤10 RNA拷贝/反应[9,10];RT-LAMP的最低检出限达3.4 RNA拷贝/反应[11]。以UpE和ORF1a为靶标,采用实时RT-PCR的最低检出限分别为5.3和9.3 RNA拷贝/反应[12]。这些检测均可作为MERS-CoV的实验室初筛和确诊方法。
表1MERS-CoV的核酸检测方法
Tab.1Nucleic acid amplification tests for laboratory diagnosis of MERS-CoV
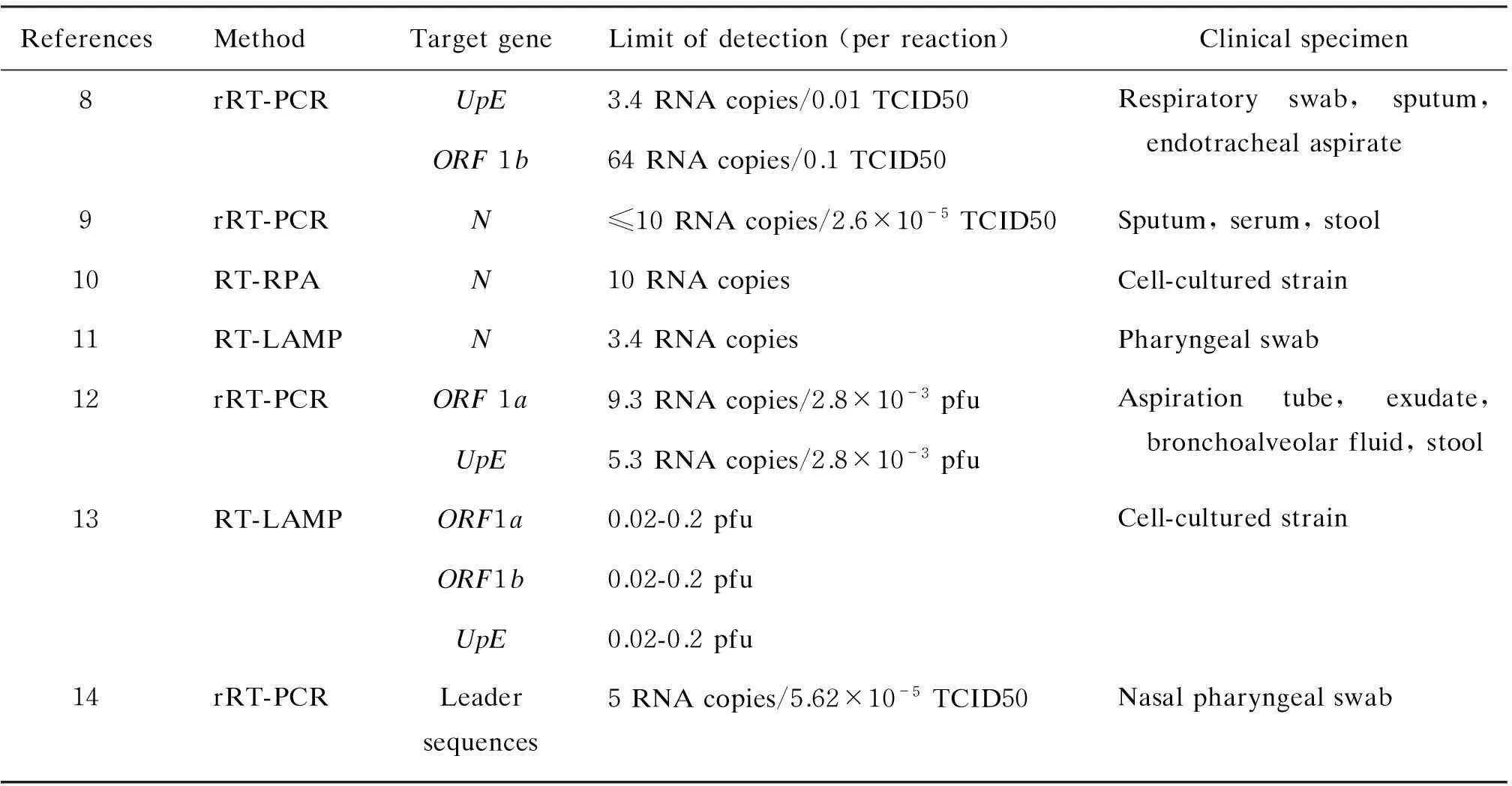
ReferencesMethodTargetgeneLimitofdetection(perreaction)Clinicalspecimen8rRT-PCRUpE3.4RNAcopies/0.01TCID50ORF1b64RNAcopies/0.1TCID50Respiratoryswab,sputum,endotrachealaspirate9rRT-PCRN≤10RNAcopies/2.6×10-5TCID50Sputum,serum,stool10RT-RPAN10RNAcopiesCell-culturedstrain11RT-LAMPN3.4RNAcopiesPharyngealswab12rRT-PCRORF1a9.3RNAcopies/2.8×10-3pfuUpE5.3RNAcopies/2.8×10-3pfuAspirationtube,exudate,bronchoalveolarfluid,stool13RT-LAMPORF1a0.02-0.2pfuORF1b0.02-0.2pfuUpE0.02-0.2pfuCell-culturedstrain14rRT-PCRLeadersequences5RNAcopies/5.62×10-5TCID50Nasalpharyngealswab
与传统实时 RT-PCR相比,RT-LAMP和RT-RPA等新技术对仪器设备要求较低,样本交叉污染小,更适用于缺乏完善实验室条件下的现场快速筛查。Bhadra等针对UpE、ORF1b和ORF1a基因建立RT-LAMP检测方法,最低检出下限达0.02~0.2 pfu/反应,但其检测灵敏度未经过临床标本验证[13]。
此外,香港大学袁国勇研究小组建立针对冠状病毒各亚型特异性前导序列(leading sequence)的RT-PCR,可一次鉴定5种冠状病毒亚型:MERS、229E、OC43、HKU1和NL63病毒(表1),最低检出限达5 RNA拷贝/反应,临床诊断应用前景较广[14]。
3MERS-CoV的抗原检测
MERS-CoV的抗原检测主要应用于确认动物组织中的病毒感染,也用于验证病毒培养过程中阳性病变细胞内的病毒复制。近期,Song等[15]建立了一种快速的胶体金免疫层析法(immuno-chromatographic assay,ICA),用于检测单峰骆驼鼻咽拭子中的MERS-CoV抗原。该方法利用高选择性的单克隆抗体,可在室温条件下短时间内快速检测到病毒的N蛋白。以针对UpE和ORF1a的实时RT-PCR检测结果为参考,ICA的相对灵敏度和特异度分别为93.9%和100%。然而,临床标本中抗原检测的合适时机尚不清楚,需进一步对MERS病例的中和抗体动态曲线及标本排毒规律进行充分了解。
4MERS-CoV的抗体检测
过去几年中,研究者已建立了一些用于检测MERS-CoV中和性抗体或非中和性抗体的方法,但尚需在临床大规模验证。这些方法包括间接免疫荧光试验(immunofluorescence assay,IFA)、基于重组蛋白表达的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、蛋白芯片技术(protein microarray)及假病毒中和抗体测试(pseudoparticle neutralization test,ppNT)。
Corman等[16]发现1例患者具有MERS-CoV感染的临床症状,利用RT-PCR不能在呼吸道分泌物中检出病毒,而IFA可在血清中检出抗体。因此,初步检测时,可利用IFA测试血清中所含的抗体。需注意的是,检测可能会出现假阳性,因此建议该方法用于有明确流行病学特点的患者,且只能作为初筛而不能用于确诊。
Al-Abdallat等[17]通过HKU5.2 N蛋白ELISA、IFA和微量中和实验(micro-neutralisation test,MNT)检测血清抗体。基因序列分析显示,蝙蝠冠状病毒HKU4和HKU5与MERS-CoV类似,因此美国疾病预防控制中心(Centers for Disease Control and Prevention,CDC)开发了基于重组HKU5.2 N蛋白的ELISA,检测MERS疑似病例血清中是否存在交叉反应抗体;检测到交叉反应后,再利用IFA和MNT检测MERS-CoV特异抗体。
Perera等[18]构建了MERS-CoV S蛋白假病毒颗粒用于ppNT,与传统的MNT一起对1 343份人血清和625份动物血清进行检测。单峰骆驼血清中,MNT检测到93.6%的血清对MERS-CoV有抗体反应,ppNT检测到98.2%的血清对MERS-CoV有抗体反应。MNT检测抗体效价≥1 280,ppNT检测抗体效价≥10 240。ppNT与MNT检测结果有很好的相关性。这种新的中和抗体检测方法不需在生物安全三级实验室中进行,同时避免了中和试验中操作MERS-CoV活病毒带来的生物安全隐患。
Reusken等[19]将蛋白芯片技术应用于MERS-CoV和SARS-CoV的IgM和IgG抗体检测。以MERS-CoV和SARS-CoV S1蛋白受体结合单元作为抗原,被来自4种常见人冠状病毒(human coronavirus,hCoV)暴露人群的交叉反应血清及hCoV-EMC或SARS-CoV恢复期患者的血清所验证。这种方法允许最小样品要求的高通量检测,并可使用干燥血点进行测试,易于样品运输。
然而,因MERS-CoV抗体与其他人感染冠状病毒存在交叉反应,在缺乏病毒核酸检测结果的情况下,基于上述方法的单次抗体检测结果均不能作为病例确诊的依据,必须通过检测同一病例的急性期和恢复期的双份血清来确定。因此,MERS-CoV的抗体检测主要用于临床流行病学调查和人群感染的回顾性研究。
5MERS-CoV的分离培养
病毒分离培养仍是鉴定特定病原体感染的“金标准”。MERS-CoV具有宿主细胞的广嗜性,可在体外感染多种人源或非人源细胞系,且在敏感细胞中复制速度较快,以合胞体形成为主要的细胞病变效应。目前,基因工程改造可进一步提高细胞系对MERS-CoV的敏感度,为病毒研究、疫苗和药物的研发等工作带来了方便。
Zaki等[20]利用Vero和LLC-MK2细胞系培养MERS-CoV,接种5 d内可引起一系列细胞病理改变。在低pH值时LLC-MK2细胞形成合胞体,在中性或碱性pH值时Vero和LLC-MK2细胞均出现细胞变圆及分离。Shirato等[21]利用稳定表达跨膜丝氨酸蛋白酶2(transmembrane serine protease 2,TMPRSS2)的Vero细胞(Vero-TMPRSS2)培养MERS-CoV,接种3 h发生细胞融合,18 h后即出现合胞体。同时Vero-TMPRSS2细胞对MERS-CoV的敏感度比普通Vero细胞高100倍。
Chan等[22]研究MERS-CoV的细胞敏感性,发现与其他hCoV相比,其可在更加广泛的细胞系中快速生长,如支气管上皮细胞系Calu-3、胚胎成纤维细胞系HFL、肺腺癌细胞系A549、胚胎肾细胞系HEK、结直肠细胞腺癌细胞系Caco-2、肝癌细胞系Huh-7和细胞恶性组织细胞瘤细胞系His-1。在这些感染细胞中均能观察到明显的细胞病变,免疫染色可检测到N蛋白表达,或在上清液中检测到病毒复制,病毒载量可增加1~5倍。
此外,在单核细胞及T细胞系THP-1、U937和H9中,虽可检测到病毒载量增加,但复制效率较低,且无核蛋白表达和细胞病变效应。Tao等[23]在Jurkat T细胞内稳定转染CD26/DPP4编码质粒,获得的Jurkat_CD26/DPP4细胞对MERS-CoV敏感,在感染病毒1或2 d后,80%~88%细胞死亡。
由于病毒培养所需周期较长,且需在生物安全三级实验室中进行,该法在MERS-CoV临床诊断中应用受限。
6MERS-CoV的基因变异监测
研究MERS-CoV基因变异情况,不仅有助于追溯病毒传播流行途径,还可实时监测病毒对人体的适应性变异,对疾病防控和治疗有重要意义。
目前,GenBank已发表的MERS-CoV全长基因组核苷酸序列相似性>99%[24],根据进化亲缘关系分为4个簇(cluster):A、B1、B2和C。然而,这一基因进化监测需基于全长基因序列的分析,费时费力。MERS-CoV全长基因组有4个高变区,分别在ORF1a、S和ORF4a基因区域[13]。Koopmans研究小组根据长度为615 bp的S基因高变区序列,对MERS-CoV分型,结果与采用全长基因组序列的分型方法一致[25]。与全长基因组分析相比,该方法简便,便于疫情暴发时当地实验室对MERS-CoV变异情况进行密切监测。
7结语
MERS病例的早发现和早治疗对MERS疫情的防控至关重要,采用规范的诊断流程和快速、敏感的检测方法是及时发现病例、控制疫情的关键。MERS-CoV的病原学诊断方法包括分子检测方法、血清学方法及病毒分离培养等,各有优势和适用时机。对于特定病例和特定目的,需选择合适的采样时间、样本种类、检测手段,并结合流行病学史和临床症状等对检测结果进行准确判断和合理解释。值得注意的是,随着MERS-CoV在世界范围内的传播,病毒可能加快变异。因此,在常规病原学诊断时,需多靶标确认,并对病毒主要抗原蛋白的基因进行测序,必要时进行全长基因组测序,以降低漏检率。同时,通过测序还可跟踪监测病毒变异情况,为防控工作提供重要数据。
参考文献
[1]van Boheemen S, de Graaf M, Lauber C, Bestebroer TM, Raj VS, Zaki AM, Osterhaus AD, Haagmans BL, Gorbalenya AE, Snijder EJ, Fouchier RA. Genomic characterization of a newly discovered coronavirus associated with acute respiratory distress syndrome in humans [J]. MBio, 2012.http://mbio.asm.org/content/3/6/e00473-12.
[2]Azhar EI, El-Kafrawy SA, Farraj SA, Hassan AM, Al-Saeed MS, Hashem AM, Madani TA. Evidence for camel-to-human transmission of MERS coronavirus [J]. N Engl J Med, 2014, 370(26): 2499-2505.
[3]Raj VS, Mou HH, Smits SL, Dekkers DH, Mueller MA, Dijkman R, Muth DA, Zaki A, Fouchier RA, Thiel V, Drosten C, Rottier PJ, Osterhaus AD, Bosch BJ, Haagmans BL. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC [J]. Nature, 2013, 495(7440): 251-254.
[4]Memish ZA, Al-Tawfiq JA, Makhdoom HQ, Assiri A, Alhakeem RF, Albarrak A, Alsubaie S, Al-Rabeeah AA, Hajomar WH, Hussain R, Kheyami AM, Almutairi A, Azhar EI, Drosten C, Watson SJ, Kellam P, Cotten M, Zumla A. Respiratory tract samples, viral load, and genome fraction yield in patients with Middle East respiratory syndrome [J]. J Infect Dis, 2014, 210(10): 1590-1594.
[5]Poissy J, Goffard A, Parmentier-Decrucq E, Favory R, Kauv M, Kipnis E, Mathieu D, Guery B; MERS-CoV Biology Group. Kinetics and pattern of viral excretion in biological specimens of two MERS-CoV cases [J]. J Clin Virol, 2014, 61(2): 275-278.
[6]de Sousa R, Reusken C, Koopmans M. MERS coronavirus: data gaps for laboratory preparedness [J]. J Clin Virol, 2014, 59(1): 4-11.
[7]Memish ZA, Assiri AM, Al-Tawfiq JA. Middle East respiratory syndrome coronavirus (MERS-CoV) viral shedding in the respiratory tract: an observational analysis with infection control implications [J]. Int J Infect Dis, 2014, 29: 307-308.
[8]Corman VM, Eckerle I, Bleicker T, Zaki A, Landt O, Eschbach-Bludau M, van Boheemen S, Gopal R, Ballhause M, Bestebroer TM, Muth D, Müller MA, Drexler JF, Zambon M, Osterhaus AD, Fouchier RM, Drosten C. Detection of a novel human coronavirus by real-time reverse-transcription polymerase chain reaction [J]. Euro Surveill, 2012.http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20285.
[9]Lu X, Whitaker B, Sakthivel SK, Kamili S, Rose LE, Lowe L, Mohareb E, Elassal EM, Al-sanouri T, Haddadin A, Erdman DD. Real-time reverse transcription-PCR assay panel for Middle East respiratory syndrome coronavirus [J]. J Clin Microbiol, 2014, 52(1): 67-75.
[10]Abd El Wahed A, Patel P, Heidenreich D, Hufert FT, Weidmann M. Reverse transcription recombinase polymerase amplification assay for the detection of middle East respiratory syndrome coronavirus [J/OL]. PLoS Curr, 2013. http: // www.ncbi.nlm.nih.gov / pmc / articles/ PMC3871419.
[11]Shirato K, Yano T, Senba S, Akachi S, Kobayashi T, Nishinaka T, Notomi T, Matsuyama S. Detection of Middle East respiratory syndrome coronavirus using reverse transcription loop-mediated isothermal amplification (RT-LAMP) [J]. Virol J, 2014, 11: 139.
[12]Corman VM. Ölschläger S,Wendtner CM,Drexler JF,Hess M,Drosten C.Performance and clinical validation of the RealStar MERS-CoV Kit for detection of Middle East respiratory syndrome coronavirus RNA [J]. J Clin Virol, 2014, 60(2): 168-171.
[13]Bhadra S, Jiang YS, Kumar MR, Johnson RF, Hensley LE, Ellington AD. Real-time sequence-validated loop-mediated isothermal amplification assays for detection of Middle East respiratory syndrome coronavirus (MERS-CoV) [J]. PLoS One, 2015, 10(4): e0123126.
[14]Chan JF, Choi GK, Tsang AK, Tee KM, Lam HY, Yip CC, To KK, Cheng VC, Yeung ML, Lau SK, Woo PC, Chan KH, Tang BS, Yuen KY. Development and evaluation of novel real-time RT-PCR assays with locked nucleic acid probes targeting the leader sequences of human pathogenic coronaviruses [J/OL]. J Clin Microbiol, 2015.http://jcm.asm.org/content/early/2015/05/22/JCM.01224-15.long.
[15]Song D, Ha G, Serhan W, Eltahir Y, Yusof M, Hashem F, Elsayed E, Marzoug B, Abdelazim A, Al Muhairi S. Development and validation of a rapid immunochromatographic assay for detection of Middle East respiratory syndrome coronavirus antigen in dromedary camels [J]. J Clin Microbiol, 2015, 53(4): 1178-1182.
[16]Corman VM, Müller MA, Costabel U, Timm J, Binger T, Meyer B, Kreher P, Lattwein E, Eschbach-Bludau M, Nitsche A, Bleicker T, Landt O, Schweiger B, Drexler JF, Osterhaus AD, Haagmans BL, Dittmer U, Bonin F, Wolff T, Drosten C. Assays for laboratory confirmation of novel human coronavirus (hCoV-EMC)infections [J/OL]. Euro Surveill, 2012.http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20334.
[17]Al-Abdallat MM, Payne DC, Alqasrawi S, Rha B, Tohme RA, Abedi GR, Al Nsour M, Iblan I, Jarour N, Farag NH, Haddadin A, Al-Sanouri T, Tamin A, Harcourt JL, Kuhar DT, Swerdlow DL, Erdman DD, Pallansch MA, Haynes LM, Gerber SI; Jordan MERS-CoV Investigation Team. Hospital-associated outbreak of Middle East respiratory syndrome coronavirus:a serologic,epidemiologic,and clinical description [J]. Clin Infect Dis, 2014, 59(9): 1225-1233.
[18]Perera RA, Wang P, Gomaa MR, El-Shesheny R, Kandeil A, Bagato O, Siu LY, Shehata MM, Kayed AS, Moatasim Y, Li M, Poon LL, Guan Y, Webby RJ, Ali MA, Peiris JS, Kayali G. Seroepidemiology for MERS coronavirus using microneutralisation and pseudoparticle virus neutralisation assays reveal a high prevalence of antibody in dromedary camels in Egypt, June 2013 [J/OL]. Euro Surveill, 2013.http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20574.
[19]Reusken C, Mou H, Godeke GJ, van der Hoek L, Meyer B, Müller MA, Haagmans B, de Sousa R, Schuurman N, Dittmer U, Rottier P, Osterhaus A, Drosten C, Bosch BJ, Koopmans M. Specific serology for emerging human coronaviruses by protein microarray [J/OL]. Euro Surveill, 2013.http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20441.
[20]Zaki AM, van Boheemen S, Bestebroer TM, Fouchier RA. Isolation of a novel coronavirus from a man with pnfeumonia in Saudi Arabia [J]. N Engl J Med, 2012, 367(19): 1814-1820.
[21]Shirato K, Kawase M, Matsuyama S. Middle East respiratory syndrome coronavirus infection mediated by the transmembrane serine protease TMPRSS2 [J]. J Virol, 2013, 87(23): 12552-12561.
[22]Chan JF, Chan KH, Choi GK, To KK, Tse H, Cai JP, Yeung ML, Cheng VC, Chen H, Che XY, Lau SK, Woo PC, Yuen KY. Differential cell line susceptibility to the emerging novel human betacoronavirus 2c EMC/2012: implications for disease pathogenesis and clinical manifestation [J]. J Infect Dis, 2013, 207(11): 1743-1752.
[23]Tao X, Hill TE, Morimoto C, Peters CJ, Ksiazek TG, Tseng CT. Bilateral entry and release of Middle East respiratory syndrome coronavirus induces profound apoptosis of human bronchial epithelial cells [J]. J Virol, 2013, 87(17): 9953-9958.
[24]Al-Tawfiq JA, Memish ZA. Middle East respiratory syndrome coronavirus: transmission and phylogenetic evolution [J]. Trends Microbiol, 2014, 22(10): 573-579.
[25]Smits SL, Raj VS, Pas SD, Reusken CB, Mohran K, Farag EA, Al-Romaihi HE, AlHajri MM, Haagmans BL, Koopmans MP. Reliable typing of MERS-CoV variants with a small genome fragment [J]. J Clin Virol, 2015, 64: 83-87.
·论著·
Corresponding author. HU Yun-Wen, E-mail: ywhu@shaphc.org
Laboratory detections for Middle East respiratory syndrome coronavirus
WANG Wei1, TIAN Di1, HU Yun-Wen1,2
1. Department of Pathogen Detection and Biological Safety, Shanghai Public Health Clinical Center Affiliated to Fudan University, Shanghai 201508, China; 2. Department of Medical Microbiology and Parasitology, Key Laboratory of Medical Molecular Virology of Ministries of Education and Health, School of Basic Medical Sciences, Fudan University, Shanghai 200032, China
Abstract:Middle East respiratory syndrome (MERS) is an acute respiratory infectious disease caused by Middle East respiratory syndrome coronavirus (MERS-CoV). Its clinical diagnosis is based on pathogen detection in the laboratory. In this review, we summarize the latest research progress on the methodology of nucleic acid detection, serological detection, virus isolation and genetic variation monitoring of MERS-CoV.
Key words:Middle East respiratory syndrome coronavirus; Laboratory diagnosis; Reverse transcriptase-polymerase chain reaction
收稿日期:(2015-07-06)
通信作者:胡芸文
基金项目:国家传染病防治科技重大专项(2014ZX10004-211)

