中医药联合同步放化疗治疗晚期非小细胞肺癌疗效及安全性的Meta分析
汪丛丛,刘洪星,庄 静,刘瑞娟,慈晓华,孙长岗
·医学循证·
中医药联合同步放化疗治疗晚期非小细胞肺癌疗效及安全性的Meta分析
汪丛丛,刘洪星,庄 静,刘瑞娟,慈晓华,孙长岗
目的 系统评价中医药联合同步放化疗治疗晚期非小细胞肺癌(NSCLC)的疗效及安全性。方法 计算机检索PubMed、中国生物医学文献服务系统(CBM)、中国知网数据库、万方数据库、维普中文期刊全文数据库(VIP)、Cochrane等电子数据库,检索时间从建库至2013年12月。手工检索相关杂志、会议论文及未发表的灰色文献等。根据Cochrane系统评价手册5.0,筛选关于中医药联合同步放化疗(试验组)对比单纯放化疗组(对照组)治疗晚期NSCLC的中、英文随机对照试验(RCT),进行纳入文献的资料提取和质量评价,采用RevMan 5.2软件进行Meta分析。比较两组治疗晚期NSCLC的临床客观疗效、生活质量、免疫能力、毒副作用及生存时间。结果 共纳入20个符合标准的RCT,Meta分析结果显示:采用世界卫生组织(WHO)评价标准评价临床客观疗效,试验组有效率高于对照组〔相对危险度(RR)=1.83,95%CI(1.31,2.56),P=0.000 4〕,中药注射类亚组有效率高于对照组〔RR=1.76,95%CI(1.26,3.00),P=0.002〕;采用实体瘤的疗效评价标准(RESIST)评价临床客观疗效,试验组有效率高于对照组〔RR=1.93,95%CI(1.24,3.01),P=0.004〕,中药口服类亚组有效率高于对照组〔RR=1.90,95%CI(1.17,3.09),P=0.010〕;采用体力状况(KPS)评分评价生活质量,试验组KPS评分高于对照组〔RR=3.16,95%CI(2.09,4.77),P<0.000 01〕,中药口服类亚组KPS评分高于对照组〔RR=3.11,95%CI(1.81,5.34),P<0.000 1〕,中药注射类亚组KPS评分高于对照组〔RR=3.23,95%CI(1.71,6.10),P<0.000 1〕;两组CD4+、CD8+、CD4+/CD8+、自然杀伤细胞(NK)所占比例比较,差异均无统计学意义(P>0.05);试验组放射性肺炎〔RR=0.49,95%CI(0.34,0.69),P<0.000 1〕及白细胞计数减少发生率〔RR=0.58,95%CI(0.39,0.87),P=0.009〕较对照组降低。结论 中医药联合同步放化疗治疗晚期NSCLC的RCT研究目前开展较少,仍有很大提升的空间;在应用价值方面,两者联用可增加治疗效果,同时降低毒副作用的发生。
癌,非小细胞肺;中草药;放射疗法;抗肿瘤联合化疗方案;Meta分析
汪丛丛,刘洪星,庄静,等.中医药联合同步放化疗治疗晚期非小细胞肺癌疗效及安全性的Meta分析[J].中国全科医学,2015,18(12):1406-1414.[www.chinagp.net]
Wang CC,Liu HX,Zhuang J,et al.Efficacy and safety of traditional Chinese medicine combined with concurrent chemoradiotherapy in treatment of advanced non-small cell lung cancer:a meta-analysis[J].Chinese General Practice,2015,18(12):1406-1414.
早期非小细胞肺癌(non-small cell lung cancer,NSCLC)大多没有特异性症状,临床确诊时以局部晚期者多见。美国国立综合癌症网络(NCCN)指南推荐该类患者接受同步放化疗,并辅助对症支持治疗以保证治疗方案的顺利实施[1]。同时在中国医学界,中医药作为患者容易接触的治疗手段,其应用价值存有较大争议,支持者认为其可对肿瘤防治起决定性作用,反对使用者认为其价值同于安慰剂[2]。那么,在现代医学针对局限晚期NSCLC推荐的同步放化疗已经取得较高疗效的基础上,合并使用中医药是否进一步使患者获益呢?本研究按照Cochrane系统评价方法,对中医药联合同步放化疗治疗晚期NSCLC进行系统评价,以期为临床应用提供科学依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究对象 选择中英文公开发表、无论是否报告盲法但使用中医辨证论治,或中成药,或中药注射剂联合同步放化疗治疗NSCLC的随机对照试验(受试者为Ⅲ~Ⅳ期、经病理诊断为NSCLC,年龄不限,性别不限,排除合并有小细胞肺癌或其他恶性肿瘤、慢性疾病和不同意加入研究者)。
1.1.2 干预措施 纳入研究需使用中医药联合同步放化疗和同步放化疗两种干预措施作为对照;中医药的范围仅包括中医辩证复方、中成药、中药注射剂,同步放化疗包括普放或者三维适形放疗技术同步进行NP、TP、EP、铂类单药等主流化疗方案。
1.1.3 结局指标 (1)按照世界卫生组织(WHO)评价标准或者实体瘤的疗效评价标准(RESIST)评价临床客观疗效,包含完全缓解(CR)、部分缓解(PR)、疾病稳定(SD),并按照(CR+PR)/总例数的方式计算有效率;(2)采用体力状况(KPS)评分、癌症患者生命质量测定量表(FACT)评价生活质量,其中,KPS评分增加>10分为改善,减少>10分为降低,介于两者之间为稳定;(3)免疫能力和毒副作用,其中毒副作用包括按照急性放射反应评分标准(RTOG)评价或WHO化疗药物毒副作用分度标准评价的放射性肺炎、放射性食管炎、消化道反应、骨髓抑制及其中的白细胞计数减少、贫血和血小板计数减少发生率等;(4)生存时间。
1.2 检索策略 计算机检索PubMed、中国生物医学文献服务系统(CBM)、中国知网、万方数据库、维普中文期刊全文数据库(VIP)、Cochrane等电子数据库,检索时间从建库至2013年12月。手工检索相关杂志、会议论文及未发表的灰色文献等。检索词包括:“非小细胞肺癌”“non-small cell lung carcinoma(NSCLC)”“同步放化疗”“concurrent chemotherapy”“synchronization of radiotherapy”“TCM”“Chinese medicine”“Chinese combined” “中医药”“汤”“丸”“方”“液”“剂”“随机”和“random”。随机对照试验(RCT)检索策略遵循Cochrane系统评价手册5.0,所有检索策略通过多次预检索后确定。
1.3 资料提取 按照设计好的资料提取表,2位研究者独立提取资料,对有分歧的意见通过讨论或由第3位研究者决定是否纳入,缺乏的资料通过电话或信件与作者联系。
1.4 偏倚风险和质量评价控制 由2位研究者分别使用Cochrane Handbook标准评估纳入研究的质量。评估条目包括随机方法、分配隐藏、盲法(单盲、双盲、三盲)、选择性报告、结果完整性、基线一致6个方面。每条标准按照“是”“否”“不清楚”来划分,“是”表示低偏倚风险,“否”表示高偏倚风险,“不清楚”表示偏倚风险不确定。文献等级采用Jadad量表评价。
1.5 统计学方法 采用Cochrane协作网提供的RevMan 5.2统计软件。采用I2检验对纳入文献进行统计学异质性分析,当P≥0.1和I2≤50%时,表示各研究间无统计学异质性,采用固定效应模型;若P<0.1和I2>50%,表示各研究间存在统计学异质性,则对异质性来源进行分析,通过亚组及敏感性分析等处理减小异质性后,再采用固定效应模型进行Meta分析,若异质性仍较大,则采用随机效应模型。计数资料选择相对危险度(RR)作为效应尺度指标,连续变量选用标准化均数差(SMD)作为统计效应量,同时计算95%可信区间(CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 检索结果和纳入文献的一般特征 共检索到528篇文献,初筛后剩余30篇文献,提取资料排除不符合纳入标准的文献,最终纳入20篇RCT[3-22],患者共计1 293例,其中,中医药联合同步放化疗组(试验组)651例,同步放化疗组(对照组)642例。文献筛选流程图见图1,纳入文献的基本特征见表1。

图1 文献筛选流程图
2.2 纳入文献的偏倚风险评估 纳入文献均提及随机分配,但仅5篇文献[5,7-8,16,21]描述了随机分配按随机数字表法生成,2篇文献[3,12]描述分配方案采用抽签法分配,2篇文献[4,19]描述分配方案采用信封法分配;关于盲法,1篇文献[19]采用单盲;其余文献对随机分配方法、分配隐藏方案及是否采用盲法未予以描述。所有文献无明显设计方案有误,文献等级为B级(见表2)。
2.3 Meta分析结果
2.3.1 临床客观疗效评价
2.3.1.1 WHO评价标准 12篇文献[5-6,9-15,18,21-22]采用WHO评价标准评价临床客观疗效,各研究间无统计学异质性(P=0.96,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异有统计学意义〔RR=1.83,95%CI(1.31,2.56),P=0.000 4〕。根据中药给药途径分为中药口服类亚组和中药注射类亚组。中药口服类亚组各研究间无统计学异质性(P=0.95,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异无统计学意义〔RR=1.68,95%CI(0.99,2.84),P=0.05〕;中药注射类亚组各研究间无统计学异质性(P=0.76,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异有统计学意义〔RR=1.76,95%CI(1.26,3.00),P=0.002〕。两亚组间的结论差异无统计学意义(P=0.67,见图2)。
2.3.1.2 RESIST 6篇文献[3,7,16-17,19-20]采用RESIST评价临床客观疗效,各研究间无统计学异质性(P=0.82,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异有统计学意义〔RR=1.93,95%CI(1.24,3.01),P=0.004〕。根据中药给药途径分为中药口服类亚组和中药注射类亚组。中药口服类亚组各研究间无统计学异质性(P=0.63,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异有统计学意义〔RR=1.90,95%CI(1.17,3.09),P=0.010〕;中药注射类亚组各研究间无统计学异质性(P=0.51,I2=0%),采用固定效应模型,Meta分析结果显示,两组有效率比较,差异无统计学意义〔RR=2.09,95%CI(0.70,6.19),P=0.51〕。两亚组间的结论差异无统计学意义(P=0.88,见图3)。

图2 两组采用WHO评价标准评价临床客观疗效的森林图
Figure 2 Forest plot of the comparison of the objective curative effect between two groups using WHO solid tumor′s effect evaluation criterion

表1 纳入文献的基本特征
注:3D-CRT=三维适形放疗

表2 纳入文献的偏倚风险评估

图3 两组采用RESIST评价临床客观疗效的森林图
Figure 3 Forest plot of the comparison of the objective curative effect between two groups using RECIST
2.3.2 生活质量评价
2.3.2.1 KPS评分 9篇文献[6,10-11,13,15,17-18,20,22]采用KPS评分评价生活质量,各研究间无统计学异质性(P=0.76,I2=0%),采用固定效应模型,Meta分析结果显示,两组KPS评分比较,差异有统计学意义〔RR=3.16,95%CI(2.09,4.77),P<0.000 01〕。根据中药给药途径分为中药口服类亚组和中药注射类亚组。中药口服类亚组各研究间存在统计学异质性(P=0.23,I2=30%),采用随机效应模型,Meta分析结果显示,两组KPS评分比较,差异有统计学意义〔RR=3.11,95%CI(1.81,5.34),P<0.000 1〕;中药注射类亚组各研究间无统计学异质性(P=0.95,I2=0%),采用固定效应模型,Meta分析结果显示,两组KPS评分比较,差异有统计学意义〔RR=3.23,95%CI(1.71,6.10),P<0.000 1〕。两亚组间的结论差异无统计学意义(P=0.93,见图4)。
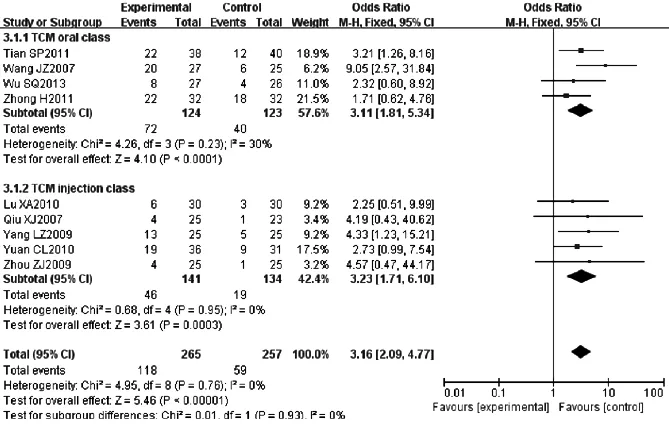
图4 两组采用KPS评分评价生活质量的森林图
Figure 4 Forest plot of the comparison of quality of life between two groups using KPS score
2.3.2.2 FACT-G评分 1篇文献[21]采用FACT-G评分,结果显示,试验组食欲、睡眠、日常活动、精神状态、情绪、与人交往、生活兴趣7个模块优于对照组,差异均有统计学意义(P<0.05)。
2.3.2.3 FACT-L评分 1篇文献[4]采用FACT-L评分,结果显示,治疗开始第3周和结束8周,试验组的总分高于对照组,差异有统计学意义(P<0.05)。治疗前试验组生理状况、功能状况、共性模块、附加关注4个模块均优于对照组,差异有统计学意义(P<0.05);社会家庭状况和情感状况2个模块差异无统计学意义(P>0.05);治疗结束后,试验组功能状况、共性模块2个模块优于对照组,差异有统计意义(P<0.05),其他模块得分与对照组相近,差异无统计学意义(P>0.05)。
2.3.3 免疫能力 2篇文献[8,18]通过流式细胞仪检测外周血中T细胞亚群(CD4+、CD8+)和自然杀伤细胞(NK)所占比例来分析中医药对患者免疫能力的影响。各研究间无统计学异质性(CD4+:P=0.42,I2=0%;CD8+:P=0.20,I2=39%;CD4+/CD8+:P=0.86,I2=0%;NK:P=0.21,I2=36%),采用固定效应模型,Meta分析结果显示,两组CD4+、CD8+、CD4+/CD8+、NK所占比例比较,差异均无统计学意义〔CD4+:SMD=0.11,95%CI(-0.22,0.43),P=0.52;CD8+:SMD=0.20,95%CI(-0.22,0.62),P=0.34;CD4+/CD8+:SMD=0.02,95%CI(-0.30,0.34),P=0.52;NK:SMD=0.07,95%CI(-0.41,0.55),P=0.48〕。文献[8]以治疗结束2周为观察终点,文献[18]以治疗结束4周为观察终点,无法利用合并差值的办法进行连续变量的Meta分析。
2.3.4 毒副作用
2.3.4.1 放射性肺炎 10篇文献[4,6,9-10,13-15,19-20,22]报道放射性肺炎发生率,各研究间无统计学异质性(P=0.93,I2=0%),采用固定效应模型,Meta分析结果显示,两组放射性肺炎发生率比较,差异有统计学意义〔RR=0.49,95%CI(0.34,0.69),P<0.000 1〕。两组1~2度放射性肺炎发生率比较,差异有统计学意义〔RR=0.48,95%CI(0.32,0.73),P=0.000 7〕;两组3~4度放射性肺炎发生率比较,差异有统计学意义〔RR=0.50,95%CI(0.26,0.96),P=0.04,见图5〕。
2.3.4.2 放射性食管炎 9篇文献[6,9-10,13-15,19-20,22]报道放射性食管炎发生率,各研究间存在统计学异质性(P=0.000 1,I2=65%),采用随机效应模型,Meta分析结果显示,两组放射性食管炎发生率比较,差异无统计学意义〔RR=0.61,95%CI(0.36,1.05),P=0.07〕。两组1~2度放射性食管炎发生率比较,差异无统计学意义〔RR=1.12,95%CI(0.48,2.60),P=0.79〕;两组3~4度放射性食管炎发生率比较,差异有统计学意义〔RR=0.30,95%CI(0.18,0.49),P<0.000 01,见图6〕。
2.3.4.3 消化道反应 5篇文献[6,9-10,13,22]报道消化道反应发生率,各研究间存在统计学异质性(P<0.000 1,I2=77%),采用随机效应模型,Meta分析结果显示,两组消化道反应发生率比较,差异无统计学意义〔RR=0.83,95%CI(0.32,2.15),P=0.71〕。两组1~2度消化道反应发生率比较,差异无统计学意义〔RR=2.87,95%CI(0.87,9.42),P=0.08〕;两组3~4度消化道反应发生率比较,差异有统计学意义〔RR=0.23,95%CI(0.12,0.46),P<0.000 1,见图7〕。
2.3.4.4 骨髓抑制 9篇文献[6,9-10,13-14,17-20,22]报道骨髓抑制发生率,各研究间存在统计学异质性(P=0.000 1,I2=66%),采用随机效应模型,Meta分析结果显示,两组骨髓抑制发生率比较,差异无统计学意义〔RR=0.61,95%CI(0.38,1.00),P=0.05〕。两组1~2度骨髓抑制发生率比较,差异无统计学意义〔RR=1.16,95%CI(0.48,2.83),P=0.74〕;两组3~4度骨髓抑制发生率比较,差异有统计学意义〔RR=0.36,95%CI(0.24,0.54),P<0.000 01,见图8〕。
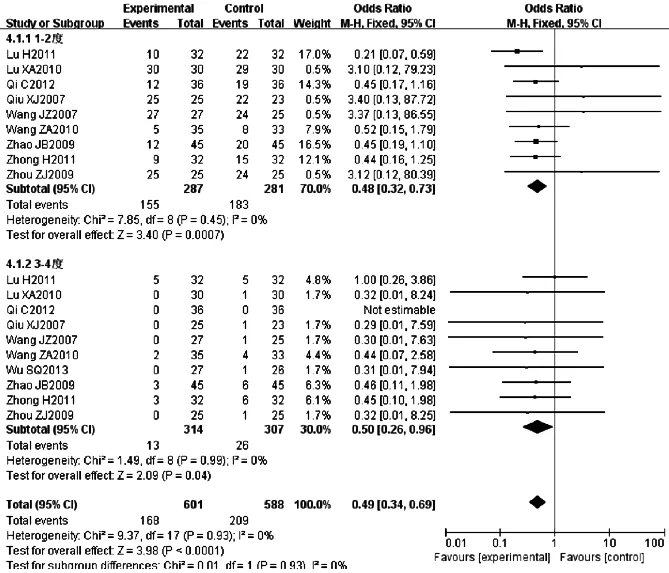
图5 两组放射性肺炎发生率比较的森林图
Figure 5 Forest plot of the comparison of radioactive lung injury incidence between two groups
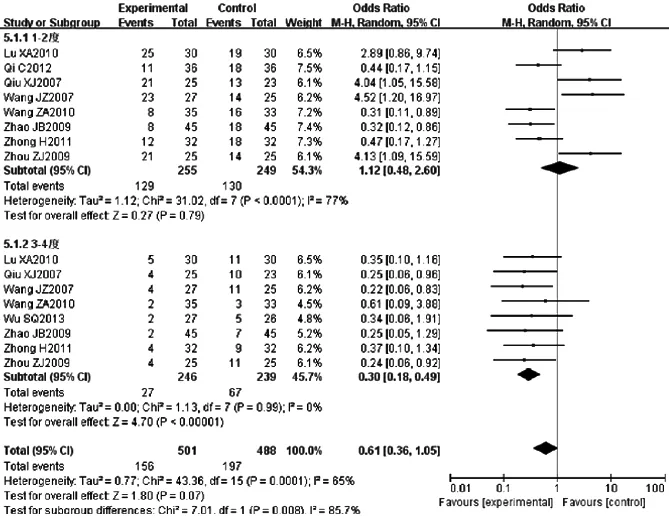
图6 两组放射性食管炎发生率比较的森林图
Figure 6 Forest plot of the comparison of radioactive oesophagitis incidence between two groups
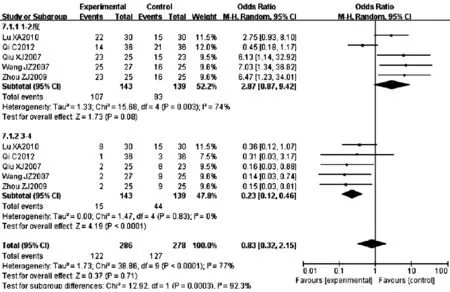
图7 两组消化道反应发生率比较的森林图
Figure 7 Forest plot of the comparison of radioactive gastrointestinal reactions incidence between two groups

图8 两组骨髓抑制发生率比较的森林图
Figure 8 Forest plot of the comparison of bone marrow suppression incidence between two groups
3篇文献[3,15-16]报道了白细胞计数减少发生率,各研究间无统计学异质性(P=0.53,I2=0%),采用固定效应模型,Meta分析结果显示,两组白细胞计数减少发生率比较,差异有统计学意义〔RR=0.58,95%CI(0.39,0.87),P=0.009,见图9〕。
2篇文献[3,16]报道了贫血发生率,各研究间无统计学异质性(P=0.78,I2=0%),采用固定效应模型,Meta分析结果显示,两组贫血发生率比较,差异无统计学意义〔RR=0.70,95%CI(0.24,2.10),P=0.053,见图9〕。
3篇文献[3,15-16]报道了血小板计数减少发生率,各研究间无统计学异质性(P=0.95,I2=0%),采用固定效应模型,Meta分析结果显示,两组血小板计数减少发生率比较,差异无统计学意义〔RR=0.45,95%CI(0.18,1.14),P=0.09,见图9〕。
2.3.5 生存时间 3篇文献[12,14,17]报道了晚期NSCLC患者中位生存时间,试验组和对照组中位生存时间分别为12.6个月和8.6个月(P<0.05)、17个月和15个月(P>0.05)、17.2个月和16.3个月。

图9 两组白细胞计数减少、贫血、血小板计数减少发生率比较的森林图
Figure 9 Forest plot of the comparison of incidence of reduction in white blood cell counts,anemia and reduction in platelet counts between two groups
2.4 异质性检验及敏感性分析 分别对纳入WHO评价标准评价临床客观疗效、RESIST评价临床客观疗效、KPS评分评价生活质量的文献绘制漏斗图(见图10~12)。结果显示,图10中的散点集中分布在无效线的两侧或中轴上,呈不对称散点图,提示根据WHO评价标准评价临床客观疗效纳入的文献可能存在发表偏倚。图11中的散点主要分布在无效线两侧,呈大致对称散点图,提示根据RESIST评价临床客观疗效纳入的文献存在发表偏倚的可能性小。图12中的各点均处于95%CI线之间,呈不对称散点图,提示根据KPS评分评价生活质量纳入的文献存在发表偏倚的可能性大。
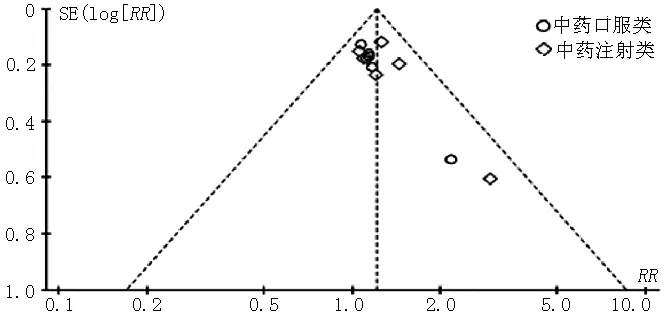
图10 根据WHO评价标准评价临床客观疗效纳入文献的漏斗图
Figure 10 Funnel plot of the included studies:evaluating objective curative effect using WHO solid tumor′s effect evaluation criterion
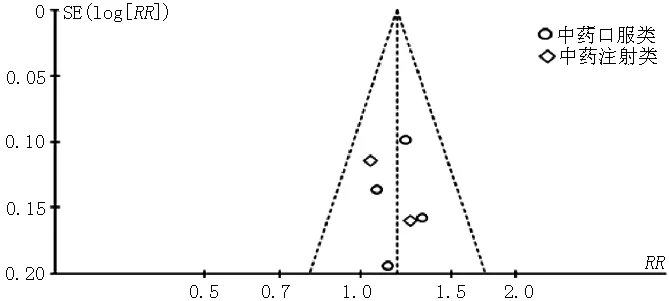
图11 根据RESIST评价临床客观疗效纳入文献的漏斗图
Figure 11 Funnel plot of the included studies:evaluating objective curative effect using RECIST
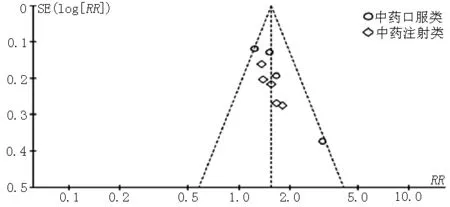
图12 根据KPS评分评价生活质量纳入文献的漏斗图
Figure 12 Funnel plot of the included studies:evaluating quality of life using KPS score
3 讨论
目前国内外肿瘤界认识到肺部肿瘤是一个全身性疾病,把生存质量、生存期作为肿瘤疗效评价的重要标准逐步形成了多学科综合治疗模式[23-24]。传统中医药以其整体防治观念和独有的辨证论治体系,在肺癌特别是中晚期肺癌治疗中显示了一定优势,产生了一些有效的单方和成药,并得到医学界的重视及肯定。严晓玲等[25]研究发现,康莱特联合化疗有效提高了患者的生活质量,降低胃肠道毒副作用,为治疗晚期NSCLC的有效方案;张培彤等[26]中药注射液加辨证论治汤剂联合化疗研究表明,中医治疗在中晚期肺癌患者中反映出抗肿瘤的特色与优势,具有进一步研究的价值。此外,关念波等[27]提出一种中西医学互为补充、相互交融的模式,成为肺癌治疗发展新的方向与趋势。由此可见,中医药联合同步放化疗治疗晚期肺癌作用显著,在肿瘤的治疗过程中杀伤肿瘤细胞,保护机体的免疫功能以及减轻治疗毒副作用具有同等重要的作用。
本文通过 Meta 分析的方法分析中医药联合同步放化疗治疗晚期NSCLC的有效性及安全性,表明其与单纯同步放化疗相比,可提高治疗有效率、提高生活质量、减少放化疗毒副作用等。本研究提示,传统中医药具有辅助治疗、增效减毒等有利于临床的作用,值得临床推广。
本研究纳入的文献存在如下局限性:(1)纳入文献均为国内的研究,可能受地域的影响,如中医药作为传统中医的文化精髓,其世界广泛认可度体系不完善,且存在评价标准未与国际接轨和不够统一、报道的结局指标也有很大的随意性等问题,这可能也是国外开展关于中医药干预研究很少的原因;(2)大部分研究未提及样本量估算的依据,且样本量较小,影响检验效能;(3)纳入文献中仅9篇描述随机方法,无一项实施隐蔽分组,不实施或不充分实施隐蔽分组会导致疗效评价不客观;(4)1篇文献[19]实施单盲,余均未说明盲法的实施,未实施盲法会直接导致实施偏倚和测量偏倚的发生;(5)纳入文献对部分结果采用不同的统计量,致使部分试验不能合并,无法得出统一结论。
综上所述,中医药联合同步放化疗治疗晚期NSCLC,在增强疗效、减轻毒副作用等方面均优于单纯放化疗。但本Meta分析所纳入的文献临床试验质量不高,临床研究方法不完全正确,且样本量较少,所以其临床应用的确切疗效尚需设计严密、实施科学的大样本研究进一步证实。因此,呼吁更多的国内外临床研究者开展规范、标准的RCT进行评价,为中医药在更大的范围发挥作用提供证据。
[1]NCCN.The NCCN non-small lung cancer clinical practice guidelines in oncology(version 1.2013).[2014-05-06].http://www.nccn.org/professionals/physician_gls/f_guidelines.asp.
[2]Zhang YP,Zhang QN,Wang XH.Discussion on the therapeutic effects of traditional Chinese medicine with chemotherapy or radiotherapy on tumors[J].Medicial Recapitulate,2014,20(21):3878-3883.(in Chinese) 张彦平,张秋宁,王小虎.浅谈中药联合放、化疗治疗恶性肿瘤[J].医学综述,2014,20(21):3878-3883.
[3]Cai GQ,Luan JW,Guo RT.Clinical research of Shenfu injection combined with concurrent chemoradiotherapy in treatment of locally advanced stage non-small cell lung cancer[J].Progress in Modern Biomedicine,2009,9(11):2144-2145.(in Chinese) 察格其,栾谨微,郭汝涛.参附注射液加同步放化疗治疗局部晚期非小细胞肺癌的临床研究[J].现代生物医学进展,2009,9(11):2144-2145.
[4]Lu H,Zhou T,She WL.Effects of concurrent chemoradiotherapy of KUSHEN injection plus paclitaxel with IMRT radiotherapy on quality of life in late stage NSCLC patients[J].Journal of Jinan University(Natural Science ﹠ Medicine Edition),2011,32(2):247-252.(in Chinese) 陆红,周涛,佘文莉.苦参注射液联合紫杉醇同步调强放疗对局部晚期非小细胞肺癌患者生活质量的影响[J].暨南大学学报:自然科学与医学版,2011,32(2):247-252.
[5]Luo ZX,Zheng QP,Lu GM,et al.Investigation of the effect of Aidi injection combined with concurrent chemoradiotherapy on locally advanced NSCLC[J].Youjiang Medical Journal,2010,38(6):688-689.(in Chinese) 罗展雄,郑青平,卢冠铭,等.艾迪注射液配合同步放化疗治疗局部晚期肺癌近期疗效观察[J].右江医学,2010,38(6):688-689.
[6]Lu XA.Investigation of the effect of Fufang Kushen Injection combined with chemotherapy and radiotherapy on advanced non-small cell lung cancer[J].Hebei Journal of Traditional Chinese Medicine,2010,32(10):1542-1543.(in Chinese) 陆新岸.复方苦参注射液联合同步放化疗治疗局部晚期非小细胞肺癌30例[J].河北中医,2010,32(10):1542-1543.
[7]Ma DY,Tan BX,Liu M,et al.Huisheng oral liquid combined with NVB based concurrent chemoradiotherapy for unresectable locally advanced NSCLC[J].Acta Academiae Medicinae Militaris Tertiae,2013,35(2):179-181.(in Chinese) 马代远,谭榜宪,柳弥,等.回生口服液联合单药奈达铂同步放化疗治疗不可切除局部晚期非小细胞肺癌[J].第三军医大学报,2013,35(2):179-181.
[8]Meng YL,Li XH,Huang GY,et al.Influence of Shenmai injection to immune function in the treatment of locally advanced non-small cell lung cancer patients with concurrent chemoradiotherapy[J].Chinese Journal of Primary Medicine and Pharmacy,2012,19(23):3531-3532.(in Chinese) 蒙以良,李晓华,黄广优,等.参麦注射液对局部晚期非小细胞肺癌同步放化疗患者免疫功能的影响[J].中国基层医药,2012,19(23):3531-3532.
[9]Qi C,Wang WP,Xing MH.Clinical observation of Shenlian capsule combined with concurrent chemoradiotherapy treating non-small cell lung cancer in intermediate and advanced stage[J].Journal of Liaoning University of TCM,2012,14(4):185-186.(in Chinese) 齐创,王文萍,幸茂晖.参莲胶囊联合同步放化疗治疗中晚期非小细胞肺癌临床观察[J].辽宁中医药大学学报,2012,14(4):185-186.
[10]Qiu XJ,Ma JB,Ji B,et al.Kanglaite injection combined with concurrent chemoradiotherapy in the treatment of locally advanced non-small cell lung cancer[J].Chinese Clinical Oncology,2007,12(2):131-133.(in Chinese) 仇晓军,马剑波,季斌,等.康莱特加同步放化疗治疗局部晚期非小细胞肺癌的临床研究[J].临床肿瘤学杂志,2007,12(2):131-133.
[11]Tian SP,Yuan YJ,Shi SX,et al.Investigation of the effect of Huisheng oral liquid combined with 78 cases of advanced NSCLC[J].Shandong Medical Journal,2011,51(51):117-118.(in Chinese) 田素萍,原艳军,石曙霞,等.回生口服液联合放化疗治疗晚期NSCLC78例效果观察[J].山东医药,2011,51(51):117-118.
[12]Wang HY,Shen J,Chen ZB,et al.The function of Shenyi Capsule in concurrent chemoradiotherapy intreatment of advanced non-small cell lung cancer[J].Chinese Journal of Primary Medicine and Pharmacy,2012,19(5):725-726.(in Chinese) 王海英,沈洁,陈增边,等.参一胶囊在晚期非小细胞肺癌同步放化疗中的作用[J].中国基层医药,2012,19(5):725-726.
[13]Wang JZ,Zhang CC.Clinical study of Kanglaite capsules combined with concurrent chemoradiotherapy intreatment of advanced non-small cell lung cancer[J].Chinese Journal of Cancer Prevention and Treatment,2007,14(19):1502-1503.(in Chinese) 王建中,张长春.康莱特胶丸加同步放化疗治疗局部晚期非小细胞肺癌的临床研究[J].中华肿瘤防治杂志,2007,14(19):1502-1503.
[14]Wang ZA,Xu NH,Feng JK.Clinical observation of patients with advanced non-small cell lung cancertreated by Kanglaite injection combined with concurrent chemo-radiotherapy[J].Journal of Modern Oncology,2010,18(8):1567-1569.(in Chinese) 王正安,徐宁红,奉吉坤.康莱特注射液联合同步放化疗治疗68例中晚期非小细胞肺癌临床观察[J].现代肿瘤医学,2010,18(8):1567-1569.
[15]Wu SQ,Yuan GR,Lin BH,et al.Clinical observation of Qingfei Bawei decoction combined with concurrent chemoradiotherapy in non-small cell lung cancer[J].Chinese Archives of Traditional Chinese Medicine,2013,31(6):1275-1277.(in Chinese) 吴树强,袁国荣,林白桦,等.同步放化疗结合清肺八味汤治疗局部晚期非小细胞肺癌的临床研究[J].中华中医药学刊,2013,31(6):1275-1277.
[16]Yang JX,Zhou M,Bing Y.Huisheng oral liquid combined with single drug nedaplatinchem oradiotherapy in treatment of unresectable locally advancednon-small cell lung cancer[J].China Medicine And Pharmacy,2013,3(9):55-56.(in Chinese) 杨金霞,周宓,邴钰.回生口服液联合单药奈达铂同步放化疗治疗不可切除局部晚期非小细胞肺癌[J].中国学术电子期刊,2013,3(9):55-56.
[17]Yang LZ,Han B,Lyu LY,et al.Clinical observation of kanglaite injection combined with concurrent chemoradiotherapy in advanced non-small cell lung cancer[J].Journal of Clinical Medicine in Practice,2009,13(4):63-64.(in Chinese) 杨丽姝,韩波,吕丽艳,等.康艾注射液联合同步放化疗治疗晚期非小细胞肺癌的临床研究[J].实用临床医药杂志,2009,13(4):63-64.
[18]Yuan CL,Gu KS,Wang ZM,et al.Shenqifuzheng injection combined with concurrent chemoradiotherapy in the treatment of locallyadvanced non-small cell lung cancer[J].Journal of Clinical Medicine in Practice,2010,14(7):37-39.(in Chinese) 袁春銮,顾康生,王忠明,等.参芪扶正加同步放化疗治疗局部晚期非小细胞肺癌的临床研究[J].实用临床医药杂志,2010,14(7):37-39.
[19]Zhao JB,Zhang TX,Li YZ,et al.Observation of curative effect of Yinqiao-Qingdai decoction combined with ehemoradiotherapyon local advanced non small cell lung cancer[J].Modern Journal of Integrated Traditional Chinese and Western Medicie,2009,18(19):2235-2236.(in Chinese) 赵家彬,张同兴,李耀忠,等.银翘青黛汤联合放化疗治疗局部晚期非小细胞肺癌疗效观察[J].现代中西医结合杂志,2009,18(19):2235-2236.
[20]Zhong H,He SZ,Xiong SZ,et al.Jin-Long capsule combined with concurrent radiochemotherapy for locally advanced non-small-cell lung cancer[J].Chin J Clin Oncol Rehabil,2011,18(5):451-453.(in Chinese) 钟豪,何少忠,熊士忠,等.金龙胶囊联合同步放化疗治疗中晚期非小细胞肺癌临床观察[J].中国肿瘤临床与康复,2011,18(5):451-453.
[21]Zhou XH.Addie injection combined with chemotherapy in treating advanced lung cancer of 40 cases[J].Chinese Journal of Experimental Traditional Medical Formulae,2012,18(15):284-286.(in Chinese) 周晓红.艾迪注射液联合放化疗治疗中晚期肺癌40例[J].中国实验方剂学杂志,2012,18(15):284-286.
[22]Zhou ZJ,Liu SB,Lu LJ.Clinical study on Aidi injection combined with concurrent chemoradiotherapy in the treatment of locally advanced nonsmall cell lung cancer[J].Zhejiang Clinical Medicine,2009,11(5):462-464.(in Chinese) 周祖金,刘少兵,卢丽杰.艾迪注射液加同步放化疗治疗局部晚期非小细胞肺癌的临床研究[J].浙江临床医学,2009,11(5):462-464.
[23]Zhi XY,Wu YL,Ma SL,et al.Chinese guidelines on the diagnosis and treatment of primary lung cancer(2011 Version)[J].Chinese Journal of Lung Cancer,2012,15(12):677-688.(in Chinese) 支修益,吴一龙,马胜林,等.原发性肺癌诊疗规范(2011年版)[J].中国肺癌杂志,2012,15(12):677-688.
[24]Hirata K,Takayama K,Kawaguchi T,et al.Discussion.Meeting on the diagnosis and treatment of lung cancer[J].Nihon Naika Gakkai Zasshi,2014,103(6):1360-1374.
[25]Yan XL,Gu YH.Meta-analysis of Kanglaite injection combined with NP regimen chemotherapy for advanced non-small cell lung cancer[J].Chinese General Practice,2013,16(2):431-435.(in Chinese) 严晓玲,顾艳荭.康莱特联合长春瑞滨+顺铂方案治疗晚期非小细胞肺癌疗效的Meta分析[J].中国全科医学,2013,16(2):431-435.
[26]Zhang PT,Yu MW,Yang ZY,et al.Comparative study on the methods of Chinese medicine and western medicine therapeutic evaluation for advanced non-small cell lung cancer[J].Chinese Journal of Integrated Traditional and Western Medicine,2010,30(7):702-705.(in Chinese) 张培彤,于明薇,杨宗艳,等.中晚期非小细胞肺癌在中西医疗效评价方法比较研究[J].中国中西医结合杂志,2010,30(7):702-705.
[27]Guan NB,Liu H,Lin HS.Progree and prospect of traditional Chinese medicine on lung cancer[J].Chinese Clinical Oncology,2013,18(3):264-267.(in Chinese) 关念波,刘浩,林洪生.肺癌中医药治疗的研究进展及展望[J].临床肿瘤学杂志,2013,18(3):264-267.
(本文编辑:陈素芳)
Efficacy and Safety of Traditional Chinese Medicine Combined With Concurrent Chemoradiotherapy in Treatment of Advanced Non-small Cell Lung Cancer:A Meta-analysis
WANGCong-cong,LIUHong-xing,ZHUANGJing,etal.
GraduateSchool,WeifangMedicalUniversity,Weifang261053,China
Objective To systematically evaluate the efficacy and safety of traditional Chinese medicine(TCM) combined with concurrent chemoradiotherapy in treatment of advanced non-small cell lung cancer(NSCLC).Methods The PubMed,CBM,CNKI,VIP,Wanfang databases,Cochrane Library and any other electric libirary were searched for English or Chinese literatures about randomized controlled trials(RCT) on treating advanced NSCLC using TCM combined with concurrent chemoradiotherapy(the experiment group) and concurrent chemoradiotherapy(the control group) which were published up until December 2013.Relevant journals,conference papers and unpublished literatures were retrieved manually.According to Cochrane system evaluation manual 5.0,data was extracted from the included literatures,and the quality of the included studies was assessed,and the data analyses were performed by the RevMan 5.2 software.The objective curative effect,quality of life,immune ability,side effects and survival time were compared between the experiment group and the control group.Results A total of 20 RCT were included.The objective curative effect was evaluated according to solid tumor′s effect evaluation criterion by WHO.Meta analysis results showed that the effective rate in experiment group was significantly higher than that in control group 〔RR=1.83,95%CI(1.31,2.56),P=0.000 4〕,the effective rate in Chinese medicine injection subgroup was significantly higher than that in control group 〔RR=1.76,95%CI(1.26,3.00),P=0.002〕.The objective curative effect was evaluated according to RECIST(Response Evaluation Criteria in Solid Tumors),the effective rate in experiment group was significantly higher than that in control group 〔RR=1.93,95%CI(1.24,3.01),P=0.004〕,the effective rate in oral Chinese medicine subgroup was significantly higher than that in control group 〔RR=1.90,95%CI(1.17,3.09),P=0.010〕.The KPS score was used to evaluate quality of life,KPS score in experiment group was significantly higher than that in control group 〔RR=3.16,95%CI(2.09,4.77),P<0.000 01〕,KPS score in oral Chinese medicine subgroup 〔RR=3.11,95%CI(1.81,5.34),P<0.000 1〕 and in Chinese medicine injection subgroup 〔RR=3.23,95%CI(1.71,6.10),P<0.000 1〕 was significantly higher than that in control group,respectively,There was no significant difference in proportion of T cells(CD4+、CD8+、CD4+/CD8+)and NK cells between experiment group and control group(P>0.05).The incidence of radioactive lung injury 〔RR=0.49,95%CI(0.34,0.69),P<0.000 1〕,and reduction in white blood cell counts 〔RR=0.58,95%CI(0.39,0.87),P=0.009〕 in experiment group was significantly higher than that in control group,respectively.Conclusion There are a small number of RCT on treating advanced NSCLC using TCM combined with concurrent chemoradiotherapy,so there is still much room for improvement.TCM combined with concurrent chemoradiotherapy can improve curative effect and can reduce side effects,thus the combination therapy has good application value.
Carcinoma,non-small-cell lung;Drugs,Chinese herbal;Radiotherapy;Antineoplastic combined chemotherapy protocols;Meta-analysis
国家自然科学基金资助项目(81273987);山东省自然科学基金青年基金(ZR2013HQ005)
261053山东省潍坊市,潍坊医学院研究生院(汪丛丛,慈晓华);潍坊市中医院肿瘤中心(刘洪星,庄静,刘瑞娟,孙长岗)
孙长岗,261041山东省潍坊市中医院肿瘤中心;E-mail:zhongliuyike@163.com
R 734.2
A
10.3969/j.issn.1007-9572.2015.12.012
2014-05-24;
2014-12-23)
注:汪丛丛和刘洪星共同为第一作者

