天然抗肿瘤活性成分靶向筛选和分离方法研究进展*
*基金项目:国家自然科学基金项目(81260690);江西省教育厅科技计划重点项目(GJJ13618、GJJ10553)。
**第一作者:冯会,女,硕士研究生。研究方向:中药活性成分分析,E-mail:fenghui08@163.com。
天然抗肿瘤活性成分靶向筛选和分离方法研究进展*
*基金项目:国家自然科学基金项目(81260690);江西省教育厅科技计划重点项目(GJJ13618、GJJ10553)。
**第一作者:冯会,女,硕士研究生。研究方向:中药活性成分分析,E-mail:fenghui08@163.com。
★冯会*任小丹尹小英*(江西中医药大学药学院南昌 330004)
摘要:天然产物抗肿瘤活性成分具有高效低毒和结构多样性。靶向筛选和分离能够提高活性化合物的分离效率,降低实验成本,缩短实验周期,并且减少大量使用有机试剂造成的环境污染。本文概述了近年来天然产物抗肿瘤活性成分的靶向筛选和分离的方法,包括以微管蛋白、端粒DNA的G-四联体、基质金属蛋白酶、DNA拓扑异构酶为靶点的活性成分筛选分离方法,以及利用脂筏色谱技术和计算机虚拟筛选技术等靶向筛选分离方法。
关键词:天然产物;抗肿瘤活性成分;靶向分离;筛选
肿瘤是严重威胁人类健康和生命的重大疾病,寻找高效低毒的药物是治疗肿瘤的关键。目前临床治疗肿瘤化学药物的最大问题是耐药性,缺乏理想的抗肿瘤药物[1]。天然产物是抗肿瘤活性成分的重要来源,如紫杉醇、喜树碱、长春新碱等[2]。现有的筛选天然抗肿瘤活性成分的方法主要有体内筛选法、体外筛选法、靶点筛选法等[3]。前两种为传统的天然抗肿瘤活性成分的研究方法,该方法首先通过先对天然产物提取物进行化合物分离,然后对化合物进行结构鉴定,最后进行体内外药理学实验,这种方法的效率较低、消耗试剂人力较大,最终分离得到的单体往往活性低,甚至无活性。抗肿瘤活性成分的靶向分离,是利用某种生物亲和靶点或靶向筛选模型来筛选中药的活性群,进而有目的的进行化学成分的分离,分离效率大大提高,体内外活性评价数据之间的一致性增大,是近年来研究天然产物抗肿瘤活性成分的热点方向[4],但相关文献报道较为少见。本文综述了近年来新的抗肿瘤活性成分的靶向筛选和分离的方法,以期为抗肿瘤活性成分的分离提供参考。
1以微管为靶标的抗肿瘤活性成分筛选分离
微管是真核细胞骨架的重要组成部分,参与许多细胞功能,包括维持细胞形态、细胞内运输、鞭毛和纤毛的运动、染色体运动和细胞分裂等[5]。微管的聚合和解聚是细胞有丝分裂过程中的重要环节,任何干扰这一环节的药物都有可能干扰肿瘤细胞的增值。根据作用机制的不同可以分为作用于微管的药物包括抑制微管解聚的药物(如紫杉醇)和抑制微管聚合的药物(如秋水仙碱、长春碱),根据与微管蛋白结合位点的不同,分为秋水仙碱结合位点、长春碱结合位点和紫杉醇结合位点[6]。以微管为靶点的药物在肿瘤治疗中有许多成功的临床应用[7],因此,微管可以作为筛选抗肿瘤活性成分的重要靶标。
孙婉等[8]采用细胞培养与免疫荧光技术,以常规的免疫组化(玻片)方法为基础优化实验条件,建立了以微管蛋白为靶点的高通量药物筛选模型。以抗肿瘤药物紫杉醇和秋水仙碱为阳性对照,观察待测未知化合物和对照药物作用于人肝癌HepG2细胞后,细胞的免疫荧光强度的变化,通过荧光强度的变化间接反映药物对细胞微管蛋白聚合/解聚作用的影响,结果表明基于人肿瘤细胞的以微管蛋白为靶点的高通量筛选方法可用于抗肿瘤化合物的筛选。孙翠荣等[9]开发了以微管为靶标、平衡透析筛选活性成分、以LC/MS为检测方法的综合方法进行分离筛选。根据抗肿瘤活性成分与微管的相互作用来筛选潜在的抗肿瘤药物,微管-配体复合物在透析器中快速透析后形成。结果表明,秋水仙碱、紫杉醇在μM以下浓度对微管有抑制作用,非活性的化合物则无抑制可迅速识别。
2以端粒DNA的G-四联体为靶点的抗肿瘤活性成分筛选分离
端粒酶在85%~90%以上的肿瘤细胞中过表达,而正常组织(生殖细胞、造血细胞等,干细胞除外)中均显阴性,表明端粒酶与细胞的恶性转化及持续分裂增殖可能具有密切关系[10]。G-四联体(见图1)是一种端粒DNA末端单链悬挂在溶液中形成的特殊的核酸二级结构,广泛存在于人类基因组DNA以及RNA中,如DNA的端粒序列、基因的启动子序列、RNA的5端非翻译区(5UTR)序列等,它在抑制端粒酶活性,从而使肿瘤细胞端粒缩短直至细胞停止增殖过程中发挥重要作用。Zahler等[11]研究表明G-四联体在体外能抑制端粒酶的活性,因而能稳定G四联体的小分子药物(G-四联体配体)就能干扰端粒酶参与的端粒复制。G-四联体配体通过稳定端粒DNA保持G-四链结构,能够达到抗肿瘤的作用。因此G-四联体已渐成为肿瘤治疗和抗肿瘤药物设计开发的一个引人注目的重要靶点[12-13]。
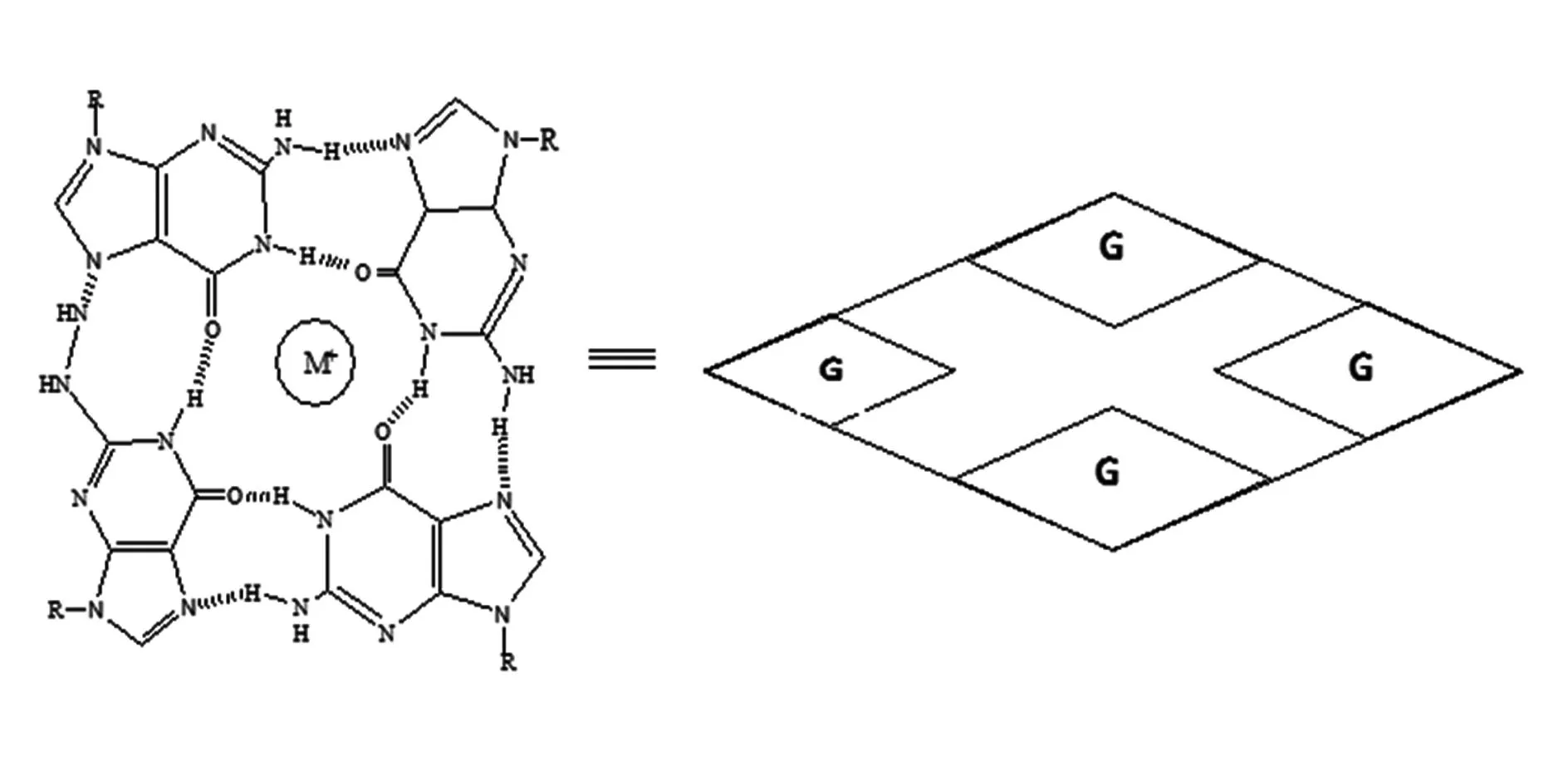
图1 G-四联体结构(M为金属阳离子)
2.1G-四联体识别与NMR检测结合周秋菊等[14-15]通过把G-四联体识别和NMR检测结合起来,成功的从两种天然药物黄柏和黄连的提取物中鉴定出G-四联体配体黄连素及巴马汀。具体步骤分为三步:第一,通过核磁共振一维氢谱检测判断G-四联体配体在提取物中是否存在;第二,通过核磁共振梯度场扩散序谱技术(DOSY)检测配体的特征峰;第三,通过核磁共振二维谱谱,如HSQC、HMBC确定其结构。该方法的优点是在植物提取物体系中引入生物靶点,利用生物靶点对其配体的特异性识别作用而获取核磁共振图谱信息,从而获得被生物靶点识别的化合物的准确结构。该方法把核磁共振图谱学的结构鉴定和抗肿瘤活性成分的筛选结合起来,使在天然植物提取物中实现活性成分快速筛选和鉴定一体化成为可能,为快速筛选天然植物提取物和潜在活性化合物提供了思路。
2.2G-四联体与膜透析法结合透析法是利用小分子物质在溶液中可通过半透膜,而大分子物质不能通过半透膜的性质,达到分离的方法。Shang Qian等[16]首次把膜透析法、G-四联体靶向吸附和NMR检测结合,对川黄柏提取物的抗肿瘤活性成分进行了靶向筛选和分离,从中确认黄连素化合物具有抗肿瘤活性。具体方法为将天然产物川黄柏提取物与G-四联体混合,形成G-四联体-配体复合物,由于复合物的分子量远远大于其他化合物,通过膜透析法,小分子能够通过透析袋而大分子不能,从而将大分子(即G-四联体-配体复合物)分离出来,最后通过高浓度的Tb3+离子与G四联体的负离子PO4-结合[17-18],从而使配体化合物游离出来。膜透析法直接分离得到化合物单体并对其进行结构鉴定,克服了由于样品浓度过小或者由于配体和G-四联体的光学信号重叠而产生的干扰等局限性,对天然药物中抗肿瘤活性成分的靶向分离提供了新思路。
2.3G-四联体与色谱法结合Ge Bai等[19]将高效液相色谱法用于传统中药刺楸(THUNB)三叶木通粗提物中G-四联体配体的快速筛选:通过比较G-四联体DNA加入前后粗提物样品的色谱峰形和吸收强度的不同,发现3个与G-四联体具有较强结合能力的配体,然后利用高速逆流色谱法(HSCCC)进行分离纯化并结合MS和NMR进行鉴定,确定了2,4-二羟基苯甲酸(I),绿原酸(Ⅱ),咖啡酸(Ⅲ)三种配体化合物。这为从天然植物提取物的快速筛选G-四联体配体提供了一个非常有前途的方法。
2.4G-四联体结合无标记荧光法筛选氯高铁血红素(亚铁血红素的氧化形式,在一些病理状态由血红蛋白释放出)通过促进氧自由基的形成引起不良的毒性导致器官、组织和细胞损伤,对脂质、蛋白质和DNA的氧化起到催化作用[20-21],程小红等[22]通过实验证明了G-四联体-氯高铁血红素复合物的过氧化物酶活性,分子内并行的G-四联体结构有利于氯高铁血红素的最终叠加,因此具有较高的过氧化物酶活性。G-四联体DNA-氯高铁血红素复合物能有效地催化的对羟基苯乙酸(HPA)和H2O2的氧化反应。HPA是一种非荧光底物,但HPA与H2O2的氧化产物是一种强荧光化合物(激发/发射波长最大值313/405nm),因此,G-四联体DNA氯高铁血红素复合物能诱导与HPA-H2O2体系产生强烈的荧光发射。
Lihui Fu等[23]采用无标记荧光法,基于G四联体配体从G-四联体DNA核酶中置换出氯高铁血红素,导致G-四联体DNA核酶对HPA和H2O2之间的荧光显影反应的催化能力降低。当强作用的G-四联体的配位体加入到G-四联体氯高铁血红素复合物系统中,配体可取代氯高铁血红素与G-四联体DNA核酶结合(见图2)。因此,可以根据HPA-H2O2体系的荧光强度是否下降来判断配位体与G-四联体的结合能力。该方法不需要对DNA进行任何化学修饰,且荧光法具有高度选择性,实验只需较低浓度的DNA和配体化合物,克服了CD法中对标记的DNA和G-四联体配体较高浓度的要求,以及MS和NMR法对昂贵设备的要求,提供了一种筛选G-四联体配体的简单、廉价、灵敏的方法。
2.5G-四联体结合表面等离子共振成像筛选表面等离子体共振成像(SPRI)是分析生物分子间的相互作用的一种无标记技术,可实时采集绑定的动力学参数。该技术的独特优势是样品免标记,且能够原位实时监测分子间相互作用的动态过程[24]。它能够提供多达1 000个独立的生物分子的相互作用单次运行测试,因此可以用一个单一的运行来测试大量的交互作用,为迅速识别对一个给定的生物实体最合适的化合物提供了可能性。到现在为止,这种技术已成功用于相关的相对大的分子(蛋白质、抗体、DNA),用于小分子的相关研究较少。Pillet F.[25]使用表面等离子共振成像技术,很容易的辨别了G-四联体配体与G-四联体的结合。证明了SPRI技术也可以用于小分子药物靶向作用的筛选,比如G-联体配体的筛选。
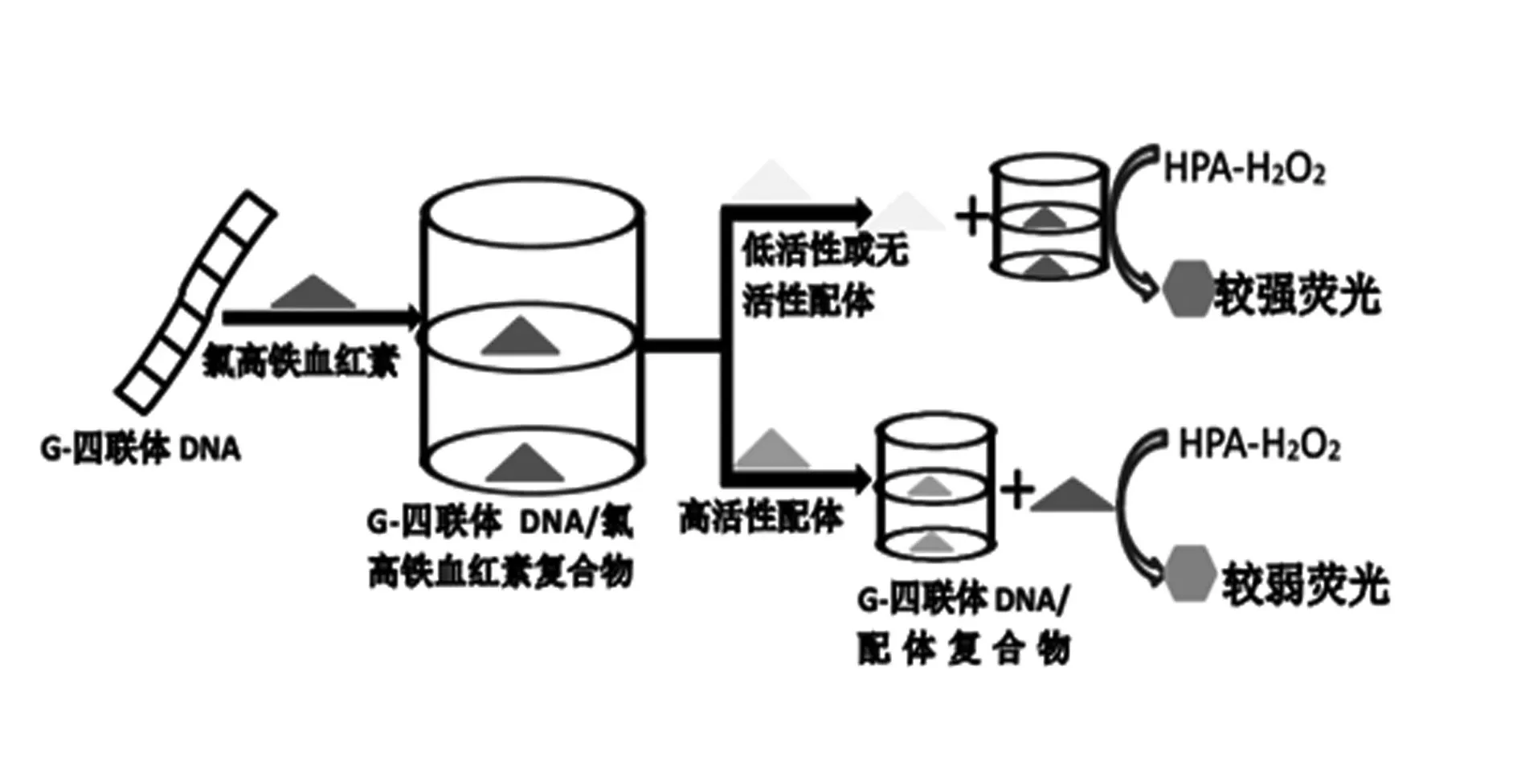
图2 无标记荧光法筛选G-四联体配体示意图
3以基质金属蛋白酶为靶点分离抗肿瘤活性成分
基质金属蛋白酶-2(matrixmetalloproteinases-2,MMP-2)是一种明胶酶,由肿瘤细胞或由肿瘤细胞诱导宿主细胞以无活性的酶原形式分泌,能降解基底膜胶原、纤连蛋白及弹性蛋白,溶解明胶[26]。MMPs主要负责细胞外基质的水解,能降解其组成中的大部分。由于MMPs的过量表达与多种疾病密切相关,如肿瘤、骨关节炎和心脏病等,尤其是在肿瘤转移过程中MMPs起着关键性的作用。刘星辰等[27]根据基质金属蛋白酶(MMPs)的活性位点附近三维空间结构,设计合成了4种双腾酸类化合物,采用酶促反应动力学方法分别测试了双腾酸化合物及阿伦磷酸钠(A lendmnate)对MMPs的抑制效果,并对其抑制效果进行了对比,利用分子对接方法以及荧光滴定光谱研究了双腾酸化合物与MMPs的分子识别和作用机理,从分子学角度阐述了双膦酸化合物与基质金属蛋白酶的作用机制。
4以DNA拓扑异构酶为靶点分离抗肿瘤活性成分
DNA拓扑异构酶(DNATopo)是调节核酸空间结构动态变化、控制核酸生理功能的关键酶,广泛存在于生物体内。DNA拓扑异构酶有I、II、III三种结构类型,目前研究较多的是拓扑异构酶II,其直接参与基因复制和转录,其表达量与细胞功能状态呈正比,可作为肿瘤细胞是否增殖的标志[28]。王长虹等[29]研究了去氢骆驼蓬碱、骆驼蓬碱、骆驼蓬总碱及哈尔满碱对DNA拓扑异构酶Ⅱ活性的抑制作用,采用琼脂糖凝胶电泳法检测提取物及药物对DNA拓扑异构酶Ⅱ的抑制作用,提出了三种可能的作用机制。
5脂筏色谱技术在抗肿瘤活性成分靶向分离的应用
脂筏((Lipid raft, LR)是质膜上富含胆固醇和鞘磷脂的微结构域,参与膜的信号转导、蛋白质和脂类运输、病原体入侵机体等一系列细胞过程。蛋白质酪氨酸激酶(Tyrosine kinase, TrkA)参与脂筏中细胞信号传导过程,在细胞的生长、分化和死亡等过程中起重要作用,超过50%的原癌基因及癌基因产物具有TrkA活性,其异常表达会导致肿瘤发生,因此,TrkA是抗肿瘤药物研究的重要靶点[30]。脂筏色谱(lipid Raft stationary phase chromatography)是以富含酪氨酸激酶的脂筏-硅胶为固定相,以乙酸铵为流动相建立的色谱柱,能够特异性的保留以酪氨酸激酶为靶点的成分,非活性成分无保留[31]。该色谱系统与传统的正反相色谱系统不同,具有色谱分离与活性识别的双重特性,因此可以以TrkA为靶标进行抗肿瘤活性成分筛选。易成学[32]运用新型酪氨酸激酶受体抑制剂的高通量筛选模型脂筏色谱,首次从金针菇中筛选出具有抗肿瘤活性甾醇和脂肪酸提取物,利用高效液相色谱法(HPLC)分离制备甾醇物中的含量较高的两个主要成分,并鉴定它们的化合物结构。童珊珊[33]用对酪氨酸激酶具有特异性抑制活性的药物来他替尼作为模型化合物来考察影响脂筏色谱效果的的操作参数,其中脂筏色谱柱填料粒径、柱温、流速对色谱行为的影响起主要作用。为了评价该系统的适用范围,用该系统的最优条件来分离筛选合欢皮的有效部位,其活性成分用MTT(四甲基偶氮唑)法确证,结果表明脂筏色谱这种新技术能够满足对潜在的抗肿瘤活性成分的初步筛选要求。
6计算机虚拟筛选抗肿瘤活性成分
药物虚拟筛选是采用化学信息学、结构生物学及分子模拟等方法,借助计算机技术和相应软件通过分子相似性搜索等评价药物与靶蛋白的相互作用,从而预测分子的作用靶标[34]。王军磊[35]采用计算机辅助药物设计的分子对接技术,选取11味具有抗肿瘤活性成分的中药,建立了抗肿瘤小分子化合物库。选取6个抗肿瘤相关靶标蛋白,对小分子化合物进行虚拟筛选,发现可以与4个及以上靶点有结合活性的化合物有15个,其中有6个来源于牛蒡子中的木脂素类化合物。吴向伟[36]运用计算药理学方法重点对龙蛇羊泉汤中所含的187个化合物进行了化学空间分析,对一些特征描述符的分布进行了阐释,同时采用主成分分析方法将多维化学空间映射到二维空间以得到更直观的图像,结果表明龙蛇羊泉汤中大部分成分具有较好的类药性质。采用分子对接方法研究了187个化合物与12个肿瘤疾病相关的公认靶标的相互作用,显示出了龙蛇羊泉汤中化合物在抗肿瘤方面多通路、潜在的协同作用的药理学性质,说明虚拟筛选具有辅助筛选先导化合物的能力[37]。
7结语
对天然产物抗肿瘤活性成分进行靶向筛选和分离,是现代研究天然产物中抗肿瘤活性成分的趋势。运用生物学靶点筛选抗肿瘤活性成分可以增大体内外活性评价数据之间的一致性,利用脂筏色谱技术能够特异性的筛选具有抗肿瘤活性的有效成分群,提高分离效率;计算机虚拟筛选抗肿瘤活性成分弥补了动物药理实验方法的缺陷,减少了人力和物力的投入。靶向筛选和分离在中药研究领域建立了全新的理念和先进的研究手段,将成为中药研究发展的一种新趋势,使中药现代化真正进入一个宽广的良性发展的轨道。
参考文献
[1]欧阳洪贵,李玉艳.美国 FDA近10年抗肿瘤药物[J].中国新药杂志,2012,21(24):2 885-2 894.
[2]罗艳萍,修连喜.天然抗肿瘤药物的研究进展[J].黑龙江医药,2011,24(3):377-379.
[3]郭婷.天然抗肿瘤药物筛选方法的研究进展[J].生物技术世界,2014,(9):99.
[4]肖楠.小花棘豆未知化学成分预测及靶向分离方法研究[D].北京中医药大学,2009:122.
[5]杨铭.结构生物学与药学研究[M].北京:科技出版社.2003:60-68.
[6]席菁乐.新型微管蛋白抑制剂的研发和抗肿瘤机制研究[D].南方医科大学,2013:144.
[7]李耀武.基于微管蛋白小分子抗肿瘤药物的设计与合成研究[D].第二军医大学,2008:124.
[8]孙婉,李敏,魏少荫,等.以微管蛋白为靶的高通量药物筛选方法的建立与应用[J].中国新药杂志,2006,15(21):1 828-1 831.
[9]Sun C, Fu J, He S, et al. An integrative approach for the isolation, screening and analysis of antitumor agents by liquid chromatography combined with mass spectrometry[J]. Analytica chimica acta, 2009, 655(1): 86-91.
[10]Whitehead J P, Lippard S J. Proteins that bind to and mediate the biological activity of platinum anticancer drug-DNA adducts[J].Metal ions in biological systems, 1996, 32: 687.
[11]Han H, Hurley L H. G-quadruplex DNA: a potential target for anti-cancer drug design[J]. Trends in pharmacological sciences, 2000, 21(4): 136-142.
[12]谌錾,修明贺,李素芳,等.G-四联体的生物学功能研究进展[J].生理科学进展,2010,41(5):329-334.
[13]胡晓文.端粒G-四联体——肿瘤治疗的新靶点[J].国外医学.口腔医学分册,2004,S1:98-100.
[14]Zhou Q, Li L, Xiang J, et al. Screening Potential Antitumor Agents from Natural Plant Extracts by G‐Quadruplex Recognition and NMR Methods[J]. Angewandte Chemie, 2008, 120(30): 5 672-5 674.
[15]Zhou Q, Li L, Xiang J, et al. Fast screening and structural elucidation of G-quadruplex ligands from a mixture via G-quadruplex recognition and NMR methods[J]. Biochimie, 2009, 91(2): 304-308.
[16]Shang Q, Xiang J F, Zhang X F, et al. Fishing potential antitumor agents from natural plant extracts pool by dialysis and G-quadruplex recognition[J].Talanta, 2011, 85(1): 820-823.
[17]Galezowska E, Gluszynska A, Juskowiak B. Luminescence study of G-quadruplex formation in the presence of Tb3+ ion[J]. Journal of inorganic biochemistry, 2007, 101(4): 678-685.
[18]Kumar S, Bandyopadhyay U. Free heme toxicity and its detoxification systems in human[J].Toxicology letters, 2005, 157(3): 175-188.
[19]Bai G, Cao X, Zhang H, et al. Direct screening of G-quadruplex ligands from Kalopanax septemlobus (Thunb.) Koidz extract by high performance liquid chromatography[J]. Journal of Chromatography A, 2011, 1 218(37): 6 433-6 438.
[20]Regan R F, Kumar N, Gao F, et al. Ferritin induction protects cortical astrocytes from heme-mediated oxidative injury[J]. Neuroscience, 2002, 113(4): 985-994.
[21]Chen‐Roetling J, Benvenisti‐Zarom L, Regan R F. Cultured astrocytes from heme oxygenase‐1 knockout mice are more vulnerable to heme‐mediated oxidative injury[J]. Journal of neuroscience research, 2005, 82(6): 802-810.
[22]Cheng X, Liu X, Bing T, et al. General Peroxidase Activity of G-Quadruplex Hemin Complexes and Its Application in Ligand Screening[J].Biochemistry, 2009, 48(33): 7 817-7 823.
[23]Fu L, Li B, Zhang Y. Label-free fluorescence method for screening G-quadruplex ligands[J]. Analytical biochemistry, 2012, 421(1): 198-202.
[24]申刚义,陈义,张轶鸣,等.表面等离子体共振成像[J].化学进展,2010,22(8):1 648-1 655.
[25]Pillet F,Romera C, Trévisiol E, et al. Surface plasmon resonance imaging (SPRi) as an alternative technique for rapid and quantitative screening of small molecules, useful in drug discovery[J]. Sensors and Actuators B: Chemical, 2011, 157(1): 304-309.
[26]金啸,汪廷乐,王丽,等.基质金属蛋白酶在涎腺良恶性多形性腺瘤中的表达[J].口腔颌面,2013,23(5):352-356.
[27]刘星辰,李洪伟,王烨,等.双膦酸化合物对基质金属蛋白酶的抑制效应及机理[J].高等学校化学学报,2010(1):88-93.
[28]马海玲,刘蕾,马艳荣.DNA拓扑异构酶Ⅱα与乳腺癌的研究进展[J].中国医药指南,2013,11(17):62-63.
[29]王长虹,程雪梅,刘忠渊,等.骆驼蓬种子提取物及其β咔保啉生物碱对DNA拓扑异构酶Ⅱ活性的抑制作用[J].中国临床药理学杂志,2008,24(5):422-425.
[30]Pike L J. Growth factor receptors, lipid rafts and caveolae: an evolving story[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2005, 1 746(3): 260-273.
[31]童珊珊.中药活性成分在线色谱筛选新模型研究[D].江苏大学,2012:144.
[32]易承学.金针菇抗肿瘤活性成分筛选及其纳米制剂研究[D].江苏大学,2012:124.
[33]Tong S, Sun C, Cao X, et al. Development and thermodynamic evaluation of novel lipid raft stationary phase chromatography for screening potential antitumor agents[J].Biomedical Chromatography, 2014.(10):155.
[34]付文卫,张华,刘平.计算机药理学的主要方法及其在中医方药治疗慢性肝病研究中的应用[J].临床肝胆病杂志,2014,30(4):289-294.
[35]王军磊.抗肿瘤中药活性成分多靶点的计算机虚拟筛选[D].中国海洋大学,2011:143.
[36]吴向伟.龙蛇羊泉汤抗癌活性成分的虚拟筛选研究[D].郑州大学,2011:114.
[37]陈少军,陈宏降,郭章华.丹参中抗血栓活性成分的虚拟筛选[J].中药药理与临床,2013,29(6):103-106.
Progress in Researches for Targeting Screening and Separating Natural Anti-tumor Activity Ingredients
FENG Hui, REN Xiao-dan, YIN Xiao-ying
CollegeofPharmacyJiangxiUniversityofTraditionalChineseMedicine,Nanchang330004,china.
Abstract:Anti-tumor ingredients have the characteristics of efficient activity, low toxicity and structural diversity from natural product. Targeted screening and separating the antitumor activity of natural products can improve the separation efficiency, reduce costs, shorten the test cycle, and reduce the amount of organic reagents which has caused environmental pollution. This article reviewed methods of targeted screening and separation anti-tumor activity of natural products in recent years, including using microtubules, G- quadruplex DNA, and matrix metalloproteinases, DNA topoisomerase as targets for screening and separating, and using lipid rafts chromatographic separation technology and computer virtual screening techniques for targeting isolation.
Key words:Natural products;Anti-tumor active ingredients;Target isolation;Screening
收稿日期:(2014-12-09)编辑:秦小珑
中图分类号:R284
文献标识码:A
通信作者:***尹小英,女,博士,教授。研究方向:中药活性成分分析。Tel:(0791)87118917,E-mail:ncyxoy@163.com。

