16S rDNA-RFLP分析不同产地人参内生菌的多态性*
*基金项目:江西省卫生厅中医药科研计划项目(2012A034)。
16S rDNA-RFLP分析不同产地人参内生菌的多态性*
*基金项目:江西省卫生厅中医药科研计划项目(2012A034)。
★万红娇谢燕飞谢斌朱金华马广强*(江西中医药大学基础医学院南昌 330004)
摘要:目的:采用16S rDNA—RFLP方法分析比较不同产地、品种人参内生菌的差异,为探讨人参内生菌对其药材的影响奠定基础。方法:收集不同产地、不同品种人参,用细菌基因提取试剂盒提取人参内生菌基因组,扩增内生菌16S rDNA片段后,用RFLP(限制性酶切片段分析)方法分析不同产地、不同品种人参内生菌的多态性。结果:不同产地、不同品种人参均含有内生细菌,且内生细菌菌种组成有明显差异。结论:不同产地的人参有不同的人参内生菌,通过鉴定内生菌可鉴定人参的产地。
关键词:人参;16S rDNA;RFLP;内生菌
植物内生菌(endophyte) 是指一类在其部分或全部生活史中存活于健康植物组织内部、不引发宿主植物表现出明显感染症状的微生物。植物内生菌包括内生真菌和内生细菌(内生细菌包括内生放线菌) ,可从经过严格表面消毒的植物组织或植物组织内部分离得到[1]。内生菌在植物体内广泛存在,大量研究表明,一方面,植物内生菌的组成与植物生长的产地环境具有密切相关性,在一定的生境下,植物根部的内生菌较为稳定;另一方面,内生菌与寄主植物的生长和生理往往具有密切的关系,无疑会对寄主植物的特性产生影响。因而植物内生菌对药用植物的生长、药材质量的影响从20世纪90年代起逐渐成为人们关注的热点[2]。而,限制性酶切片段分析(RFLP)作为一种生物研究方法,已广泛应用于基因的多态性分析和不同环境中微生物菌的多态性分析[7-10]。人参(Panax ginseng)由于其生产资源有限、生产周期长、成本高、价格昂贵,故市场上以次充好,以假乱真的现象很多[3-4],药材经营商家、制药企业及社会公众对人参的真伪优劣鉴别有着普遍的需求。作为中药材传统的形态学鉴定方法,需要丰富的鉴定经验[4],现代的利用HPLC、GC等手段的化学成分鉴别方法[5-6],则对仪器设备有较高的要求,在应用上有一定的局限性。作为以根入药的人参,开展其内生菌的研究对于人参的鉴别和质量控制无疑具有重要的意义。为此,本实验采用PCR扩增16S rDNA,RFLP分子标记方法对不同产地、品种人参内生细菌的多态性、特定产区和品种人参特有的RFLP片段,对不同产地、品种的人参内生细菌的多样性进行分析,初步研究植物内生菌在道地药材药性形成过程中的影响。
1材料与方法
1.1实验材料各种人参(美国野生西洋参,美国许氏种植西洋参,吉林种植西洋参,加拿大种植西洋参,西洋参)以及不同种类的参类(白参,南沙参,北沙参,党参,丹参)(均购自南昌市黄庆仁栈桥大药房);胡萝卜(购于菜市场)。细菌基因组DNA提取试剂盒,普通DNA产物胶纯化试剂盒(购自天根生化科技有限公司);限制性内切酶Hha I,Rsa I ,Hinf I(Promaga),2×Taq PCRMasterMix(天根生化科技有限公司),扩增引物为通用引物UFPL (5'-AGTTTGATCCTGGCTCAG-3') ,URPL (5'-GGTTACCTTGTTACGACTT-3'),扩增长度为1484 bp(上海生物工程有限公司合成)。
1.2实验方法
1.2.1人参的处理将人参3 g用无菌水洗净后,置于99%乙醇 溶液中浸泡1 min,然后置于3.125%的次氯酸钠溶液中浸泡6min,再置于99%乙醇溶液中浸泡30 s,最后用无菌水冲洗5次。样品用无菌吸水纸吸干后备用。吸取50 μL最后一次洗涤水涂布在NA平板上,置于28 ℃培养箱培养2 d,作为空白对照组。将处理过的样品剪碎,取1 g置于含10 mL无菌水的试管中,28 ℃条件培养2~3d。
1.2.2植物内生菌总DNA的提取取细菌培养液,摇匀后取1.5 mL于无菌离心管中离心(10000 r/min,4 ℃)2 min 后,用细菌基因组DNA提取试剂盒提取细菌总DNA。
1.2.3植物内生菌16S rDNA的扩增及检测 扩增体系为20 μL,其中引物各1 μL,2×Taq PCRMasterMix 10 μL,DNA模板4 μL,双蒸水4 μL。扩增条件为95℃ 0.5 min,55 ℃ 0.5 min,72 ℃ 1.5 min,共35个循环。反应后PCR产物用1%的琼脂糖凝胶电泳检测。
1.2.4限制性内切酶酶切分别用限制性内切酶Hha I,Rsa I , Hinf I对16S rDNA产物进行酶切鉴定。酶切体系为双蒸水12.3 μL,C Buffer 2 μL,BSA 0.5 μL,内切酶0.5 μL,DNA,5 μL,共20 μL体系。
2结果
2.116S rDNA -PCR产物电泳检测结果PCR产物鉴定结果如图1所示:结果表明西洋参内生菌中均能检测到细菌的16S rDNA,证明人参中存在有内生细菌。
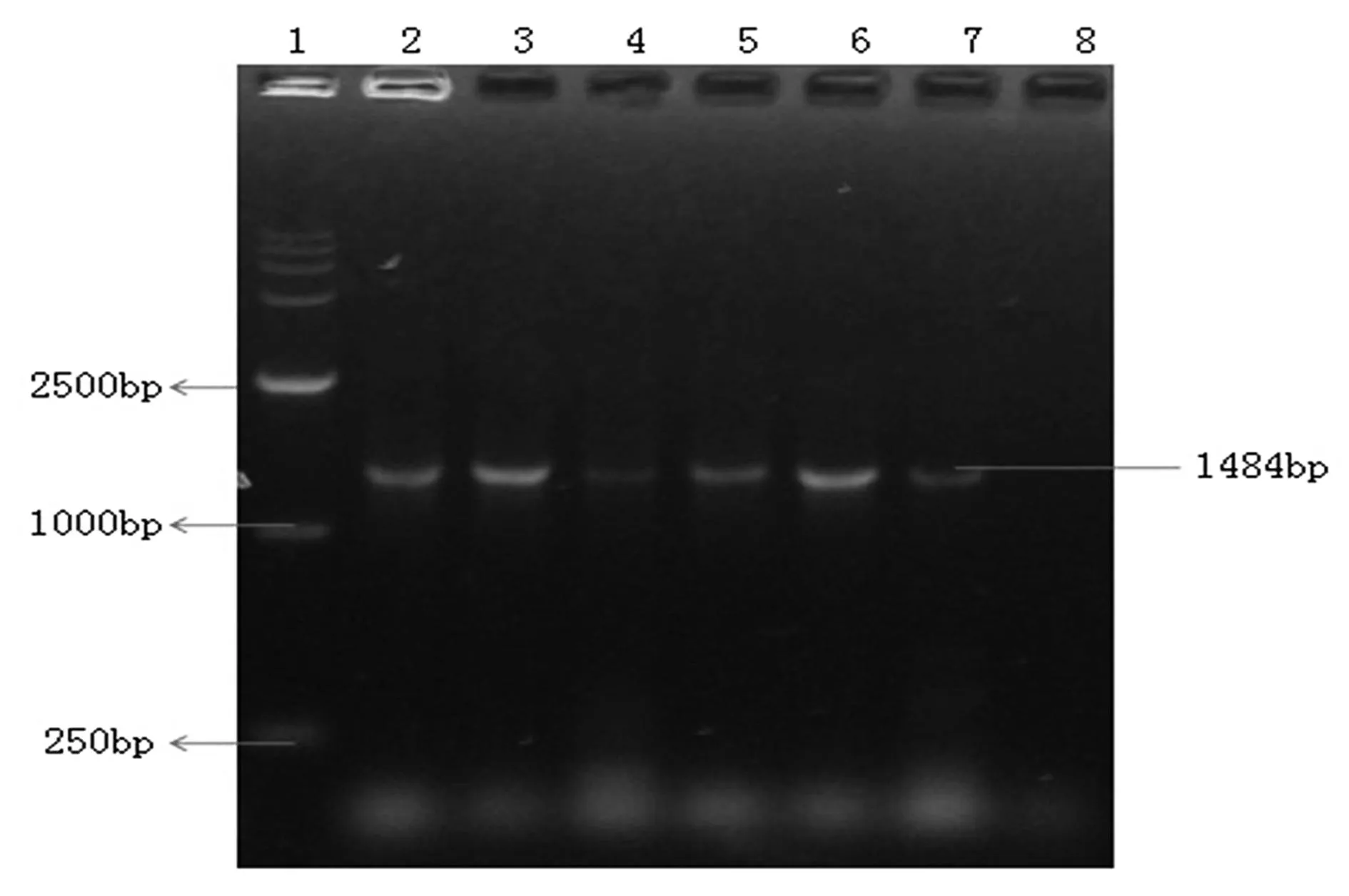
1.DL15000;2.美国野生西洋参;3.美国许氏种植西洋参;4.吉林种植西洋参;5.加拿大种植西洋参;6.长春种植西洋参;7.不知产地西洋参;8.空白对照
图116S rDNA扩增结果
2.2RFLP鉴定不同产地西洋参内生细菌的差异2.2.1不同产地西洋参Hha I酶切鉴定不同西洋参内生菌的总16S rDNA Hha I酶切结果(图2)显示,不同产地西洋参的16S rDNA-RFLP条带有部分相同;但是美国野生西洋参/许氏种植西洋参/吉林种植西洋参/加拿大种植西洋参和长春种植西洋参的酶切条带明显不同。
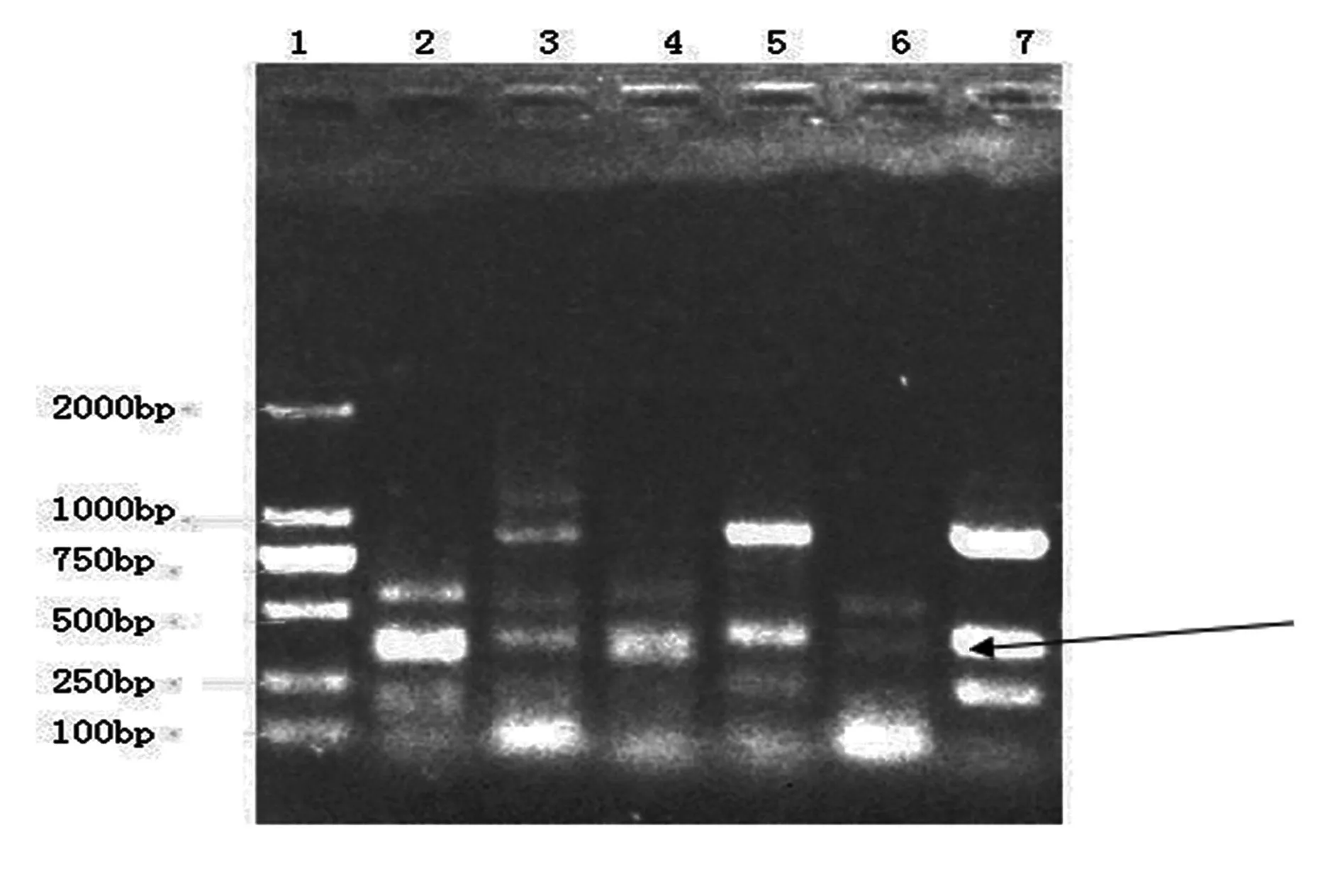
1.DL2000;2.美国野生西洋参;3.美国许氏种植西洋参;4.吉林种植西洋参;5.加拿大种植西洋参;6.长春种植西洋参;7.不知产地西洋参
图2不同西洋参内生菌总16S rDNA Hha I酶切结果
2.2.2不同产地西洋参RsaI酶切鉴定不同西洋参内生菌的总16S rDNARsa I酶切结果(图3),其中美国野生西洋参/许氏种植西洋参/吉林种植西洋参/加拿大种植西洋参和长春种植西洋参的酶切条带存在显著差异,几乎无共有条带。
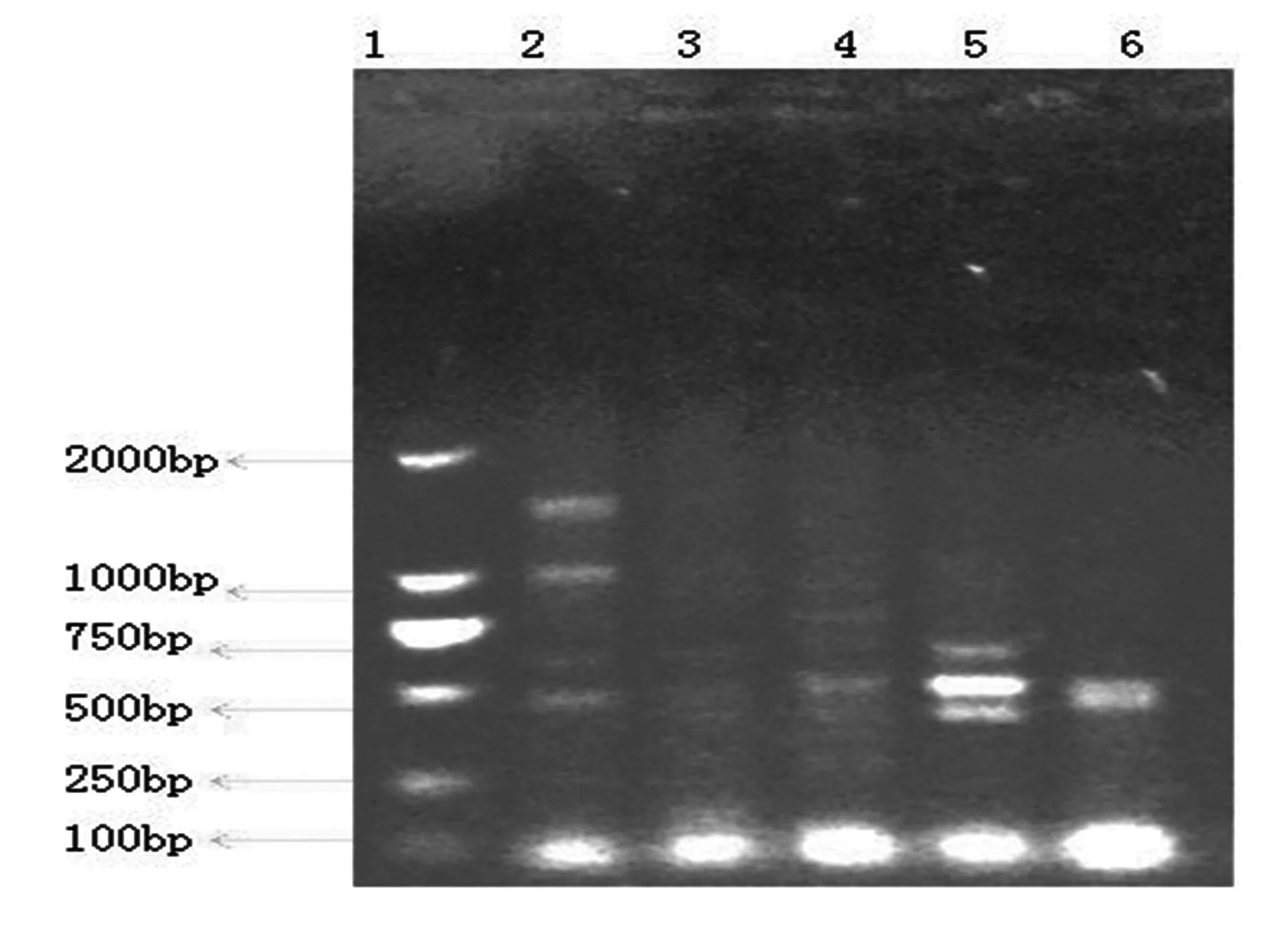
1.DL2000;2.美国野生西洋参;3.美国许氏种植西洋参;4.吉林种植西洋参;5.加拿大种植西洋参;6.长春种植西洋参;
图3不同西洋参内生菌总16S rDNARsa I酶切结果
2.2.3不同产地西洋参Hinf I酶切鉴定不同产地西洋参内生菌的总16S rDNA Hinf I酶切结果(图4)表明,其中美国野生西洋参/许氏种植西洋参/吉林种植西洋参/加拿大种植西洋参和长春种植西洋参的酶切条带明显不同。Hinf I限制性内切酶酶切16S rDNA帯型丰富。
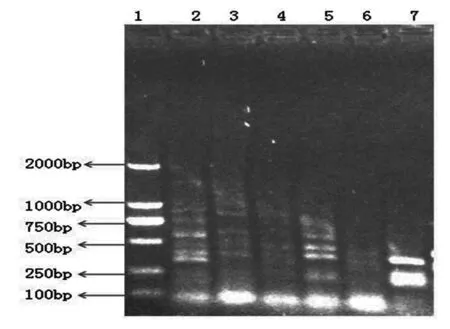
1.DL2000;2.美国野生西洋参;3.美国许氏种植西洋参;4.吉林种植西洋参;5.加拿大种植西洋参;6.长春种植西洋参;7.不知产地西洋参
图4不同西洋参内生菌总16S rDNA Hinf I酶切结果
2.3酶切鉴定不同人参种类内生细菌的差异
2.3.1不同人参种类Hha I酶切鉴定不同人参内生菌的总16S rDNA Hha I酶切结果(图5)。其中西洋参/白参/沙参/党参/胡萝卜/丹参的酶切条带明显不同。沙参和胡萝卜内生菌16S rDNA被完全切成小片段。
2.3.2不同人参种类Rsa I酶切鉴定不同人参内生菌的总16S rDNARsa I酶切结果(图6)。其中西洋参/白参/党参/丹参的酶切条带明显不同。沙参和胡萝卜内生菌16S rDNA完全被降解。
2.2.3不同人参种类Hinf I酶切鉴定不同人参内生菌的总16S rDNA Hinf I酶切结果(图7),其中西洋参/白参/党参/丹参的酶切条带明显不同。沙参和胡萝卜内生菌16S rDNA被完全降解。

1.DL2000;2.西洋参;3.白参;4.沙参;5.党参;6.胡萝卜;7.丹参
图5不同人参内生菌总16S rDNA Hha I酶切结果
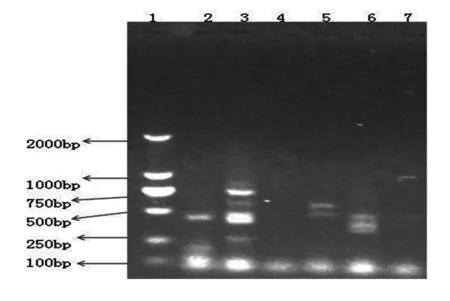
1.DL2000;2.西洋参;3.白参;4.沙参;5.党参;6.胡萝卜;7.丹参
图6不同人参内生菌总16S rDNA Rsa I酶切结果
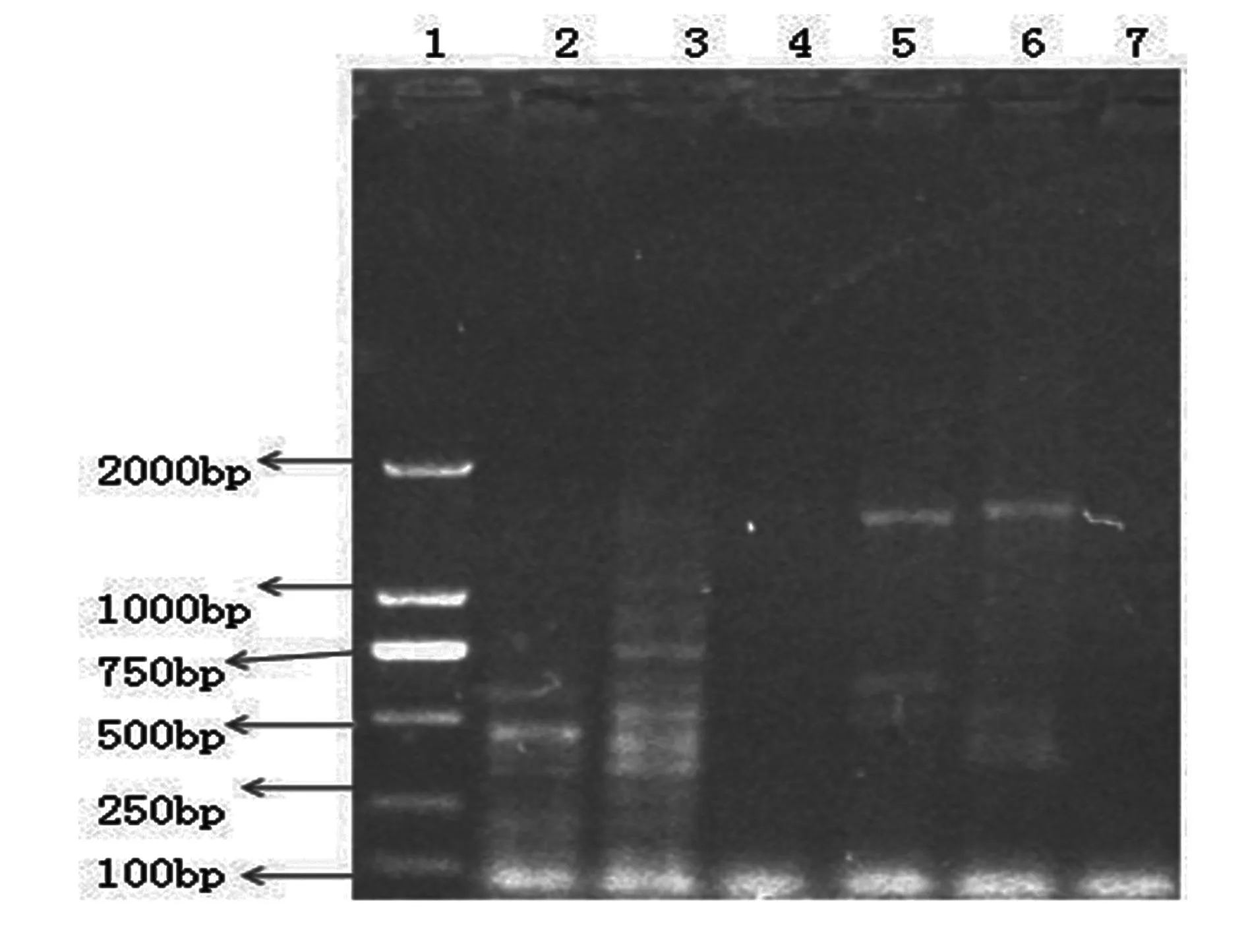
1.DL2000;2.西洋参;3.白参;4.沙参;5.党参;6.胡萝卜;7.丹参
图7不同人参内生菌总16S rDNA Hinf I酶切结果
3讨论
近年来,研究者已从红豆杉、桃儿七、雷公藤、长春花、青蒿、薄荷、杜仲和美登木等多种药用植物分离到了大量内生菌。药用植物内生菌与宿主植物之间存在复杂的微生态关系。两者互相进行物质、能量及基因交流,在长期进化过程中形成了互惠共生关系[1-11]。对于生长在不同生境中的中药材,由于所处生态环境的差异以及药材原植物自身所产生的遗传变异(居群、品系或品种),其结果可能导致内生菌种群结构在道地药材与非道地药材之间存在较大差异。由于不同内生菌产生的代谢产物种类一般不同,因此这种种群结构的差异会产生功能多样性,不同的内生菌种群以各自不同的方式影响着药材性状、生长以及有效成分的积累等,最终导致道地药材与非道地药材品质的差异[1-2,11-13]。
本实验通过16S rDNA PCR方法扩增人参植物内生细菌基因,不同产区、不同品种的人参都扩增出16S rDNA 片段,说明植物内生细菌广泛存在于不同品种人参内。通过对16S rDNA PCR产物RFLP分析发现,不同产地、不同品种的人参的植物内生菌的种类有明显差异,不同产地的同种植物的内生菌也有很大的差异性。提示,人参内生菌的特征条带可能具有人参产地和品种的鉴别价值,可应用于建立人参简便、快速的微生物学鉴定方法;同时,进一步结合对不同产地、品种人参的质量评价分析,探讨其质量与内生菌特征条带的相关性,可为人参生产区划、质量控制提供新的科学依据。
参考文献
[1]邹文欣, 谭仁祥.植物内生菌研究新进展[J]. 植物学报,2001, 43(9):881-892.
[2]贾栗, 陈疏影, 翟永功,等.近年国内外植物内生菌产生物活性物质的研究进展[J]. 中草药,2007, 38(11):1 750-1 754.
[3]晓洪.人参质量鉴定与食用方法[J]. 农业技术与装备,2008,(1):57.
[4]帅绯.刺人参的生药鉴定研究[J]. 中草药,2001, 32(6):554-555.
[5]赖天兵, 陈波, 潘振球, 等. 高效液相色谱法用于保健食品中人参原料鉴定[J]. 实用预防医学,2004, 11(5):1 004-1 005.
[6]冯传平, 黄鹏, 王效山.人参的分子生物学鉴定概况[J]. 现代中药研究与实践,2004, 18(4):62-64.
[7]闫爱民, 陈文新. 三个根瘤菌新亚群的16S rDNA-RFLP分析[J]. 高技术通讯,1998, 8(9):50-54.
[8]原亚萍, 陈孝, 肖世和, 等.应用基因组原位杂交及RFLP标记鉴定小麦中的大麦染色体[J]. 遗传学报, 2000, 27(12):1 080-1 083.
[9]程海鹰, 肖生科, 马光东, 等.营养注入后油藏微生物群落16S rRNA基因的T-RFLP对比分析[J]. 石油勘探与开发,2006, 33(3):356-359, 373.
[10]马玉红, 马志杰. RFLP和PCR-RFLP标记与牦牛遗传育种研究[J]. 中国牛业科学,2006, 32(5):48-51.
[11]姜怡, 杨颖, 陈华红, 等.植物内生菌资源[J]. 微生物学通报,2005, 32(6):146-147.
[12]江曙, 钱大玮, 段金廒, 等.植物内生菌与道地药材的相关性研究[J]. 中草药,2008, 39(8):1 268-1 272.
[13]江曙, 陈代杰, 陶金华, 等.植物内生菌及其代谢产物的药学研究进展[J]. 中国生化药物杂志,2008, 29(6):424-426.
Analysis the Differences of Endophyte Bacterias in Panxiginsengs by 16S rDNA -RFLP Method
WAN Hong-jiao, XIE Yan-fei,XIE Bin ,ZHU Jin-hua ,MA Guang-qiang
JiangxiUniversityofTraditionalChineseMedicnie,Nanchang330004,China;
Abstract:Objective:In this study, method of 16S Rdna-RFLP were used to detect the differences of the endophyte in Panxginseng. Methods: PCR were used to amplify the 16S rDNA of endophyte bacterias in Panxginseng, then the products of PCR were digested by single enzyme. Results: there Were obvious differences in the endophyte bacterias in different kinds of Panxginsengs. Conclusion: It is possible to identify the producing region of Panxginsengs by detecting the special bacterias in its endophte.
Key words:Panxginseng; 16S rDNA; RFLP;Endophyte
收稿日期:(2014-10-13)编辑:曾文雪
中图分类号:Q93
文献标识码:A
通信作者:*马广强(1977—),男,博士。研究方向:病原微生物学。Tel:1877005061,E-mail:maguangqiang@163.com.。

