毛尖蘑粗多糖对H22肝癌小鼠 TNF-α和IL-2表达的影响①
罗文哲 ,王建杰, 吕冬霞
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
毛尖蘑粗多糖对H22肝癌小鼠 TNF-α和IL-2表达的影响①
罗文哲 ,王建杰, 吕冬霞
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的:研究毛尖蘑粗多糖对H22肝癌小鼠 TNF-α和IL-2表达的影响。方法:建立小鼠肝癌模型,并随机分为4组:阴性对照组、阳性对照组、毛尖蘑粗多糖低(20mg/mL)、高剂量组(40mg/mL),每组10只。于接种后24h给予不同处理,每日1次,腹腔注射。14d后,采用ELISA法测定血清中TNF-α与IL-2水平,RT-PCR对外周血单个核细胞(PBMC)TNF-α与IL-2 mRNA表达进行检测。结果:模型对照组血清中IL-2 水平低于正常对照组(P<0.05),TNF-α水平变化不明显,毛尖蘑粗多糖组TNF-α和IL-2水平高于模型对照组(P<0.05)。PBMC中TNF-α和IL-2mRNA在毛尖蘑粗多糖组高于模型对照组(P<0.05)。结论:毛尖蘑粗多糖能促进TNF-α和IL-2 分泌而发挥了抗肿瘤作用。
毛尖蘑粗多糖;肝癌;细胞因子
毛尖蘑,别名金子蘑,是一种罕见的野生珍稀食用真菌。在前期研究工作中,我们对毛尖蘑中的粗多糖进行了提取,并发现其对H22荷瘤小鼠的肿瘤生长有抑制作用[1,2],但对免疫功能的影响尚未见报道。因此,本研究通过建立小鼠H22肝癌模型,采用ELISA、RT-PCR方法,对荷瘤小鼠外周血中TNF-α与IL-2水平、以及相应的mRNA进行了检测,以阐明毛尖蘑粗多糖如何影响H22肝癌小鼠的免疫功能,为毛尖蘑粗多糖的抗肿瘤作用提供理论依据。
1 材料与方法
1.1 材料
毛尖蘑子实体购于大兴安岭呼玛县韩家园林业局松涛鹿苑公司。环磷酰胺(CTX)为上海华氏制药有限公司天平制药厂产品。红细胞裂解液、淋巴细胞分离液购于上海新睿生物科技有限公司。TNF-α、IL-2酶联免疫双抗体夹心(ELISA)试剂盒购于深圳赛保尔生物药业有限公司。总RNA提取试剂盒、反转录cDNA合成试剂盒购于Promega生物公司。Trizol试剂购于Invitrogen公司。β-actin多克隆抗体来自北京北京康为世纪生物科技有限公司。昆明种小鼠雌性为佳木斯大学实验动物中心提供。小鼠H22肝癌细胞株为哈尔滨医科大学肿瘤研究所惠赠。
1.2 方法
1.2.1 毛尖蘑粗多糖提取
根据文献报道,采用热水浸提方法改良[1]。
1.2.2 建立小鼠肝癌模型以及药物处理
将小鼠腹水瘤以生理盐水制成肿瘤细胞悬液,浓度5×106个/mL,注于小鼠右前肢腋下0.2mL/只,制作荷瘤鼠模型,共40只。24h后,将小鼠随机分成4组,每组以不同的处理因素进行干预,一组为肿瘤对照组(对照组):无任何干预;一组为阳性药物对照组(CTX组):给予CTX,25mg/kg·d,每日1次,腹腔注射;其他两组为毛尖蘑粗多糖低剂量、高剂量组:低剂量组给予毛尖蘑粗多糖20mg/mL,高剂量给予40mg/mL,腹腔注射,每日1次,连续14d。每日观察,隔日称重。
1.2.3 检测荷瘤小鼠血清TNF-α、IL-2的水平
各组小鼠14d后,外周血采血,4 ℃、3,000r/min离心10min,吸取血清,ELISA法检测各组小鼠血清中TNF-α和IL-2的水平,实验步骤按试剂盒说明书操作。
1.2.4RT-PCR检测TNF-α、IL-2mRNA的表达
应用淋巴细胞分离液分离小鼠的外周血中的PBMC,调整细胞浓度至2×106个细胞/mL,于24孔细胞培养板中各加0.5mL的细胞悬液,在培养箱中(5%CO2、37 ℃)培养48h。加入Trizol,按照说明书提取细胞的总RNA。应用一步法反转录试剂盒转录,PCR扩增,25μL为总反应体积。TNF-α引物序列(460bp):上游:5’-TGGCCCAGACCCTCACA-3’,下游:5’-TGCCCGGACTCCGTGAT-3’;IL-2引物序列(502bp):上游: 5`-ATGTACAGCATGCAGCTCGCATC-3`,下游: 5`-GGCTTGTTGAGATGATGCTTTGACA-3`;β-actin序列:上游: 5`-ATGGGTCAGAAGGACTCCTATGTGG-3`,下游: 5`-CGCCTAGAAGCACTTGCGGTG-3`。TNF-α的反应条件为94 ℃变性30s,55 ℃退火30s, 72 ℃延伸30s,共30个循环,72 ℃延伸5min。4 ℃终止。IL-2的反应条件为94 ℃变性30s,57 ℃退火45s,72 ℃延伸30s,共30个循环,72 ℃延伸7min。4 ℃终止。内参为β-actin。应用图像灰度扫描系统进行灰度值测定,计算与β-actin比值,得到mRNA相对含量。
1.3 统计学方法
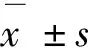
2 结果
2.1 毛尖蘑粗多糖的提取
用苯酚-硫酸法测定了毛尖蘑子实体中提取的固形物中多糖的含量为97.5%。
2.2 血清中IL-2 和 TNF-α的变化
IL-2 水平在模型组低于正常组(P<0.05),TNF-α无明显变化,毛尖蘑粗多糖组IL-2 和TNF-α较模型组明显增加(P<0.05)。
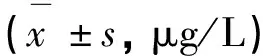
表1 毛尖蘑粗多糖对小鼠血清IL-2和TNF-α水平的影响
注:与模型比较,*P<0.05;与正常组比较,#P<0.05。
2.3 TNF-α 和IL-2 mRNA的表达
如表2、图1显示,IL-2、TNF-α的PCR结果在502bp和460bp处出现条带,条带灰度值经扫描分析,差异具有显著性(P<0.01)。
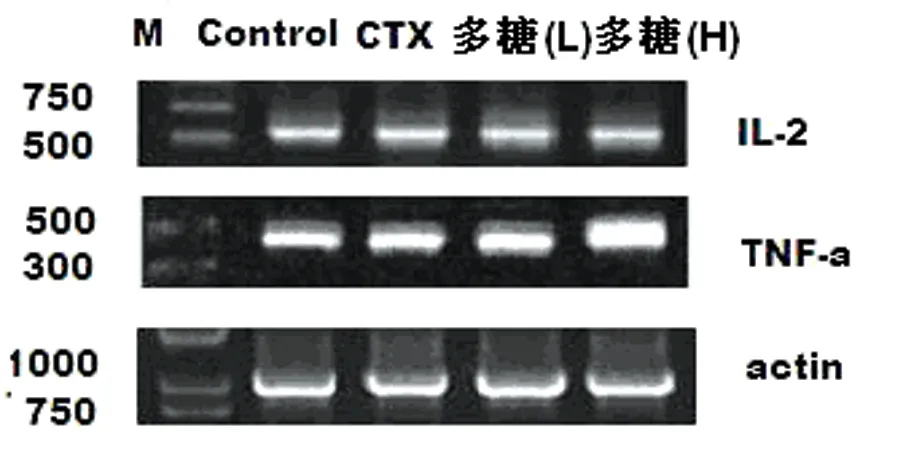
图1PBMC中IL-2、TNF-αmRNA表达
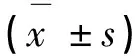
表2 毛尖蘑粗多糖对PBMC IL-2、TNF-αmRNA表达的影响
注:与模型对照组比较,**P<0.01
3 讨论
研究显示,TNF-α与IL-2是免疫系统中起重要作用的调节因子,调节T、B细胞的增殖、分化等免疫功能,并参与各种免疫反应以及炎症反应。肿瘤免疫中,TNF-α与IL-2二者协同发挥抗肿瘤作用[3]。经过炎症介质、内毒素、白细胞介素-1等物质的刺激,单核/巨噬细胞活化,活化后主要分泌肿瘤坏死因子,它是一种小分子蛋白质。根据不同的基因结构及功能, 肿瘤坏死因子分为TNF-α、TNF-β两种。单核/巨噬细胞主要分泌的是TNF-α, 而TNF-β主要由活化的T淋巴细胞产生。TNF-α具有直接的抗肿瘤作用,以自分泌的方式作用于分泌的细胞,在病变部位产生,并集中于局部区域,具有选择性,被认为是一种多功能的细胞因子[4]。IL-2为T细胞生长因子,对T细胞的活化、增殖具有促进作用,是重要的可溶性因子,也是细胞因子网络性调节的核心,对细胞免疫、体液免疫以及非特异性免疫功能具有重要意义。目前,国内外文献报道显示, 晚期肿瘤患者或者荷瘤动物体内IL-2产生的含量明显比正常人低,同时,IL-2 活性也明显低于正常人, 这可能是癌症晚期患者或者荷瘤动物诱生了某些抑制性的细胞群,这些细胞群产生了免疫抑制因子,非特异性抑制了IL-2产生与活性,或者因为IL-1等这些IL-2生成必需的淋巴因子活性减弱引起[5]。 毛尖蘑是黑龙江省特有的食、药用真菌,天然绿色食品。其多糖具有抗肿瘤,保肝护肝,增强免疫力等作用[2]。对此,我们进一步研究了毛尖蘑粗多糖组对TNF-α和IL-2的影响,经过实验证明,荷瘤小鼠在灌胃2周后,TNF-α和IL-2水平明显升高,mRNA表达增强。由此,我们可以认为,毛尖蘑粗多糖促进免疫细胞分泌TNF-α和IL-2,这是通过促进了外周血单个核细胞的TNF-α和IL-2mRNA的转录。毛尖蘑粗多糖能通过调节TNF-α和IL-2分泌发挥了抗肿瘤作用。
[1]范晓艳,吕冬霞,刘爽,等. 毛尖蘑粗多糖提取方法的研究[J].黑龙江医药科学,2010,33(4): 20-21
[2]吕冬霞,范晓艳,金岳雷,等. 毛尖蘑子实体粗多糖对H22荷瘤小鼠的抑瘤作用[J].中国老年学杂志,2012,32(11):2303-2304
[3]MargolinKA.Interleukin-2inthetreatmentofrenalcancer[J].SeminOncol,2000,27(2):194-203
[4]孙云晖,代立娟. 肺癌中PPAR-和TNF-的表达及临床意义[J].黑龙江医药科学,2008,31(1):12-13
[5]王丽娟,孙蕾,王振东.葛根素对U14宫颈癌小鼠免疫和氧化功能的影响[J].黑龙江医药科学,2011,34(4):42-43
佳木斯大学校级重点项目,编号:Sz2013-002。
罗文哲(1976~)男,黑龙江佳木斯人,在读硕士研究生,副教授。
吕冬霞(1965~)女,黑龙江佳木斯人,博士,教授,硕士研究生导师。E-mail: luo228071luo@163.com
R737.9
A
1008-0104(2015)04-0037-02
2014-12-22)

