放牧强度对克氏针茅草原的土壤酶活性和养分影响
张凤杰,乌云娜,宋彦涛,霍光伟
(大连民族学院 环境与资源学院,辽宁 大连116605)
克氏针茅(stipa krylovii )草原是内蒙古高原分布最广泛的典型草原之一,也是中国温带半干旱草原区分布最集中、最具代表性的草原生态系统类型,更是中国北方地区最重要的生态防护屏障,在中国畜牧业生产中占有非常重要的地位。
自20 世纪80 年代开始实施草原草畜双向承包制以来,克氏针茅草原草畜循环功能逐渐失调,导致草地退化严重[1]。克氏针茅草原退化不仅是草地植被演替波动,优势种组成变动和生长型变异,更重要的是地表裸露增加,土壤风蚀严重,土壤表层养分锐减,草地物质循环能力下降,土壤环境质量面临严重的威胁。土壤微生物是草地土壤生态系统的最活跃的组成部分,是土壤中物质循环的调节者和能量流动的推动者,土壤微生物和根系分泌物的强大生物化学活力构成了土壤活性养分的库和源,参与土壤中碳、氮、磷等养分腐殖化和矿化过程,对土壤养分的供给和转化具有重要意义。土壤酶主要来自土壤微生物、植物、动植物残体,酶活性的大小反映了土壤中养分的转化能力和土壤生物活性,是土壤生物化学特征的重要组成部分,也是衡量生态系统土壤质量变化的预警和敏感指标[3]。因此,利用土壤酶活性来确定土壤生产力,评估因过度放牧引起草地退化过程土壤养分和微生物波动已经成为土壤微生态学研究的重要领域[4-5]。本研究以克氏针茅草原为研究对象,分析不同放牧强度对土壤养分和土壤酶活性的影响及其相互关系,为克氏针茅草原生态系统的保护、恢复和重建提供科学依据。
1 材料与方法
1.1 研究区域自然概况
研究区位于内蒙古自治区呼伦贝尔市新巴尔虎右旗境内克鲁伦河流域的中温型典型草原区。地理位置N 47°36'-49°50'、E 115°31'-117°43',气候属于温带半干旱季风气候,年降水量250 mm~400 mm,湿润度0.5 ~0.7,年均温-3 ~0 ℃,全年≥10 ℃的活动积温1600 ~2000 ℃,潜在年蒸发量为950 mm ~1900 mm,土壤类型主要为栗钙土和黑钙土。植物种类主要有克氏针茅(Stipa krylovii)、羊草(Leymus chinensis)、糙隐子草(Cleistogenes squarrosa)、黄囊苔草(Carex korshinskyi)、冷蒿(Artemisia frigid)等[6]。
1.2 实验设计
2013 年7 月末至8 月初植物生长季,在研究区域以空间演替系列代替时间演替系列的方法,以代表性克氏针茅草原优势种的变化为依据选取轻度放牧(轻牧)、中度放牧(中牧)、重度放牧(重牧)三个研究样地。轻度放牧样地围栏封育时间为2001 年,中牧放牧样地为轮牧活动,重牧放牧样地为自然放牧区,常年受到放牧压力的影响,具体样地自然状况见表1。

表1 样地基本自然概况
1.3 样品采集和分析方法
在每个样地的典型地段设置3 条50 m 样线,每条样线上每隔10 m 设置一个50 cm × 50 cm样方,共计10 个样方。在每个小样方中心部位用100 cm3环刀取0 ~10 cm 土壤样品,充分混合均匀土壤,实验设3 次重复。将土样保鲜带回实验室,去除植物根系和砾石,改成:风干,过筛,用于土壤理化性质和土壤酶活性的测定。
土壤样品经风干后,研磨过筛,贮存于广口瓶中,4 ℃保藏备用。土壤基本理化性状采用常规分析法测定[7]。土壤样品的全磷(钼锑抗比色)、速效磷(碳酸氢钠浸提- 钼锑抗比色法)、全氮、铵态氮和硝态氮(半微量凯氏定氮法)和有机质含量(重铬酸钾氧化-外加热法);蔗糖酶采用3,5二硝基水杨酸比色法;过氧化氢酶高锰酸钾滴定法;磷酸酶采用磷酸苯二钠比色法,脱氢酶采用氯化三苯基四氮唑(TTC)比色法[8]。
1.4 数据统计分析
数据进行同质性和正态分布检验,对土壤有机质、全氮、全磷、有效磷、铵态氮和硝态氮,土壤过氧化氢酶、磷酸酶、脱氢酶和蔗糖酶进行单因素方差分析;以放牧强度为固定因子对这些指标进行双因素方差分析;用Person 相关分析法对各指标进行相关分析、双侧检验;Scheffe 法比较均值间的差异性,显著性水平a=0. 05,所有统计用SPSS 19.0 (SPSS Inc.,USA)完成。
2 结果与讨论
2.1 放牧强度对草原土壤养分的影响
在轻牧、中牧和重牧3 个代表性样地土壤的各种养分含量分别见表2。

表2 放牧强度对土壤养分的影响
从表2 可以看出,不同放牧强度3 个样地表层土壤的有机质、全氮、全磷、硝态氮、铵态氮和有效磷含量都随着放牧强度的增大,养分含量明显下降,差异极显著(p <0.01)。轻度放牧土壤养分含量最高,中度放牧土壤养分含量居中,而重度放牧土壤养分含量最低。重度放牧土壤同轻度放牧土壤养分含量相比,有机质、全氮、全磷、硝态氮、铵态氮和有效磷含量分别下降了49. 3 %、68.8 %、62.5 %、99.4 %、38.4 %、58.2 %,其中土壤有效态养分中硝态氮的影响最大;中度放牧同轻度放牧相比,养分含量下降幅度相对较小,其中有机质和铵态氮下降了16.3 % 和16.4 %,而硝态氮和有效磷分别下降了76. 3 %、50. 7 %。由此可见,放牧强度对土壤养分循环产生明显影响,随着放牧强度的增加,土壤养分下降明显。这与高雪峰等人[9]在羊草草原的研究结果相一致。
2.2 不同放牧强度对草原土壤酶活的影响
克氏针茅草原不同放牧条件下酶活性值反映出土壤中土壤酶活性的变化趋势,见图1。放牧强度对脱氢酶和磷酸酶没有显著影响(P >0.05);放牧强度对过氧化氢酶和蔗糖酶有显著影响(P <0.05)。过氧化氢酶和蔗糖酶活性随放牧强度的增加而降低,并在轻牧样地土壤两种酶活性显著高于中牧和重牧样地的土壤酶活性,中牧和重牧样地两种酶活性都无明显差异。上述研究结果表明放牧强度对由不同植物群落土壤的影响是不同的,土壤水热条件的改变影响不同草地植物生长及其微生物的生存和繁衍,从而对土壤酶活性产生间接作用。

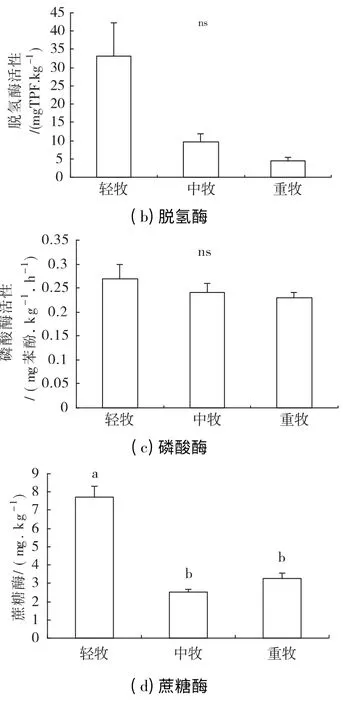
图1 放牧强度对土壤酶的影响
2.3 相关性分析
不同放牧强度的土壤养分含量和土壤酶活性之间相关关系不同(见表3)。克氏针茅草原土壤过氧化氢酶活性与土壤有效磷含量达到了显著正相关(P <0.05);土壤脱氢酶与土壤硝态氮和有效磷含量均达到了显著正相关(P <0.05);蔗糖酶活性与土壤有效磷含量之间达到了显著正相关(P <0.05)。以上结果说明,呼伦贝尔克氏针茅草原土壤磷酸酶、脱氢酶酶、蔗糖酶和过氧化氢酶活性与土壤养分有密切的关系。
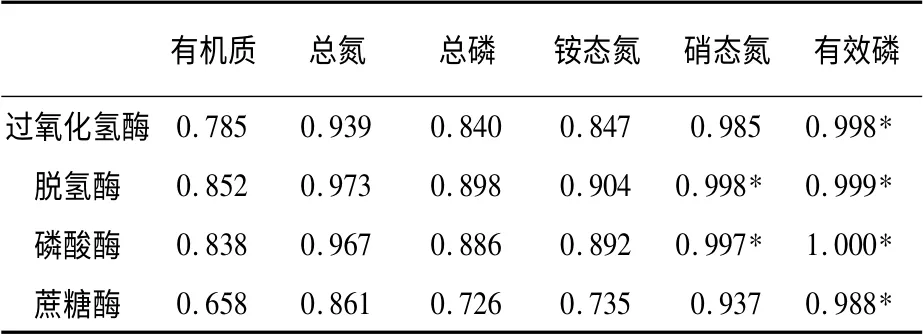
表3 土壤养分与土壤酶活性的相关系数
3 讨论与结论
放牧作为一种典型的人为干扰,不仅直接导致自然植被发生相应变化,还通过采食活动及畜体对营养物质的转化影响草地营养物质循环,深刻影响着土壤生态系统的养分形态和分布[10]。放牧强度对土壤养分含量影响显著。不同植被类型草原在放牧影响下土壤有机质含量均下降,这主要是因为土壤有机质的含量取决于草原生物量的生产与分解的平衡状态以及土壤储存有机质的能力,随着放牧强度的增加,家畜啃食牧草量增加,而残留归还给土壤的有机物减少,草原生物量生产与分解的平衡状态失衡,从而导致土壤有机质含量下降,牛得草和高雪峰也有同样的研究结果[11-12]。随着放牧强度的增大,植物根冠比增大[13],蕴育土壤根系的基质量逐渐减少,表层根土比例增加引起归还土壤中有机质的数量逐渐减少,即微生物利用的碳源、氮源减少[14];同时微生物数量和微生物量随着放牧强度的增大而增加[13],土壤微生物代谢速率加快,引起土壤中养分循环加快,土壤中的养分随放牧强度的增加而显著下降,这与本研究结果基本一致。
呼伦贝尔克氏针茅草原是中国代表性的温带半干旱草原,水热条件季节和年度波动较大[15]。因此,由土壤微生物分泌的土壤酶数量和活性会受土壤环境水热条件的影响,进而影响土壤生物化学反应强度及养分循环的速度,对土壤养分释放和储存产生影响。研究发现呼伦贝尔克氏针茅草放牧样地土壤养分和土壤酶活性(过氧化氢酶、磷酸酶、脱氢酶和蔗糖酶)均随着放牧强度的增加而显著降低,说明放牧强度不同干扰了土壤养分平衡和土壤微生物的数量进而影响了土壤微生物生理生化反应机制,进而降低了土壤酶的活性,破环了土壤的养分平衡。因此,对放牧方式应采取人为干扰措施,建立合理的草地利用制度,才能实现克氏针茅草原的可持续发展和利用。
[1]赛西雅拉图,白丽艳,张萍.2000 -2010 年克氏针茅放牧草地资源的变化[J].草业科学,2014,31(4):607 -613.
[2]刘恩科,赵秉强,李秀英,等. 长期施肥对土壤微生物量及土壤酶活性的影响[J].植物生态学报,2008,32(1)176 -182.
[3]GAN L,PENG X,PETH S R. Horn. Effects of grazing intensity on soil thermal properties and heat ux under Leymus chinensis and Stipa grandis vegetation in Inner Mongolia,China[J]. Soil & Tillage Research,2012,118:147 -158.
[4]霍光伟,乌云娜,雒文涛,等. 围栏封育和自由放牧对克氏针茅草原植被空间异质性的影响[J].生态学杂志2012,31(1):66 -73.
[5]TEAGUEA W R,DOWHOWER S L,BAKER S A,et al.Grazing management impacts on vegetation,soil biota and soil chemical,physical and hydrological properties in tall grass prairie[J].Agriculture,Ecosystems and Environment,2011,141:310 -322.
[6]乌云娜,雒文涛,霍光伟,等. 草原群落退化演替过程中微斑块土壤碳氮的空间异质动态[J]. 生态学报,2014,34(19):5549 -5557.
[7]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[8]关松荫.土壤酶及其研究法[M]. 北京:农业出版社,1986.
[9]FTERICH A,MAHDHI M,MARS M.Impact of grazing on soil microbial communities along a chronosequence of Acacia tortilis subsp. raddiana in arid soils in Tunisia[J].European Journal of Soil Biology,European Journal of Soil Biology,2012,50:56 -63.
[10]文都日乐,张静妮,李刚,等.放牧干扰对贝加尔针茅草原土壤微生物与土壤酶活性的影响[J].草地学报,2010,18(4):517 -522.
[11]牛得草,江世高,秦燕,等. 围封与放牧对土壤微生物和酶活性的影响[J].草地科学,2013,30(4):528-534
[12]高雪峰,韩国栋. 利用强度对草原土壤酶活性和养分影响的动态研究[J]. 干旱区资源与环境,2011,25(4):166 -170.
[13]雒文涛,乌云娜,张凤杰,等. 不同放牧强度下克氏针茅(Stipa krylovii)草原的根系特征[J]. 生态学杂志,2011,30(12):2692 -2699.
[14]王长庭,王启兰,景增春,等. 不同放牧梯度下高寒小嵩草草甸植被根系和土壤理化特征的变化[J].草业学报,2008,17(5):9 -15.
[15]乌云娜,张凤杰,裴浩,等. 克鲁伦河流域生长季有效温水组合对草原群落生物量的影响[J].草业学报,2012,21(2):227 -232.

