蚯蚓自溶酶对菜粕中植物蛋白的影响
(河北省迁安市第一中学064400)
蚯蚓自溶酶对菜粕中植物蛋白的影响
周丽娜(河北省迁安市第一中学064400)
蚯蚓体内有极高活性的蛋白水解酶等酶类,利用这些酶水解自体蛋白,使之成为可溶性的小分子活性肽和氨基酸。蚯蚓中的氨基酸组成与禽畜体内组织蛋白质的氨基酸的组成相仿,并且水解产物中含有抗病和促进动物生长等多种功能的活性多肽。本实验为研究蚯蚓对菜粕中的植物性蛋白的水解作用,为利用蚯蚓处理植物蛋白,生产新型高质廉价饲料提供实验依据。
蚯蚓自溶酶菜粕植物蛋白质聚丙烯酰胺凝胶电泳
蚯蚓蛋白可作为优质蛋白饲料或作为饲料添加剂,而且能提高动物的免疫力。菜粕为常用的植物蛋白饲料,但其适口性差、消化吸收利用率低。本研究利用蚯蚓自溶酶水解蛋白质的作用,将蚯蚓匀浆与菜粕在一定条件下混合反应,得到较短肽链或氨基酸,从而改变蛋白质原有结构。最终得到一种新型的、成本低的、高品质的蛋白饲料。
一、材料和方法
(一)仪器
匀浆打碎机,电热鼓风干燥箱,HH-S数显恒温水浴锅,冰箱,电子天平,KS康式振荡器,DYY-ⅢⅠ型稳压电泳仪,JY-SCZ2型双垂直板式电泳槽,TDL-60B离心机,烧杯200mL(16支),50mL(16支),小密封塑料袋(若干),离心管,容量瓶(50mL),棕色试剂瓶,培养皿,量筒,注射器,针头,微量移液器。
(二)试剂
蒸馏水,0.9%NaCl溶液,0.1%NaCl溶液,丙烯酰胺,甲叉双丙烯酰胺,三羟甲基氨基甲烷,1mol·L-1HCl,甘氨酸,十二烷基磺酸钠,过硫酸铵,甘油,2-巯基乙醇,0.025%溴酚蓝溶液,四甲基乙二胺,考马斯亮蓝R250,冰醋酸溶液,低分子量标准蛋白。
(三)试剂的配制
1.母液的配制:30%丙烯酰胺溶液:取29.2g丙烯酰胺,0.8g甲叉双丙烯酰胺,加水至100mL,过滤,棕色试剂瓶避光保存;
5mol·L-1Tris-HCl分离胶缓冲液,pH8.8(8X):取18.15gTris,用1mol·L-1HCl调pH至8.8,加水至100mL,4℃保存;
1.0mol.L-1Tris-HCl浓缩胶缓冲液,pH6.8(8X):取12gTris,用1mol·L-1HCl调pH至6.8,加水至100mL,4℃保存;
电极缓冲液,pH8.3(1X):取28.8g甘氨酸,6.04gTris,加10mL 10%SDS,加水至1L,室温保存;
10%SDS溶液:取10g SDS,加水至100mL,完全溶解后室温保存;
10%过硫酸铵溶液:取0.1g过硫酸铵,加水至1mL,每次用前新鲜配制。
2.染色液的配制:考马斯亮蓝0.25%,甲醇50%,醋酸10%,加水至100%。
3.脱色液的配制:甲醇40%,醋酸10%,加水至100%。
4.标准蛋白的使用:开封后溶于200μL重蒸水,分装于20个小管内,再于每小管内加入等体积的2倍样品缓冲液,于沸水浴中加热5min后,置于-20℃保存。使用前置室温融化后,沸水浴中加热3-5min。
5.样品缓冲液(2X)的配制,见表1。(四)分离胶和浓缩胶的配制
1.分离胶(10%)的配制,见表2。
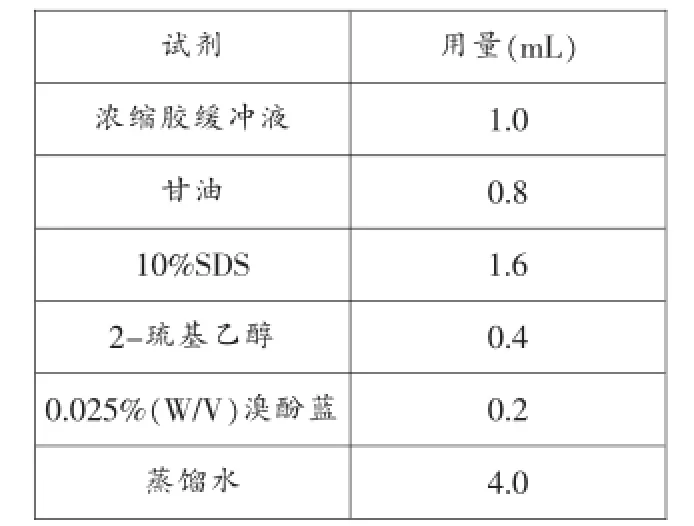
表1 样品缓冲液制试剂用量表
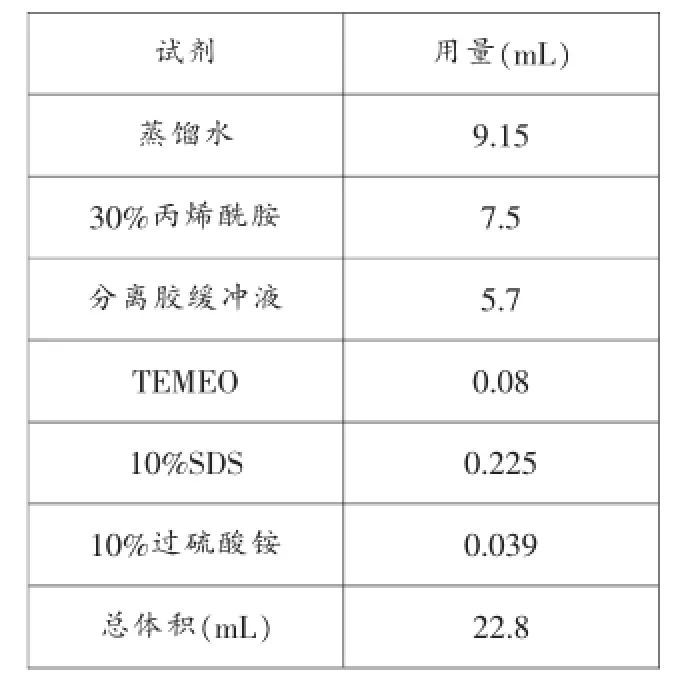
表2 分离胶配制试剂表
2.浓缩胶(4%)的配制,见表3。
(五)步骤
1.鲜蚓(约500g)放在大烧杯中清洗,然后用匀浆打碎机将其打碎,得匀浆约500ml,加生理盐水60ml,放在冰箱内保存。
2.按表4的方法配制分组样品,并在40℃下进行反应。
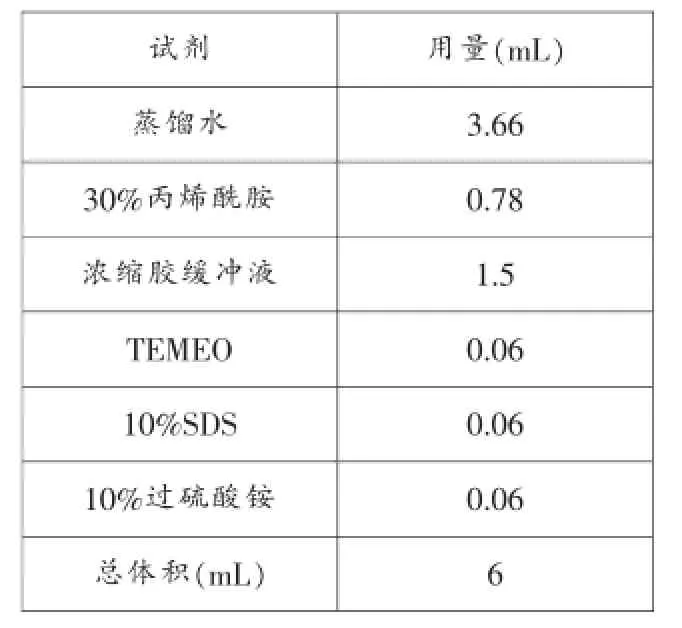
表3 浓缩胶配制试剂表
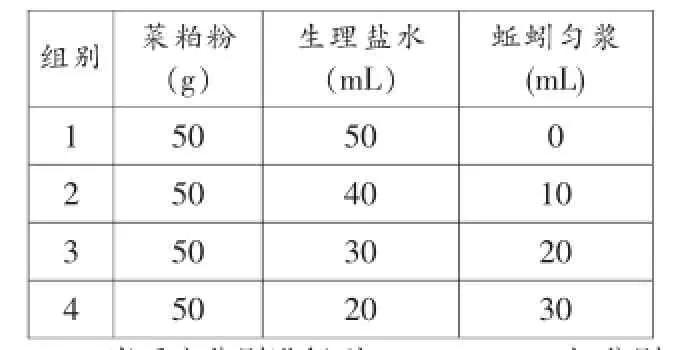
表4 样品配制
3.当反应分别进行到2h,4h,6h,8h时,分别从各组锥形瓶中取反应产物5-6药匙置于培养皿中,再将其放入电热鼓风干燥箱中在温度为55℃下烘干,然后将烘干物质分别放在小塑料袋中,并进行标记后放入冰箱内保存,共得到不同配比、不同反应时间的4组共16个样品,以备后用。
4.分别从16个样品塑料袋中取出干燥物质0.2g放于16支锥形瓶中并标记,分别加入10mL 0.1%NaCl溶液将锥形瓶置于振荡器上振荡浸提约1h。
5.离心:将浸提后的反应物分别移入离心管中,标记,放入离心机中在5000r·min-1的情况下离心5min,完毕,将上清液移入小试管中,标记,放入冰箱保存,以备后用。
6.凝胶的灌制:安装制胶板前用洗涤剂将玻璃板洗净,将白塑料框下沿的窄缝用密封胶带贴好,确保密封;把制胶板垂直放好,将新配制的分离胶溶液迅速用注射器缓慢加入制胶板之间,直至液面达到距梳子下缘1cm处。用注射器将蒸馏水注入分离胶上层,以隔绝空气并使液面平整;分离胶聚合后,倒掉蒸馏水,用滤纸吸去残液,用注射器迅速在制胶板中加满新制浓缩胶溶液,插入相应厚度的10齿梳子。
7.加样:浓缩胶聚合后除去梳子、密封胶带以及6个铁夹。取出样品离心后的上清液,用微量加样器取样并在梳井内加样。通常每个加样孔上样量20μg,将样品体积20μL与样品缓冲液20μL混合均匀,取适量加于加样孔底部。完毕,将制胶板(2块),电泳槽内芯放入槽内,使制胶板的玻璃板均与电泳槽内芯接触,然后插入楔型板以固定两套制胶板。在内外水槽加注电极缓冲液,使内外水槽的液面均超过玻璃板上沿但低于塑料板上沿。
8.电泳:盖好电泳槽上盖,在100-150V电压下电泳2h,直至样品指示剂到达玻璃板的下缘,关闭电源,拔掉楔型板,取下制胶板,用刀片将浓缩胶切掉,将分离胶的左上角切掉一小角以标记样品顺序。
9.染色:将电泳好的凝胶板取出,手带橡胶手套将凝胶小心移入染色器皿中。加入考马斯亮蓝染液R250,加盖,在摇床上染色2h。将染色液倒出,加入100mL脱色液,脱色3h。
10.将反应物蛋白质电泳结果与标准蛋白电泳结果进行比较大致确定反应产物中所含蛋白质。
二、结果
(一)按表4的方法配制4组样品按不同的反应时间取样,编号见表5
(二)低分子量标准蛋白质的组成及分子量,见表6
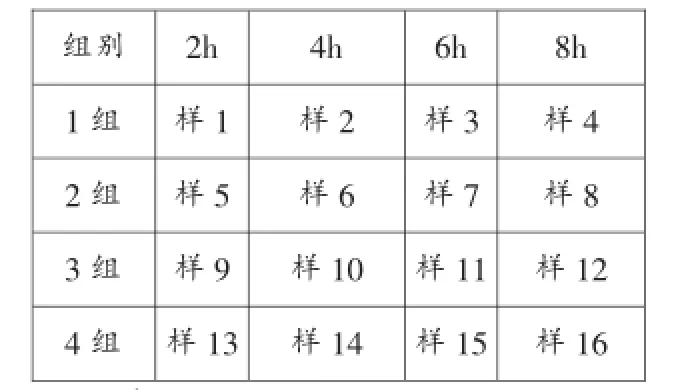
表5 各组样品按不同反应时间的取样编号
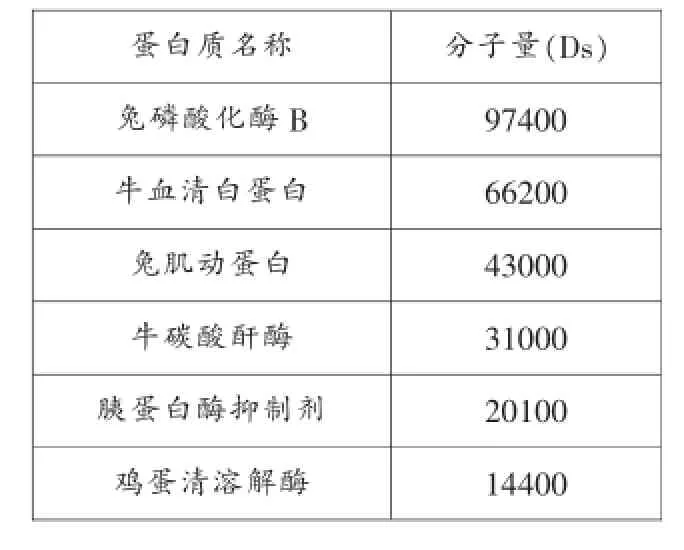
表6 低分子量标准蛋白质的组成
(三)标准蛋白质及按表5取样的电泳结果,见图1和图2
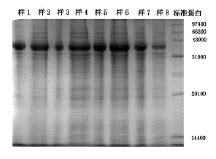
图1 样1-样8的电泳结果
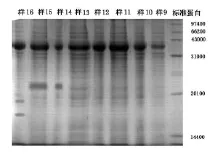
图2 样9-样16电泳结果
(四)蚯蚓自溶酶对菜粕中植物蛋白的影响
从样品的电泳结果可知,蚯蚓体内的自溶酶等酶类对菜粕中植物性蛋白的水解作用随着蚯蚓匀浆量的增加而增大;从反应时间角度来看,随着时间的延长,各组样品的电泳条带逐渐加长,即蚯蚓自溶酶等酶类对菜粕蛋白的水解程度加大。
三、讨论
以上实验结果表明,蚯蚓体内蛋白质自溶酶等酶类对植物性蛋白质有较明显的分解作用,利用蚯蚓自溶酶等酶类确实可以水解菜粕中的植物蛋白,菜粕蛋白被水解成小分子量的蛋白或短肽,蛋白结构被改变,从而为将低质蛋白原料开发为高效饲料蛋白提供了借鉴方法,为开发禽畜食用饲料提供了有效途径。
[1]路英华,金汝娥.蚯蚓纤溶酶的提取、性质鉴定和溶腺血的研究[J].兰州大学学报,1986,22(1)∶95-100.
[2]程牛亮,王新亚,郑国平等.双胸蚯蚓纤溶酶Ⅱ的纯化及性质研究[J].生物化学杂志,1996,8(2)∶8-10.
(责编 赵建荣)

