不同提取方法对海蒿子多糖性质的影响研究
扶 雄,李湘师,游丽君,,*,刘 冬
(1.华南理工大学轻工与食品学院,广东广州 510640;2.深圳职业技术学院 深圳市发酵精制检测系统重点实验室,广东深圳 518055)
不同提取方法对海蒿子多糖性质的影响研究
扶 雄1,李湘师1,游丽君1,2,*,刘 冬2
(1.华南理工大学轻工与食品学院,广东广州 510640;2.深圳职业技术学院 深圳市发酵精制检测系统重点实验室,广东深圳 518055)
海蒿子多糖是存在于海洋褐藻植物海蒿子细胞内和细胞间的一种天然大分子物质,具有多种生物活性。本研究比较了传统水提法、柠檬酸提取法、超声法、超声波辅助水提法、超声波辅助柠檬酸提取法五种方法提取海蒿子多糖的性质区别。结果表明采用柠檬酸法提取海蒿子多糖得率最高,可达5.31%,是传统水提法的1.8倍。并且,不同方法提取的海蒿子多糖分子量大小存在差异性,其中传统水提法提取多糖的分子量为739.663ku,约是超声法提取多糖分子量大小的19倍。通过不同抗氧化能力评价指标的测定表明传统水提法提取多糖的DPPH·清除能力在浓度0.5mg/mL时为54.77%,ABTS+清除能力在浓度0.25mg/mL时为74.59%,还原力在浓度0.3mg/mL时为1.381,氧自由基吸收能力(ORAC)值可达5404.90μmol Trolox/g。且硫酸基含量最高,为12.28%,具有较好的抗氧化活性。因此,采用传统水提法工艺来提取多糖更利于维持海蒿子多糖的功能活性,便于进一步的深入研究。
海蒿子,多糖,柠檬酸提取,分子量,抗氧化
海蒿子(Sargassumpallidum)习称“大叶海藻”,是生长在暖温带水域的褐藻门(Brown algae)马尾藻科(Sargassacean)植物,在我国的渤海、黄海、东海等区有广泛的分布。颜色为暗褐色,是典型的海洋褐藻,性味苦咸,寒。入脾、肾、肺。功能主治利水,泄热,疼痛核肿,慢性气管炎等,在《本经》《别录》《药性论》《海药本草》等中均有记载,具有很高的药用价值。对褐、红、蓝、绿海藻的多糖研究表明褐藻多糖具有比较显著的生物活性,开发前景十分广阔。海蒿子作为历代本草收录的海洋褐藻之一,不仅含有丰富的营养成分,如:蛋白质(亲糖蛋白)、藻胶酸、不饱和脂肪酸、钾、碘外,而且含有大量的褐藻多糖,主要组成包括褐藻胶、褐藻糖胶和褐藻淀粉。褐藻多糖是一种水溶性活性多糖,是国内外关于海洋藻类活性物质研究的热点之一。已发现的褐藻门马尾藻科植物的活性多糖具有抗血栓[1]、抗病毒[2]、抗肿瘤、免疫调节功能[3]等,但目前关于海蒿子活性多糖方面的研究有少量报道,内容涉及抗氧化、抗肿瘤[4]、降血脂[5]等方面。因此,有必要进一步开展对海蒿子活性多糖的提取和功效研究,以便开发利用丰富的海洋藻类资源。
植物多糖的提取广泛采用水溶剂,且在酸溶液或超声波环境下可强化多糖的提取。本实验采用传统水提法、柠檬酸提取法、超声法、超声波辅助水提法和超声波辅助柠檬酸法五种方法提取海蒿子多糖,并比较不同方法对海蒿子多糖的得率、分子量、硫酸基含量以及抗氧化活性的影响,为海蒿子多糖的活性研究和开发利用奠定基础。
1 材料与方法
1.1 材料与仪器
海蒿子 购自元真堂;ABTS(2,2-Azino-bis(3-ethylbenzothia-zoline-6-sulfonic acid))、Trolox(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid)、AAPH(2,2′-azobis(2-methylpropionamidine)-dihydrochloride)、DPPH(2,2-diphenyl-1-picrylhydrazyl)、Fluorescein均购自Sigma公司。磷酸氢二钠、磷酸二氢钠、无水乙醇、95%乙醇、苯酚、柠檬酸、铁氰化钾、过硫酸钾、硫酸钾、三氯乙酸、明胶、氯化钡、氯化铁、葡萄糖均为分析纯。VC为食品级。
中药粉碎机 天津市泰斯特仪器有限公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;RV10数显型旋转蒸发器 广州市东南科创科技有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;电子天平 梅特勒-托利多仪器(上海)有限公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;数显式电热恒温水浴锅 常州澳华仪器有限公司;721G可见分光光度计 上海精科;DL-5C型低速台式离心机 上海安亭科学仪器厂;Scient Z-18N冷冻干燥机 宁波新芝生物科技股份有限公司;荧光化学分析仪 Thermo公司;7890A GC System Agilent Technologies公司。
1.2 实验方法
1.2.1 海蒿子原料预处理 将海蒿子饮片在45℃下烘干,粉碎后过32目筛,装于密封袋中,置于干燥器中储备。海蒿子粉末至于圆底烧瓶,按1∶8(g/mL)加入95%的乙醇,先浸泡0.5h,用电热套加热回流3h,真空抽滤(200目的滤布),弃去上清液,得滤渣(去除原料中的油脂、色素、低聚糖和小分子物质等),40℃的烘箱中进行干燥,储存备用。
1.2.2 海蒿子多糖的提取
1.2.2.1 传统水提法提取海蒿子多糖 取经过预处理的海蒿子粉末10g,按1∶20(g/mL)比例加入去离子水,100℃下提取2h,提取物抽滤得一次滤液,将滤渣按上述方法重复提取一次,抽滤,合并滤液,旋转蒸发浓缩提取液,加入4倍体积的无水乙醇,置4℃冰箱中,静置12h,离心,所得沉淀挥发干乙醇,以水复溶,配制成海蒿子粗多糖溶液,为样品TP。
1.2.2.2 柠檬酸法提取海蒿子多糖 取经过预处理的海蒿子粉末10g,按1∶20(g/mL)比例加入柠檬酸溶液(pH2)100℃提取2h,提取物抽滤,滤液用1mol/L NaOH调pH至中性,将滤渣按上述方法重复提取一次,抽滤,调pH至中性,合并滤液,浓缩提取液,其余步骤同1.2.2.1,为样品CP。
1.2.2.3 超声法提取海蒿子多糖 取经过预处理的海蒿子粉末10g,按1∶20(g/mL)比例加入去离子水,于50℃下,功率250W下超声提取20min,提取物抽滤,将滤渣按上述方法重复提取一次,抽滤,合并滤液,浓缩提取液,其余步骤同1.2.2.1,为样品UP。
1.2.2.4 超声波辅助水提提取法 取经过预处理的海蒿子粉末10g,按1∶20(g/mL)比例加入去离子水,于50℃下,功率250W下超声提取20min,提取物抽滤得一次滤液,将滤渣在100℃下水提2h,抽滤得二次滤液,合并浓缩提取液,其余步骤同1.2.2.1,为样品UTP。
1.2.2.5 超声波辅助柠檬酸提取法 取经过预处理的海蒿子粉末10g,按1∶20(g/mL)比例加柠檬酸(pH2)于50℃下,功率250W下超声提取20min,提取物抽滤,滤液用1mol/L NaOH调pH至中性,将滤渣加柠檬酸(pH2)100℃下提取2h,抽滤,调pH至中性,合并滤液,浓缩提取液,其余步骤同1.2.2.1,为样品UCP。
1.2.3 海蒿子多糖含量的测定 采用苯酚-硫酸法[6]测定海蒿子多糖的含量,葡萄糖为标准品。
1.2.4 海蒿子多糖得率的计算
多糖得率(%)=粗多糖质量/海蒿子粉末质量×100
1.2.5 海蒿子多糖分子量的测定 将已知分子量的葡聚糖标准品分别用流动相配制成2.0mg/mL的溶液,采用凝胶渗透色谱法(GPC)测定分子量。色谱条件:色谱柱为TSK-GEL G-5000PWXL凝胶柱和G-3000 PWXL凝胶柱(串联);流动相为0.02mol/L KH2PO4溶液;流速0.6mL/min;进样量20μL;柱温35℃;检测器为Waters2414示差检测器;标准葡聚糖为Dextran系列(Dextran 5200、11600、23800、48600、14800、27300、410000、668000、1400000)。
1.2.6 海蒿子多糖硫酸基含量的测定 采用硫酸钡比浊法[7]测定海蒿子多糖的硫酸基含量,并加以适当改进。精确称量于105℃下干燥至恒重的硫酸钾217.5mg,加1mol/L的盐酸溶解定容至50mL,得硫酸基标准储备液,硫酸基浓度为2.4mg/mL。取0,80,160,240,320,400μL标准溶液,用1mol/L盐酸补至400μL,加入7.6mL的3%TCA和2mL氯化钡明胶溶液,充分混合,室温静置反应15min后,以无硫酸基的溶液按上述处理作为空白,于360nm处测吸光值。分别为以硫酸基含量和吸光值为坐标绘制标准硫酸基含量曲线。
称取20mg海蒿子多糖粉末于安培瓶中,加入2mL 1mol/L盐酸,密封,沸水浴3h。量取反应液400μL于10mL的试管中,加入7.6 mL的3%TCA和2mL氯化钡明胶溶液,同样条件反应后,测吸光值为A1值;同时,为了消除多糖样品溶液中其它因素对紫外吸收的干扰,用明胶试剂替代氯化钡明胶溶液,按上述步骤,测吸光值为A2值,得(A1-A2)值,以硫酸基含量的标准曲线线性回归方程计算海蒿子多糖样品中硫酸基含量。
1.2.7 海蒿子多糖抗氧化活性的测定
1.2.7.1 DPPH自由基清除能力的测定 参考Kargozler[8]等的方法,并作适当修改。以无水乙醇为溶剂配制0.2mmol/L DPPH溶液,避光保存。取2mL的多糖样品溶液(1~5mg/mL)与2mL的DPPH溶液乙醇溶液(0.2mmol/L)混合,震荡,在30℃避光反应30min,在517nm处测吸光值Asample。以2mL的多糖样品溶液和2mL的无水乙醇溶液混合,在同样的条件下测得的吸光度为Ablank。以2mL的无水乙醇和2mL的DPPH溶液乙醇溶液(0.2mmol/L)液混合,在同样的条件下测得的吸光度为Acontrol。其中,样品浓度分别为0.0625、0.125、0.25、0.5mg/mL,VC浓度分别为0.2、0.1、0.067、0.05、0.025、0.025mg/mL。DPPH自由基清除率按如下公式计算。
清除率(%)=1-(Asample-Ablank)/Acontrol×100
1.2.7.2 ABTS自由基清除能力测定 参考Re R[9]等的方法,并做适当修改。配制ABTS储备液:将浓度为4.9mmol/L K4S2O8溶液和14mmol/L ABTS溶液等体积混合,于避光条件下室温反应12~16h后,取适量ABTS储备液,用50%乙醇稀释至734nm波长检测其吸光度为(0.7±0.020)。将样品稀释至不同的浓度梯度,取0.1mL样品稀释液或VC,加2.9mL的ABTS自由基测定液,准确混合震荡30s,反应20min后在734nm处测定得吸光值A样品。对照组用去离子水替代样品,按上述操作,测得吸光值为A对照。其中,样品浓度分别为0.0625、0.125、0.25、0.5mg/mL,VC浓度分别为0.2、0.15、0.125、0.1、0.05、0.025、0.025mg/mL。ABTS自由基的清除率按如下公式计算。
ABTS+清除率(%)=(A对照-A样品)/A对照× 100
1.2.7.3 氧自由基吸收能力(ORAC)测定 参照Hua[10]等的方法,并作适当修改。荧光素FL(终浓度70mmol/L)、自由基产生剂AAPH(12.8mmol/L,现配现用)、Trolox标准溶液(水溶性维生素E)和待测海蒿子多糖样品均用磷酸盐缓冲液(75mmol/L,pH7.40)溶解和梯度稀释。具体操作为:在96多微孔板中依次加入20μL磷酸盐缓冲溶液、20μL多糖样品溶液后,每孔各加入20μL FL(70nmol/L)。用Ascent software version软件设定程序,37℃下混匀孵育20min,迅速在各孔中加入140μL AAPH(12.8mmol/L),自动混匀,开始连续测定荧光强度值(激发波长485nm,吸收波长538nm),各孔测定荧光强度的时间间隔为2min,荧光强度分别记为f0、f1、f2…f60。循环次数一般根据荧光衰减至基线所需时间设定。用软件统计荧光衰减曲线下面积(AUCsample)和(AUCblank)值,计算NetAUC=AUCsample-AUCblank值,按上述公式分别计算不同浓度Trolox(0-100μmol/L)和海蒿子多糖样品的NetAUC值,AUCblank代表不含抗氧化剂存在时对氧自由基作用的对照AUC值。根据Trolox的线性回归方程计算海蒿子多糖的ORAC值,ORAC值以μmolTrolox/g表示。
1.2.7.4 还原力的测定 参考Oyaizu[11]的方法,并作适当修改。将海蒿子多糖样品和VC梯度稀释,取2mL海蒿子多糖样品稀释液,加入2mL磷酸缓冲液(0.2mol/L,pH6.6)和2mL的1%(w/w)铁氰化钾溶液,震荡混合,50℃静置20min后加入2mL 10%(w/w)TCA溶液,离心分离,移取2mL上清液于10mL的试管中,加入2mL蒸馏水和0.4mL 0.1%(w/w)FeCl3溶液,震荡混合,静置反应10min,测吸光值(700nm),按同样步骤测定VC还原力。其中,样品浓度分别为0.0625、0.125、0.25、0.5mg/mL,VC浓度分别为0.2、0.15、0.125、0.1、0.05、0.025、0.025mg/mL。以浓度为横坐标,OD值为纵坐标绘制曲线。
2 结果与讨论
2.1 不同提取方法对海蒿子多糖得率的影响
如图1所示,柠檬酸提取与超声结合柠檬酸提取法多糖得率最高,两者之间无显著性差异;UP多糖得率最低;TP与UTP两者之间无显著性差异。CP多糖得率为5.31%±0.21%,是TP的1.8倍。UP多糖得率仅为1.04%±0.03%,可能由于仅采用超声处理20min,物理破坏植物细胞后进行多糖浸提的时间过短所致。从结果可看出CP和UCP可显著提高多糖得率,这可能是因为柠檬酸是一种弱酸,在该弱酸环境下提取海蒿子多糖时,可有效地降解海蒿子细胞壁组织,使胞间和胞内的多糖溶出,提高得率。这与卢江虹等[12]的报道相一致。

图1 不同提取方法所得海蒿子多糖的得率Fig.1 The extraction yield of Sargassum pallidum polysaccharides注:柱上方不同字母(a~c)代表显著性差异(p<0.05),图2同。

表1 不同提取方法所得海蒿子多糖的分子量分布Table1 The molecular weight distribution of Sargassum pallidum polysaccharides
2.2 不同提取方法所得海蒿子多糖的分子量
表1中可以看出,TP的分子量为739.663ku,约为UP的分子量大小的19倍;CP、UTP、UCP均洗脱出两个峰,含有两个组分。柠檬酸处理和超声处理均可显著降低多糖分子量。多糖链在酸提和超声处理过程中会发生降解和结构的变化。
2.3 不同提取方法对海蒿子多糖硫酸基含量的影响
如图2所示,五种方法提取的海蒿子多糖硫酸基含量相互存在着显著性差异,总体趋势是TP>UTP>UP>UCP>CP。其中,TP硫酸基含量最高,为12.28%±0.67%,约是UTP的1.2倍,UP硫酸基含量的2.3倍,UCP硫酸基含量的3.7倍;CP的硫酸基含量的9.9倍。多糖中硫酸基的含量与多糖的抗氧化活性具有密切的相关性[13],一般硫酸基含量越高,多糖的抗氧化活性越好。此外,酸法和超声处理可引起多糖链结构的断裂,破坏多糖结构的完整性,造成多糖硫酸基的损失。由此,可能TP具有较好的抗氧化活性。

图2 不同提取方法所得海蒿子多糖的硫酸基含量Fig.2 The extraction sulfate content of Sargassum pallidum polysaccharides
2.4 不同提取方法所得海蒿子多糖的抗氧化活性
2.4.1 DPPH自由基清除能力 DPPH自由基在517nm处有强吸收,抗氧化剂与其单电子配对而使吸收逐渐消失,可利用光化学性质进行抗氧化能力的评价。由图3可以看出,TP、UTP为0~0.2mg/mL、UP为0~0.1mg/mL的低浓度范围内随浓度增加清除率反而降低,超过该浓度范围后,则随着浓度的升高清除率逐渐升高。而CP和UCP则一直是随多糖浓度升高清除率升高。总体来看,UCP清除率较高,其次是CP,UP清除率最差。当多糖浓度为0.5mg/mL时,CP、UCP、TP、UTP、UP的清除率分别为72.57%、64.08%、54.77%、54.51%、48.43%。
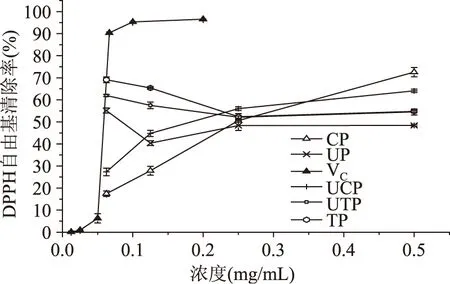
图3 不同提取方法所得海蒿子多糖的DPPH自由基清除能力Fig.3 The DPPH radical scavenging ability of Sargassum pallidum polysaccharides
2.4.2 ABTS+清除能力 由图4可以看出,所有海蒿子多糖样品ABTS+清除率都随浓度的增大而增强。ABTS+清除能力由高到低依次为UTP>UP>TP>UCP>CP,当多糖浓度为0.25mg/mL时,分别达到81.62%、74.65%、74.59%、50.10%、29.32%。当浓度低于0.0625mg/mL的范围内,海蒿子多糖的清除率均略高于同等浓度的VC,当高于0.14mg/mL浓度时,VC的清除率超过海蒿子多糖,但与UTP、UP、TP相差不大。当多糖浓度为0.45mg/mL时,UTP的清除率可达0.18mg/mL VC的96.13%。ABTS自由基清除能力的方法可适用于评价脂溶性和水溶性样品[14],因此,可较全面地评价不同提取方法所得多糖的抗氧化活性。卢江虹[12]采用传统水提法提取海带多糖,当多糖浓度为3mg/mL,ABTS+清除能力为62.55%,低于本文TP的清除能力。

图4 不同提取方法所得海蒿子多糖的ABTS+清除能力 Fig.4 The ABTS+radical scavenging ability of Sargassum pallidum polysaccharides
2.4.3 氧自由基吸收能力(ORAC) 氧自由基清除能力(ORAC)法,基于HAT机制,是一种生物相关性高的抗氧化性评价方法,现在普遍应用于对各种物质的抗氧化评价。基本原理是利用偶氮类化合物AAPH的过氧自由基攻击下,FL荧光素的荧光特性逐渐消失的现象。评价抗氧化物质的抗氧化能力,关键在于抗氧化物质存在下对过氧自由基的清除能力的大小,通常与氧自由基作用下荧光衰减曲线的延迟曲线面积直接相关,即荧光自然衰减曲线下面积减去荧光衰减曲线下面积,最终结果以Trolox当量来表示[15]。
由图5可知,TP和UP之间氧自由基吸收能力无显著性差异,总体趋势是(TP或UP)>UTP>UCP>CP。其中,TP和UP的氧自由基吸收能力最强,可达(5404.90±178.74)μmol Trolox/g和(5136.91±192.27)μmol Trolox/g。UTP、UCP、CP三者之间存在着显著性差异,UTP和UCP分别是(4381.92±142.39)μmolTrolox/g和(1657.79± 148.49)μmol Trolox/g。CP的ORAC值最低,为(1051.51±175.05)μmol Trolox/g。

图5 不同提取方法所得海蒿子多糖的ORAC值Fig.5 The ORAC value of Sargassum pallidum polysaccharides
2.4.4 还原力 由图6可以看出,所有样品都有一定的还原力,均随多糖浓度的升高还原力逐渐增强。同等浓度下VC的OD值显著高于其它样品,0.15mg/mL时就达到1.562。在几种不同方法提取的多糖样品中,TP还原力最高,略强于UTP,在0.3mg/mL浓度时分别达到1.381,1.298。UP和UCP的还原力在浓度为0.3mg/mL时分别达到1.258,0.361。CP还原力最低,在0.3mg/mL时只有0.303。因此,还原力大小顺序依次为:TP>UTP>UP>UCP>CP。还原力的测定是基于抗氧化物质具有提供H·使Fe3+和Fe2+电子转移的抗氧化性评价方法,通常还原力越大,所测样品的抗氧化能力越好。由上述可知,显示出较好的抗氧化活性的样品可能是TP。

图6 不同提取方法所得海蒿子多糖的还原力 Fig.6 The reducing power of Sargassum pallidum polysaccharides
研究表明,海洋藻类中的多糖物质的生物活性与其结构有十分密切的关系,如分子量、硫酸基含量、单糖组成、主链结构等[16]。从本研究来看,不同的提取方法所得海蒿子多糖抗氧化活性有明显差异,这可能与其分子量、单糖组成等有密切关系。海洋藻类生长在浩瀚复杂的海水环境中,由于水质的特殊,许多海洋藻类对营养物质吸收代谢的过程适应了多组分(盐分,气体,营养盐,生源要素,微量元素,有机物质等)水溶液环境。通常许多海藻多糖为硫酸化多糖,研究已发现硫酸基的含量与多糖的生物活性有显著的关系[17]。这与本文研究结果相一致。Takashi[18]的报道褐藻中水溶性多糖具有较好抗氧化性的分子量分布在高分子量(>100ku),10~30ku,和低分子量(<5ku)组分,本研究中TP的分子量是739.663ku,UP分子量39.385ku,UTP分子量742.667ku(26.88%)和122.509ku(73.12%),其抗氧化活性也较强。
3 结论
本实验采用传统水提法、柠檬酸提取法、超声法、超声波辅助水提法、超声波辅助柠檬酸提取法五种方法提取海蒿子多糖。其中采用柠檬酸进行多糖的提取,可显著地提高多糖的得率。抗氧化指标评价中,DPPH·清除能力在低浓度范围内TP、UP、UTP要强于CP、UCP,高浓度反之;超声波辅助水提法多糖的ABTS+清除能力0.25mg/mL浓度时为81.62%;而采用传统水提法多糖的硫酸基含量为12.28%,还原力在0.3mg/mL浓度时可达到1.381,氧自由基吸收能力(ORAC)值可达5404.90μmol Trolox/g,并且传统水提法和超声波辅助水提法的多糖分子量较大。采用柠檬酸处理进行多糖的提取虽可提高多糖得率,但其硫酸基含量和综合抗氧化性却不高,这可能与酸破坏多糖分子结构有关。整体而言,由于进一步研究的重点在于海蒿子多糖的生物活性,因此,宜采用传统水提法工艺来提取海蒿子多糖。同时,实验结果表明海蒿子作为褐藻的代表植物之一,其具有较好的抗氧化活性,可为海洋活性物质的开发提供依据。
[1]Dias P F,Siqueira J M,Maraschin M,et al.A polysaccharide isolated from the brown seaweedSargassumstenophyllum exerts antivasculogenic effects evidenced by modified morphogenesis[J].Microvascular research,2008,75(1):34-44.
[2]Lee J-B,Takeshita A,Hayashi K,et al.Structures and antiviral activities of polysaccharides fromSargassumtrichophyllum[J].Carbohydrate polymers,2011,86 :995- 999.
[3]Chen Xiaoming,Nie Wenjian,Yu Guoqing,et al.Antitumor and immunomodulatory activity of polysaccharides fromSargassumfusiforme[J].Food and Chemical Toxicology,2012,50(3-4):695-700.
[4]Ye Hong,Wang Keqi,Zhou Chunhong,et al. Purification,antitumor and antioxidant activitiesinvitroof polysaccharides from the brown seaweedSargassumpallidum[J]. Food Chemistry,2008,111:428-432.
[5]张华峰,高征,罗亚飞,等.海蒿子活性多糖降血脂作用的研究[J].中成药,2009,31(12):1925-1927.
[6]张维杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987.
[7]Osselaer N V,Rampart M,Herman A G.Differential inhibition of polymorphonuclear leukocyte recruitmentinvivoby dextran sulphate and fucoidan[J]. Mediators of Inflammation,1996,5(5):346-357.
[9]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorizing assay[J]. Free Radi in Bio and Medi,1999,26(9):1231-1237.
[10]Hua Yanglin,Yang Bao,Tang Jian,et al. Structural analysis of water-soluble polysaccharides in the fruiting body of Dictyophora indusiata and theirinvivoantioxidant activities[J].Carbohydrate Polymers,2012,87(1):343-347.
[11]Oyaizu M.Studies on products of browning reactions:Antioxidative activities of products of browning reaction prepared from glucosamine[J]. Japanese Journal of Nutrition,1986,44:307-315.
[12]卢茳虹,林宗毅,崔春,等.柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J].食品工业科技,2012,33(23):93-96.
[13]Xue Changhu,Fang Yu,Lin Hong,et al. Chemical characters and antioxidative properties of sulfated polysaccharides from Laminaria japonica[J].Journal of Applied Phycology,2001,13:67-70.
[14]Wu L C,Hsu H W,Chen Y C,et al. Antioxidant and antiproliferative activities of red pitaya[J]. Food Chemistry,2006,95(2):319-327.
[15]续洁琨,姚新生,栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J].中国药理学通报,2006,22(8):1015-1021.
[16]Vishchuk Olesya S,Ermakova Svetlana P,Zvyagintseva Tatyana N.Sulfated polysaccharides from brown seaweeds Saccharina japonica and Undaria pinnatifida:isolation,structural characteristics,and antitumor activity[J].Carbohydrate Research,2011,346(17):2769-2776.
[17]Suresh V,Senthilkumar N,Thangam R,et al.Separation,purification and preliminary characterization of sulfated polysaccharides fromSargassumplagiophyllumand itsinvitroanticancer and antioxidant activity[J].Process Biochemistry,2013,48(2):364-373.
[18]Takashi Kuda,Tomoko Hishi,Sayuri Maekawa.Antioxidant properties of dried product of ‘haba-nori’,an edible brown alga,Petalonia binghamiae(J. Agaradh)Vinogradova[J].Food Chemistry,2006,98(3):545-550.
Study on characteristics ofSargassumPallidumpolysaccharides prepared by different methods
FU Xiong1,LI Xiang-shi1,YOU Li-jun1,2,*,LIU Dong2
(1.College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China;2.Shenzhen Key Laboratory of Fermentation,Purification and Analysis,Shenzhen Polytechnic,Shenzhen 518055,China)
Polysaccharide extracted fromSargassumpallidum,as a cell polysaccharide,possesses a number of biological activities. Different extraction methods ofSargassumpallidumpolysaccharide,including hot water extraction,citric acid extraction,ultrasound extraction,ultrasonic wave complex hot water extraction and ultrasonic wave complex citric acid extraction,were compared in this paper. The results showed that the extracting yield increased largely by citric acid extraction,the experimental yield was 5.31%,1.8 fold of that of polysaccharides extracted by traditional hot water. At the same time,there were differences inSargassumpallidumpolysaccharide molecular weight. For example,the polysaccharide molecular weight by hot water extraction was 739.663ku,about 19 times than the method of ultrasound extraction. Through different evaluation tests of antioxidant capacity,it showed the polysaccharide extracted by traditional hot water,DPPH·radical scavenging ability was(54.77% at 0.5mg/mL). Its ABTS+scavenging ability was(74.59% at 0.25mg/mL). Its reducing power was(1.381 at 0.3mg/mL),and the oxygen radical absorbance capacity was(5404.90μmol Trolox/g). Moreover,its sulfate content was 12.28%,with best antioxidant activities. Therefore,the polysaccharide extracted by traditional hot water is more conducive to maintain the functional activity ofSargassumpallidumpolysaccharides,ease further in-depth research.
Sargassumpallidum;polysaccharides;citric acid extraction;molecular weight;antioxidant activity
2014-07-28
扶雄(1972-),男,博士,教授,研究方向:功能碳水化合物。
*通讯作者:游丽君(1982-),女,博士,研究方向:食品营养与健康。
广东省领军人才项目(Rui Hai Liu);国家自然科学基金(31101222);中央高校科研业务费项目(2013ZM0049);中美功能糖合作研发中心(2013J4500036);深圳市发酵精制检测系统重点实验室开放课题。
TS201.2
A
:1002-0306(2015)09-0101-06
10.13386/j.issn1002-0306.2015.09.013

