胸腺素β4对增生性瘢痕基质金属蛋白酶-2及9表达作用的影响*
樊志强,廖立新,张友来,罗 飞(.南昌大学第一附属医院烧伤科 330000;.厦门大学第一附属医院烧伤整形科 36003)
病理性瘢痕的形成是创伤过度反应的结果[1],病理性瘢痕包括增生性瘢痕和瘢痕疙瘩,其组织性特征是持续且大量增生的成纤维细胞,炎性生长因子活化所产生的细胞外基质(ECM)成分的沉积,其影响愈合后的外观和功能。增生性瘢痕形成是个复杂的病理过程,其中细胞移行、肉芽组织的形成、新生血管及基质的重塑均依赖ECM(胶原、纤维粘连蛋白、弹性蛋白等)的分泌和降解[2]。其中胶原的产生是增生性瘢痕形成的决定性因素[3],胶原的降解主要依赖基质金属蛋白酶(MMPs),MMPs由结缔组织及肿瘤组织合成分泌。胶原酶家族中MMP-2、MMP-9是近年来研究的热点。胸腺素β4有显著的促进皮肤愈合的作用,Philp等[4]曾在大鼠皮肤创伤模型中应用胸腺素β4发现多个MMPs表达量在成纤维细胞、内皮细胞和角质细胞中显著增加,加速了创面愈合的过程。但对于胸腺素β4对人的增生性瘢痕成纤维细胞中MMPs的影响研究较少,本研究拟了解胸腺素β4对瘢痕成纤维细胞中MMP-2、MMP-9表达的影响及作用机制。
1 资料与方法
1.1 一般资料 取2013年6~9月在南昌大学第一附属医院烧伤整形科手术切取的增生性瘢痕组织,于-70℃冰箱中冻存待用。诊断标准:瘢痕疙瘩为损伤后,瘢痕生长超出原有范围向周围正常皮肤组织浸润扩大,病程超过12个月,持续增生,并有规则赘生物,高出皮肤表面,呈蟹足样生长,伴瘙痒和刺痛。同时根据病史、病变过程、局部刺激因素进行综合判断。增生性瘢痕均系严重烧伤后局部增生引起,具有隆起、形状不规则、质地实韧、常伴疼痛,于伤口愈合后6~12个月取材。排除标准:术前应用激素治疗及接受放射治疗的患者。其中男6例、女3例,患者年龄25~53岁,平均34.5岁。均已告知患者及家属,并签知情同意书。
1.2 实验材料 胎牛血清(FBS)、DMEM培养基购自 Hy-Clone公司;胸腺素β4粉剂购自Prospec公司,考马斯亮蓝、逆转录试剂盒(货号 KR106-02)、2×Taq PCR Master Mix(货号KT201)购自北京天根生化科技有限公司;MMP-2单克隆抗体(货号ab7033)、MMP-9单克隆抗体(货号ab137867)购自美国Abcam公司;人β-actin抗体(货号 TA-09)购自中杉金桥;Trizol购自Invitrogen公司。引物:MMP-2上游5′-CAG GGA ATG AGT ACT GGG TCT ATT-3′,下游5′-ACT CCA GTT AAA GGC AGC ATC TAC-3′;MMP-9 上 游 5′-AAT CTC TTC TAG AGA CTG GGA AGG AG-3′,下游5′-AGC TGA TTG ACT AAA GTA GCT GGA-3′;β-actin 上 游 5′-GAG CTA CGA GCT GCC TGA CG-3′,下游 5′-CCT AGA AGC ATT TGC GGT GG-3′;引物由上海捷瑞生物技术有限公司合成。
1.3 成纤维细胞的分离培养 采用组织块法培养,将临床标本在无菌条件下用D-Hank′s液反复冲洗并消毒,切成约1 mm3的块状,种植于25cm2培养瓶内,间隔约0.3cm。接种好后静置数分钟,加入含20%FBS的DMEM培养。置于37℃、5%CO2饱和湿度的培养箱静置培养,根据生长情况每3~5天换液,待原代细胞长满瓶底80%时消化传代,本实验选用第3~6代细胞。
1.4 实验分组 根据胸腺素β4浓度不同分为对照组(0 μg/m L)和实验组(0.05、0.1、1.0、5.0μg/mL)。
1.5 RT-PCR检测 MMP-2、MMP-9基因表达的变化 取第3~6代生长良好的细胞,经胰酶消化后,调整细胞计数,移种到6孔板,经24h饥饿培养后逐一加药。药物干预6h后,通过Trizol法提取细胞总RNA,凝胶电泳和紫外分光光度计分析所提取的总RNA的完整性和浓度。采用北京天根公司的逆转录试剂盒按说明书进行cDNA的合成。按照引物设计原则设计引物,并在BLAST中进行同源性比较。PCR的条件为:变性94℃3min;94℃30s;60℃30s,72℃10min 29个循环。取PCR产物5μL,在1.5%琼脂糖中电泳后,凝胶图像分析系统Bio-Rad Image Lab对目的基因的PCR产物进行灰度测定。基因表达量是以基因的灰度值与β-actin基因的灰度值的比值表示。
1.6 Western blot检测 MMP-2、MMP-9蛋白的表达变化药物处理后提取细胞总蛋白,考马斯亮蓝溶液对蛋白进行定量分析。采用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,凝胶经半干转仪转移至硝酸纤维素(NC)膜,转移好的NC膜用5%脱脂奶粉封闭1h。一抗4℃孵育过夜,充分漂洗后,二抗4℃孵育4h,洗膜3次,最后用ECL发光试剂盒检测,胶片曝光,显影,定影。蛋白的表达量以该蛋白的灰度值与β-actin蛋白的灰度值的比值表示。
1.7 统计学处理 采用SAS9.2软件进行分析,统计分析采用单因素方差分析模型,模型的R Squared较高,提示模型有意义,组间两两比较采用SNK检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 培养的成纤维细胞生长变化 成纤维细胞在培养后第4天从组织块边缘游出,较稀疏(图1A),第7天呈大片密集生长,呈放射状梭形排列,细胞体饱满(图1B)。传代后细胞呈旋涡状或条索状(图1C)。胸腺素β4干预后部分细胞开始变圆,细胞间隙增大,数量减少,部分凋亡飘浮(图2B、C),而对照组无明显变化(图2A)。

图1 传代成纤维细胞生长状况(×100)
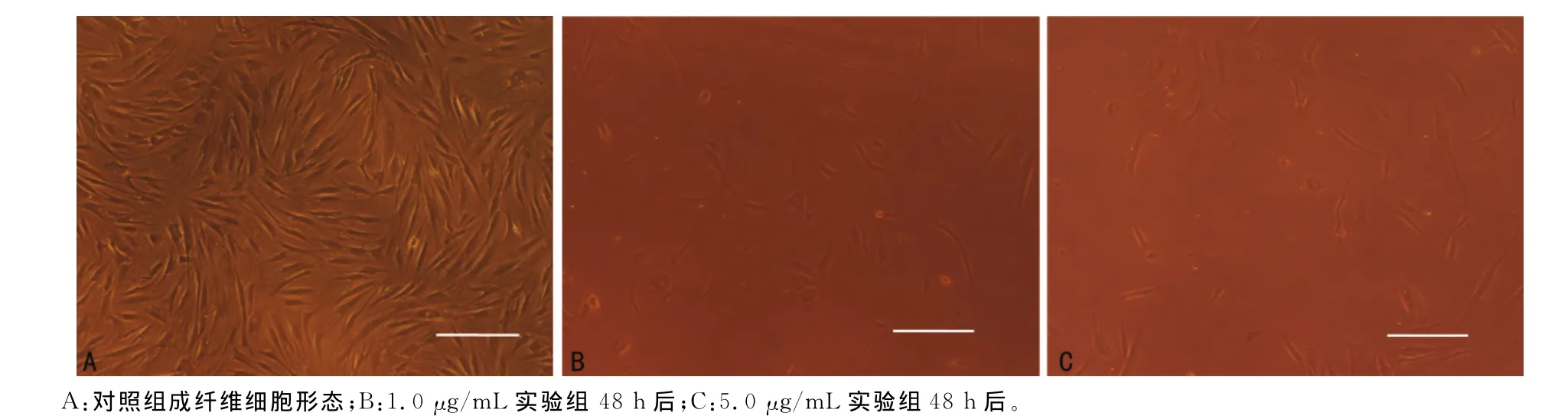
图2 胸腺素β4干预后细胞生长状况(×100)
2.2 胸腺素β4对增生性瘢痕成纤维细胞分泌 MMP-2、MMP-9的影响 胸腺素β4能够提升 MMP-2、MMP-9mRNA及蛋白的表达,0.05、0.1、1.0、5.0μg/mL实验组中 MMP-2、MMP-9mRNA及蛋白含量均高于对照组,分别以1.0、5.0 μg/mL组作用最明显,见图3、4。统计分析采用单因素方差分析模型,模型的R Squared较高,提示模型有意义。单因素方差分析结果显示,不同浓度组间差异有统计学意义,F值分别为279.55,207.47,56.32,88.52,P<0.01。组间两两比较采用SNK检验,结果提示浓度越高,表达量越高,且差异有统计学意义(P<0.05)。见表1。
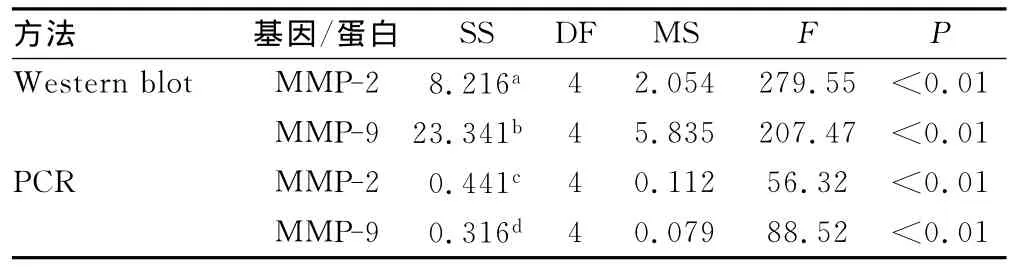
表1 Western blot和RT-PCR检测胸腺β4作用后增生性瘢痕组织MMP-2、MMP-9与对照组表达差异
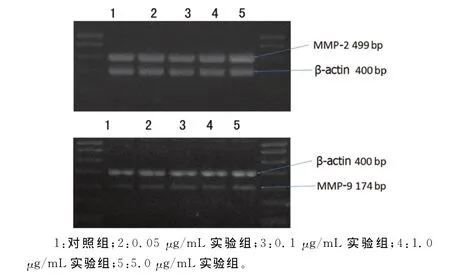
图4 RT-PCR检测 MMP-2、MMP-9蛋白在各组织中的含量
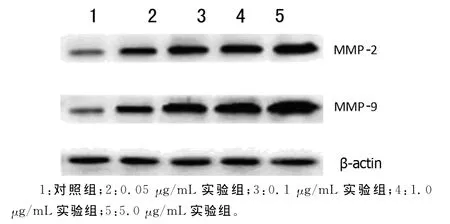
图4 Western blot检测 MMP-2、MMP-9蛋白在各组织中的含量
3 讨 论
增生性瘢痕的形成是一个较为复杂的病理过程,正常情况下,伤口预后愈合过程中ECM沉积和降解处于动态平衡中,研究显示胶原合成和降解是影响创面愈合和后期组织重塑的重要因素[5],有相关研究证实在后期瘢痕形成过程中成纤维细胞胶原合成明显增高,同时合成的胶原纤维排列明显紊乱[6]。保持ECM合成和降解之间的平衡对完成组织修复有重要作用,胶原的降解主要是通过酶促反应来完成,MMPs是其降解的关键成分[7],其中 MMP-2、MMP-9是胶原降解的关键酶[8]。MMP-9主要由上皮细胞产生,是Ⅳ型糖化胶原酶的一种形式,主要底物有Ⅳ、Ⅴ型胶原和明胶,可以作用于Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原、蛋白聚糖的核心蛋白、明胶、弹性蛋白等ECM成分[9]。MMP-9出现于创面愈合早期,参与内皮细胞核角质形成细胞等的迁移、分化及新生血管形成[10]。MMP-2作用底物与MMP-9相同,但其作用范围更广泛,还可作用于Ⅶ型胶原、弹性蛋白、纤维粘连蛋白及蛋白聚糖的蛋白核心[11]。研究表明,MMP-2和MMP-9等多种MMPs在瘢痕成纤维细胞中表达明显改变[12],以上资料均提示 MMPs的表达与活性的降低,可能是增生性瘢痕形成的重要原因。
胸腺素β4是Low等[13]于1981年发现由43个氨基酸残基形成的多肽,在机体广泛分布,与机体免疫功能、神经系统发育、创伤愈合以及肌动蛋白功能均密切相关。胸腺素β4能加速血管再生、角质形成层细胞迁移以及伤口收缩等一系列反应,从而促进创面的愈合[14]。在Sosne等[15]的研究中,胸腺素β4能促进角膜碱烧伤模型创面愈合。同时其发现,IL-1、巨噬细胞炎性蛋白(MIP-1)、MIP-2,单核趋化蛋白(MCP-2)等炎性因子的基因转录和表达受到显著的抑制,表明胸腺素β4能够减少炎症细胞的数量,下调炎症趋化因子和细胞因子的表达,防止新生组织受到炎性反应的损害。在心肌组织中,Bock-Marquette等[16]及 Hinkel等[17]的研究发现:胸腺素β4能抑制心肌瘢痕的形成,阻断心肌细胞的凋亡、促进心肌修复及提高经缺氧再氧合的心肌细胞存活率等。在治疗增生性瘢痕方面,胸腺素β4改善基质环境利于细胞的迁移和血管生成。Malinda等[18]的研究显示,在正常小鼠皮肤创伤模型中,通过体内和体外实验,胸腺素β4在特异性的趋化内皮细胞迁移的同时,增加MMPs表达,加速基底膜降解,为血管生成创造条件。
本实验组前期实验发现胸腺素β4能够抑制成纤维细胞的增殖,并能剂量依赖性地降低增生性瘢痕成纤维细胞Ⅰ、Ⅲ型胶原蛋白的分泌及结缔组织生长因子(CTGF)的表达[19]。但关于腺素β4对成纤维细胞分泌MMP-2、MMP-9有何作用的报道较少见。本实验证实,通过体外培养增生性瘢痕成纤维细胞,发现0.1、1.0、5.0μg/mL胸腺素β4能够促进 MMP-2、MMP-9的表达,二者表达量上升,高于对照组。MMP-2、MMP-9是降解瘢痕组织中细胞外基质的主要因素,加入胸腺素β4后 MMP-2、MMP-9的表达量增加,说明胸腺素β4能够促进二者基因表达而发挥分解胶原的作用。胸腺素β4通过促进MMPs表达减轻ECM沉积而减轻瘢痕增生和挛缩,有抑制瘢痕增生的作用。通过查阅文献作者认为,胸腺素β4能早期增强细胞间黏附因子(ICAM)表达,加速炎性反应。保持较高的MMP-2水平以利于损伤早期加速清除坏死组织和基底膜的降解;晚期成纤维细胞和内皮细胞及基底膜的表达有利于上皮和表皮的增殖和血管重建[20];而胸腺素β4对于 MMP-9的影响机制尚未有相关文献报道,仍待进一步研究。
ECM在创伤修复中具有重要作用,基质代谢平衡失调与增生性瘢痕的形成有密切关联[21],MMPs是起主要降解作用的胶原酶。本实验发现胸腺素β4能够提高 MMP-2、MMP-9的表达减轻ECM沉积,为进一步研究胸腺素β4应用治疗增生性瘢痕的机制提供了思路。MMP-2和MMP-9与其抑制因子在创面愈合转归中的关系逐渐成为研究热点,胸腺素β4对其抑制因子的作用机制需要进一步研究。
[1] Abdou AG,Maraee AH,Al-Bara AM,et al.Immunohistochemical expression of TGF-β1in keloids and hypertrophic scars[J].Am J Dermatopathol,2011,33(1):84-91.
[2] Alster TS,Tanzi EL.Hypertrophic scars and keloids[J].Am J Clin Dermatol,2003,4(4):235-243.
[3] Naitoh M,Hosokawa N,Kubota H,et al.Upregulation of HSP47and collagen typeⅢin the dermal fibrotic disease,keloid[J].Biochem Biophys Res Commun,2001,280(5):1316-1322.
[4] Philp D,Scheremeta B,Sibliss K,et al.Thymosin beta4 promotes matrix metalloproteinase expression during wound repair[J].J Cell Physiol,2006,208(1):195-200.
[5] 刘爱东,王玥,庞久玲,等.基质金属蛋白酶7和转化生长因子β1在病理性瘢痕中的表达:与正常瘢痕及正常皮肤组织比较[J].中国组织工程研究,2012,16(7):1165-1168.
[6]Imaizumi R,Akasaka Y,Inomata N,et al.Promoted activation of matrix metalloproteinase(MMP)-2in keloid fibroblasts and increased expression of MMP-2in collagen bundle regions:implications for mechanisms of keloid progression[J].Histopathology,2009,54(6):722-730.
[7] Tanriverdi-Akhisaroglu S,Menderes A,Oktay G.Matrix metalloproteinase-2and-9activities in human keloids,hypertrophic and atrophic scars:apilot study[J].Cell Biochem Funct,2009,27(2):81-87.
[8] 张文,赵洁,毕朝晖.心肌损伤标志物在小儿病毒性心肌炎诊断中的应用进展[J].临床和实验医学杂志,2009,8(11):119-121.
[9] 陈小婷,欧斌贤,唐屈,等.苦参碱对体外培养人增生性瘢痕成纤维细胞 MMP-1、MMP-9表达的影响[J].广西医学,2014,43(5):624-626.
[10]李文娟,陈伟,付小兵,等.基质金属蛋白酶及其抑制因子在增生性瘢痕中的表达特征及意义[J].感染、炎症、修复,2005,6(4):207-209.
[11]李开通,刘达恩,陈小婷,等.水蛭素对增生性瘢痕基质金属蛋白酶-2、9表达作用的影响[J].山东医药,2012,52(20):28-29,88.
[12]Parks WC.Matrix metalloproteinases in lung repair[J].Eur Respir J Suppl,2003,44:36s-38s.
[13]Low TL,Hu SK,Goldstein AL.Complete amino acid sequence of bovine thymosin beta 4:a thymic hormone that induces terminal deoxynucleotidyl transferase activity in thymocyte populations[J].Mol Cell Biochem,1981,78(2):1162-1166.
[14]于虎,张朔瑒,马瑞珏,等.胸腺素β4促进创伤愈合机制的研究进展[J].国际生物医学工程杂志,2010,33(4):235-238.
[15]Sosne G,Xu L,Prach L,et al.Thymosin beta 4stimulates laminin-5production independent of TGF-beta[J].Exp Cell Res,2004,293(1):175-183.
[16]Bock-Marquette I,Saxena A,White MD,et al.Thymosin β4activates integrin-linked kinase and promotes cardiac cell migration,survival and cardiac repair[J].Nature,2004,432(7016):466-472.
[17]Hinkel R,El-Aouni C,Olson T,et al.Thymosin beta4is an essential paracrine factor of embryonic endothelial progenitor cell-mediated cardioprotection[J].Circulation,2008,117(17):2232-2240.
[18]Malinda KM,Goldstein AL,Kleinman HK.Thymosin beta(4)stimulates directional migration of human umbilical vein endothelial cells[J].FASEB J,1997,11(6):474-481.
[19]朱璇.胸腺素β4对人增生性瘢痕成纤维细胞胶原合成和CTGF表达的影响[D].南昌:南昌大学,2013.
[20]李艳,王冠,于虎,等.重组胸腺素β4调节ICAM-1、MMP-2和LN-5促进创伤愈合的实验研究[J].组织工程与重建外科杂志,2008,4(3):142-145,163.
[21]Gailit J,Clark RA.Wound repair in the context of extracellular matrix[J].Curr Opin Cell Biol,1994,6(5):717-725.

