健脾解毒化瘀方对肝衰竭大鼠肝脏的保护作用及对TLR4表达的影响
王 轩,彭土生,王 昊,马群英,徐嘉蔚
(1. 广州医科大学附属第五医院,广东 广州 510700;2. 湖南中医药大学研究生院,湖南 长沙 410007)
健脾解毒化瘀方对肝衰竭大鼠肝脏的保护作用及对TLR4表达的影响
王 轩1,彭土生1,王 昊1,马群英1,徐嘉蔚2
(1. 广州医科大学附属第五医院,广东 广州 510700;2. 湖南中医药大学研究生院,湖南 长沙 410007)

目的研究健脾解毒化瘀方对肝衰竭大鼠的保护作用及对Toll样受体4(TLR4)表达的影响。方法将大鼠随机分为正常组、模型组、对照组和实验组,除正常组外,其余组均采用D-半乳糖胺(D-gal)腹腔注射方法建立肝衰竭大鼠模型。于造模前4 d开始,正常组和模型组给予生理盐水灌胃,对照组和实验组分别给予谷氨酰胺溶液和健脾解毒化瘀方灌胃,直至造模后24 h,于造模1 d后处死大鼠,检测各组大鼠血清ALT、AST、内毒素水平,镜下观察肝组织病理学变化,取肝组织采用免疫组化法检测TLR4表达情况。结果模型组血清ALT、AST、内毒素水平均明显高于正常组(P均<0.05),实验组及对照组各指标水平均明显低于模型组(P均<0.05);实验组及对照组肝组织病理学分级好于模型组(P均<0.05),病损评分及TLR4染色光密度值均明显低于模型组(P均<0.05)。实验组与对照组间上述指标比较差异均无统计学意义(P均>0.05)。结论健脾解毒化瘀方对肝衰竭大鼠肝功能有明显保护作用,其可能通过下调肝组织TLR4的表达而起到抗肝衰竭的作用。
健脾解毒化瘀方;肝衰竭;内毒素;Toll样受体4
肝衰竭是各种肝病的终末阶段,其治疗难度大,病死率为50%~80%[1],故而如何改善肝功能,阻止肝损伤意义重大。健脾解毒化瘀方是基于肝衰竭早期“瘀毒”的病机基础及“防病传变”的治疗思想创制而成,用于治疗肝衰竭效果较好,但其作用机制目前尚不明确。目前研究证实,肝衰竭时伴有内毒素血症,而内毒素血症是导致肝衰竭病情进展的重要因素[2]。内毒素诱导细胞因子释放主要依赖于Toll 样受体(TLRs)介导的细胞通路,其中Toll样受体4(TRL4)介导的通路被认为是最主要的[3]。故本实验以肝衰竭大鼠为模型,研究了健脾解毒化瘀方对大鼠肝功能、内毒素及与其密切相关的TLR4表达的影响,旨在揭示中药治疗肝衰竭的作用机制,现报道如下。
1 实验资料
1.1实验动物 雄性SD大鼠64只,体质量200 g左右,由湖南中医药大学医学实验动物中心提供,动物合格证号:SCXK(湘)2009-0004。
1.2药物与试剂 健脾解毒化瘀方由赤芍50 g、丹参30 g、茵陈30 g、白术30 g、葛根30 g、大黄10 g、白花蛇舌草15 g组成,均为中药浓缩颗粒剂(广东一方制药有限公司,批号分别为412263T、503477T、411323T、407340T、410493T、501575T、408435T)。谷氨酰胺(sigma公司,批号:G3126)。D-半乳糖胺(南通通吕生物制品有限公司,批号:20111106),使用前将其配制成质量分数为20%的溶液,并用1 mol/L氢氧化钠溶液调节pH至7.0。终点基质鲎试剂盒(厦门市鲎试剂实验厂有限公司,批号:110620)。大鼠TLR4免疫组化试剂盒(Abcam公司,批号:ab22048)。
1.3仪器 7170型全自动生化分析仪(日本日立公司),AY120型电子天平(日本岛津公司),UV-1800型紫外分光光度计(日本岛津公司),HHW21420S型电热恒温水温箱(上海跃进医疗器械厂),TG16-W型微量高速离心机(长沙湘仪离心机仪器有限公司)。
1.4分组、造模及给药 将64只健康SD大鼠随机分为正常组、模型组、对照组和实验组,正常组10只,余每组18只。参照文献[4-5],除正常组外,其余组均给予D-半乳糖胺2.0 g/kg一次性腹腔注射,24 h后成模。于造模前4 d开始,正常组和模型组给予生理盐水灌胃,对照组和实验组分别给予谷氨酰胺溶液和健脾解毒化瘀方灌胃。按人和大鼠的体表面积关系换算出大鼠的日用药量:中药生药19.5 g/(kg·d),使用时用蒸馏水配制成浓度为0.975 g/mL的溶液;谷氨酰胺0.2 g/(kg·d),使用时配制成浓度为 0.01 g/mL的溶液。各组灌胃量均为20 mL/(kg·d),2次/d,直至造模后24 h。于造模1 d后处死大鼠。
1.5观察指标 ①肝功能:取大鼠心脏血2 mL,用于测定ALT、AST。②内毒素检测:从大鼠门静脉采血1 mL注入无热原抗凝管,3 000 r/min离心1 min,取血浆,参照终点基质鲎试剂盒说明书检测内毒素水平。③肝组织病理学:取适量肝组织,生理盐水清洗,再以4%多聚甲醛固定,逐级乙醇脱水,常规石蜡包埋,4 μm切片,逐级脱蜡、脱水,HE染色,光镜下观察肝组织病理学改变。按损伤范围不同给予评分。0级:组织结构正常,0分;1级:仅有肝细胞点状坏死,1分;2级:可见片状肝细胞坏死,坏死范围占肝小叶1/3以内,2分;3级:肝细胞坏死范围占1/3~2/3肝小叶,3分;4级:肝细胞坏死范围占肝小叶2/3以上,4分。④肝组织 TLR4表达检测:取适量肝组织,以4%多聚甲醛固定4 h,冰冻切片,采用免疫组织化学SP法进行检测。细胞中TLR4表达呈棕黄色颗粒为阳性。每只动物测1张切片,采用SP图像分析系统Micro-image analyse system进行图像分析,每张切片在400倍视野下随机取10个视野获取TLR4平均光密度值。
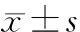
2 结 果
2.1各组肝功能指标水平比较 模型组血清AST和ALT水平均明显高于正常组(P均<0.05),对照组、实验组血清AST和ALT水平均明显低于模型组(P均<0.05),对照组和实验组间血清AST、ALT水平比较差异均无统计学意义(P均>0.05)。见表1。
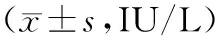
表1 各组血清AST和ALT水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.2各组血浆内毒素水平比较 正常组血浆内毒素水平为(0.32±0.22)EIU/mL,模型组为(0.90±0.41)EIU/mL,对照组为(0.58±0.31)EIU/mL,实验组为(0.61±0.26)EIU/mL。模型组血浆内毒素水平明显高于正常组(P均<0.05),对照组和实验组血浆内毒素水平均明显低于模型组(P均<0.05),对照组和实验组间血浆内毒素水平比较差异无统计学意义(P均>0.05)。
2.3各组肝组织镜下表现 正常组肝小叶结构清晰,汇管区几乎未见炎症细胞浸润,见图1。模型组见肝小叶结构破坏,大片肝细胞坏死,肝细胞胀肿,呈空泡样改变,伴有大量炎症细胞浸润,见图2。对照组和实验组肝小叶结构比较完整,见局灶状肝细胞坏死,少量肝细胞空泡样改变,汇管区可见炎症细胞浸润,见图3和图4。

图1 正常组肝组织病理学表现(HE染色×100)
2.4各组病理学分级及病损评分比较 实验组及对照组肝组织病理学分级好于模型组(P均<0.05),病损评分均明显低于模型组(P均<0.05),对照组和实验组间比较差异均无统计学意义(P均>0.05)。见表2。
2.5各组肝组织TLR4染色光密度值比较 正常组TLR4染色光密度值为0.132±0.021,模型组为0.644±0.187,对照组为0.427±0.105,实验组为0.414±0.116。模型组TLR4染色光密度值明显高于正常组(P<0.05),对照组和实验组明显低于模型组(P均<0.05),对照组和实验组间比较差异无统计学意义(P>0.05)。
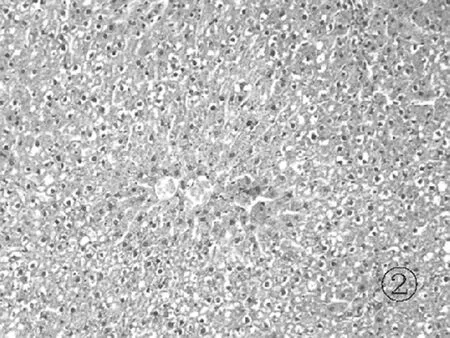
图2 模型组肝组织病理学表现(HE染色 ×100)
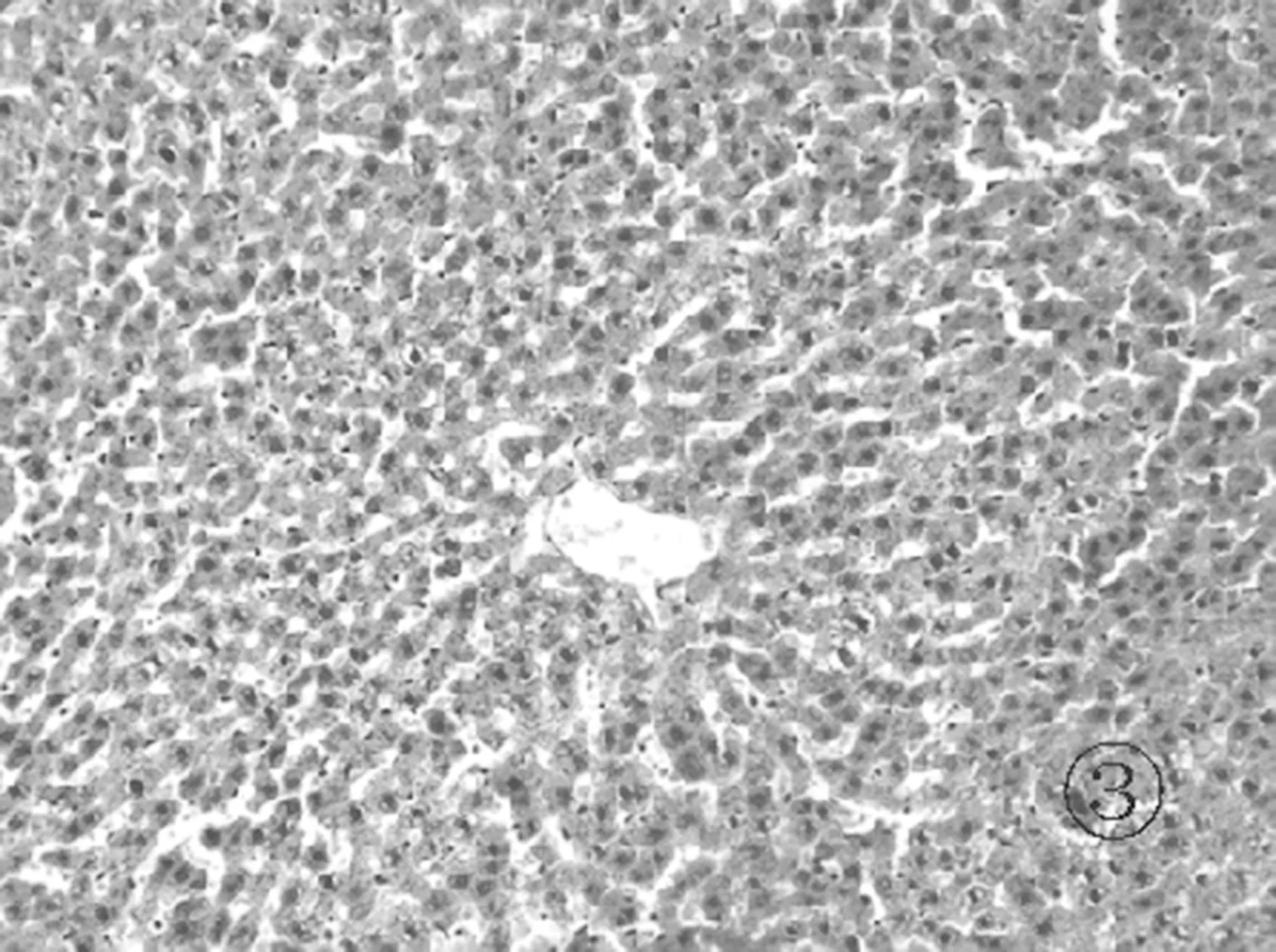
图3 对照组肝组织病理学表现(HE染色 ×100)
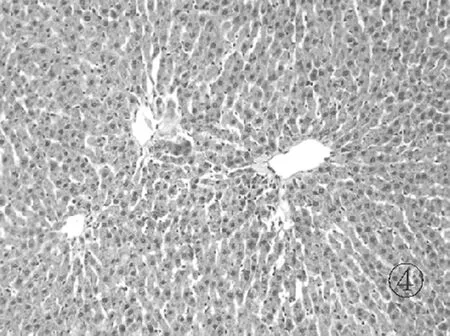
图4 实验组肝组织病理学表现(HE染色 ×100)
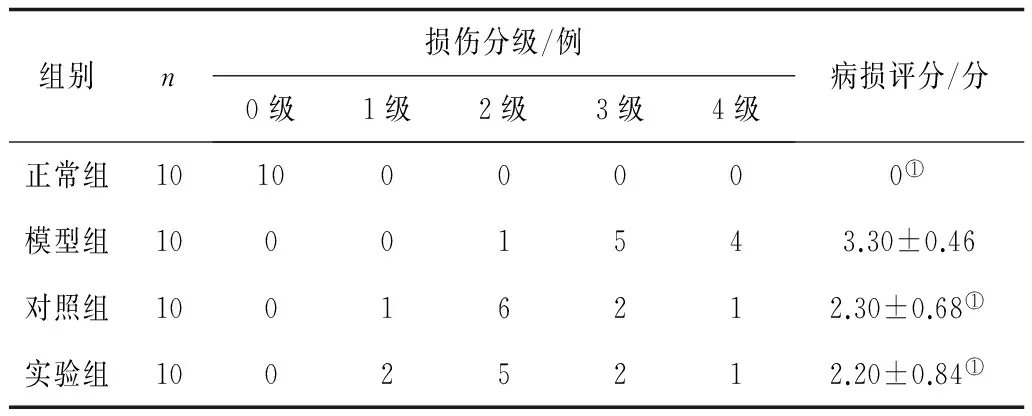
组别n损伤分级/例0级1级2级3级4级病损评分/分正常组101000000①模型组10001543.30±0.46对照组10016212.30±0.68①实验组10025212.20±0.84①
注:①与模型组比较,P<0.05。
2.6各组肝组织TLR4免疫组化表现 正常组肝细胞胞浆及胞核几乎未见棕黄色颗粒表达,见图5。模型组可见肝细胞胞浆内大量棕黄色颗粒表达,汇管区尤为明显,呈强阳性,见图6。对照组和实验组可见肝细胞胞浆内棕黄色颗粒表达,汇管区较明显,呈中等阳性,见图7及图8。
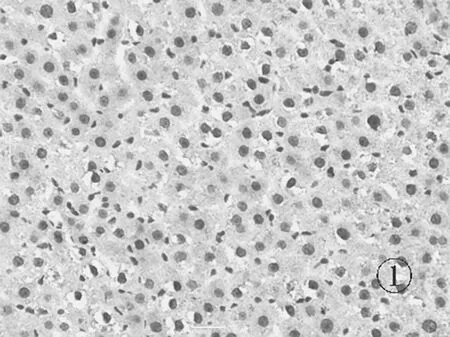
图5 正常组肝组织TLR4蛋白表达情况(免疫组化×400)
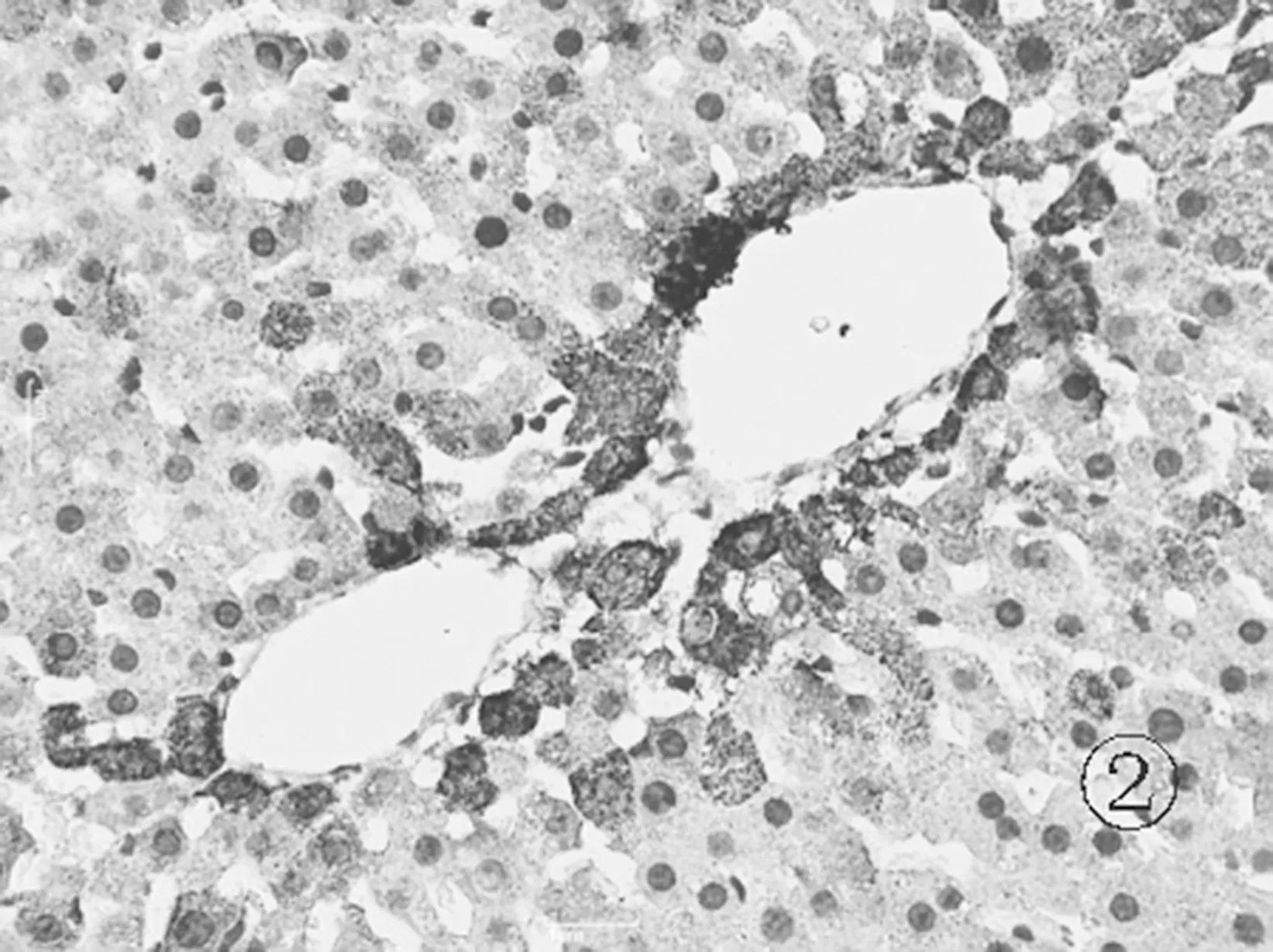
图6 模型组肝组织TLR4蛋白表达情况(免疫组化×400)
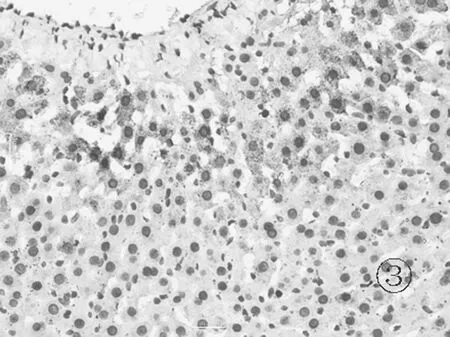
图7 对照组肝组织TLR4蛋白表达情况(免疫组化×400)
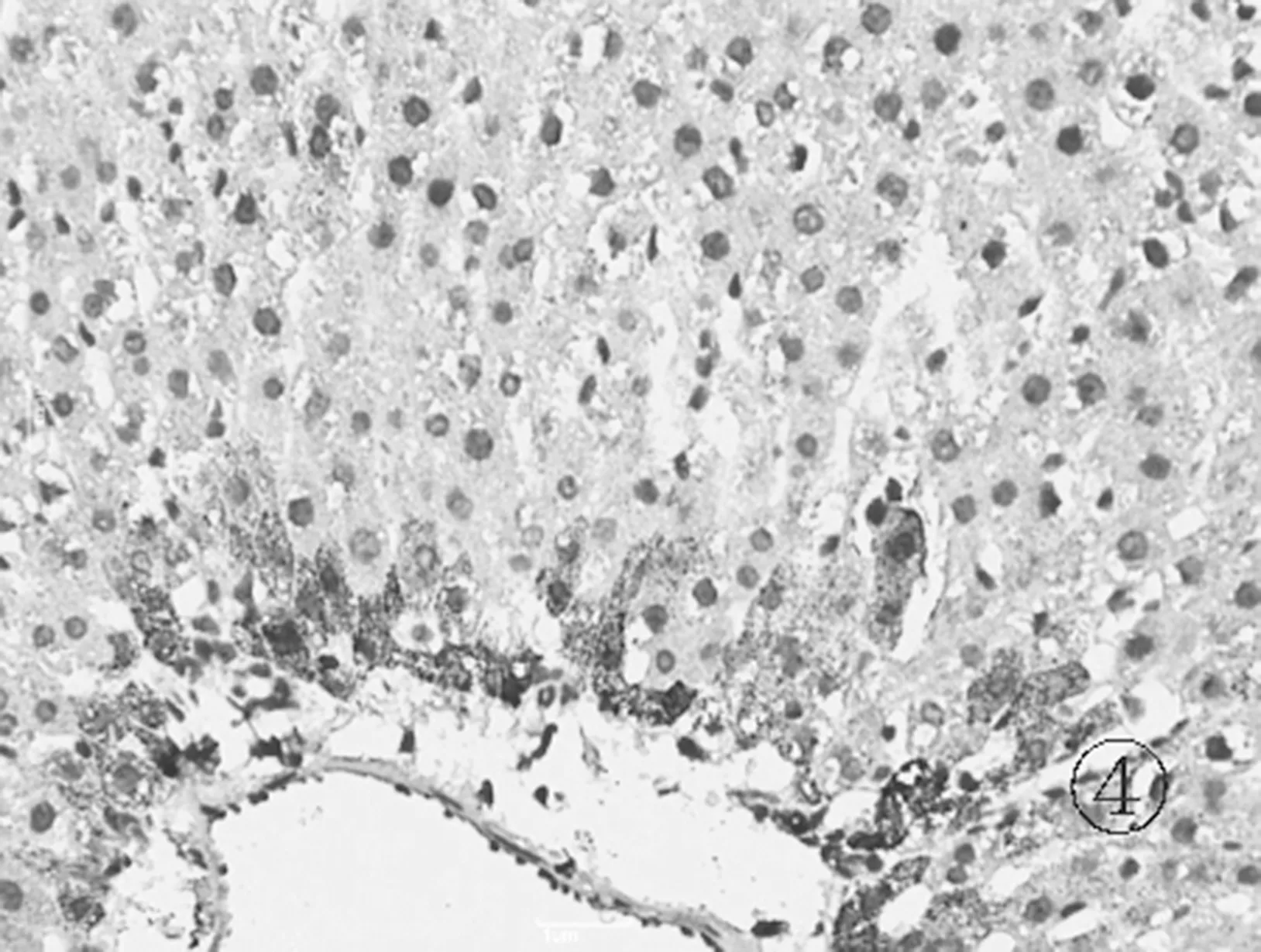
图8 实验组肝组织TLR4蛋白表达情况(免疫组化×400)
3 讨 论
肝衰竭的发病机制复杂,目前研究认为免疫损伤起主要作用,认为“内毒素—细胞因子—肝损伤”是肝损伤加重造成第二次打击的主要机制[6]。肝衰竭可导致肠道菌群紊乱、肠黏膜屏障功能减弱,使大量内毒素经受损的肠黏膜下微血管入血,加之肝脏受损严重,其解毒功能下降,内毒素得不到有效清除,形成肠源性内毒素血症。据统计,肝衰竭患者肠源性内毒素血症发生率为93.3%~100%[7]。其后内毒素造成第二次肝损伤,为肝衰竭免疫损伤过后继发加重的重要病理机制,可显著加重病情,甚至导致死亡。内毒素可诱导细胞因子释放,通过多种机制损伤肝脏[8-9]:与特异性受体结合,降低肝脏的腺苷酸和三磷酸腺苷/二磷酸腺苷比值,使肝脏能量代谢发生障碍;促使肝细胞膜的Ca2+通道开放,胞浆游离Ca2+升高,引起肝细胞变性坏死;通过TLR4介导的信号传导途径,激活肝枯否细胞释放各种细胞因子(TNF-α、IL-6等)损伤肝脏[10]。TLR4广泛存在于免疫细胞上,它们识别内毒素后,通过髓样分化因子88(MyD88)依赖途径激活核因子-κB(NF-κB)通路,或通过MyD88非依赖途径促分裂素原活化蛋白激酶系统通路表达,引起多种细胞因子的释放,继而激活下游的蛋白分子,然后活化先天性免疫信号,表达各种炎症调节分子,从而加重肝脏的损伤。而TLR4阻断剂则可以减轻这种损伤[11],并有改善肠黏膜微循环的作用[12]。
谷氨酰胺是人体内含量最多的氨基酸,为肠黏膜上皮代谢必需的营养物质,在创伤、败血症、感染等严重应激下,肠黏膜上皮内谷氨酰胺迅速耗竭,此时补充谷氨酰胺可减少感染并发症[13],减轻内毒素血症。同时谷氨酰胺为谷胱甘肽合成前体,能起到减轻炎症反应、减少氧化应激的作用。但在缓解肝脏炎症,改善肝脏微循环方面功能有所欠缺。
中医认为肝衰竭属于“急黄”范畴,其病因主要归结为湿热或瘀毒,早期以实证为主,中晚期则为虚实夹杂。肝主疏泄,以条畅气机,脾主运化,以生精微、化水湿,肝郁条达不舒时能反侮脾土,脾土受侮,则健运失常,水湿停滞损及脾阳,湿邪疫毒滋生。另外肝病时伴有不同程度的肠道功能受损,肝衰竭时尤为明显,而中医“脾”与现代医学消化系统关系密切。张仲景在《金匮要略》里提出:“见肝之病知肝传脾,当先实脾。”故认为在肝衰竭早期加用益气健脾药尤有意义,国内有研究报道早期运用扶正健脾药物确有较好疗效[14]。健脾解毒化瘀方中赤芍具有清热解毒、活血化瘀的功能,方中重用赤芍以加强解毒化瘀的功效,白术健脾益气,两者合用为君药;茵陈、白花蛇舌草、丹参可加强清热化湿退黄、活血化瘀的功效;再佐以葛根升发阳气,大黄泻腑逐瘀,一升一降,内外通和,斡旋气机。
本实验结果显示,模型组血清ALT、AST、内毒素水平均明显高于正常组,实验组及对照组各指标水平均明显低于模型组;实验组及对照组肝组织病理学分级好于模型组,病损评分及TLR4染色光密度值均明显低于模型组;实验组与对照组间上述指标比较差异均无统计学意义。提示健脾解毒化瘀方可能通过下调肝组织中TLR4的表达,降低内毒素水平,从而减轻内毒素等因素造成的肝损伤,改善肝功能,在治疗肝衰竭方面值得进一步深入研究。
[1] 林世德,罗亚文,苏毅,等. 重型肝炎研究进展[J]. 实用肝脏病杂志,2009,12(1):73-75
[2] 杨洁,聂青和. 肝衰竭与肠道屏障功能障碍[J]. 实用肝脏病杂志,2010,13(1):66-69
[3]FisherJE,McKenzieTJ,LillegardJB,etal.RoleofKupffercellsandtoll-likereceptor4inacetaminophen-inducedacuteliverfailure[J].JSurgRes,2013,180(1):147-155
[4]HocherB,HeidenS,vonWebskyK,etal.Dualendothelin-convertingenzyme/neutralendopeptidaseblockadeinratswithD-galactosamine-inducedliverfailure[J].EurJMedRes,2011,16(6):275-279
[5] 王轩,陈斌,彭杰,等. 温阳解毒化瘀方对肝衰竭内毒素血症大鼠肠道sIgA的影响[J]. 中西医结合肝病杂志,2013,23(3):157-159
[6]NolanJP.Theroleofintestinalendotoxininliverinjury:alongandevolvinghistory[J].Hepatology,2010,52(5):1829-1835
[7] 徐道振. 病毒性肝炎临床实践[M]. 北京:人民卫生出版社,2006:266-271
[8]ChenLC,GordonRE,LaskinJD,etal.RoleofTLR-4inlivermacrophageandendothelialcellresponsivenessduringacuteendotoxemia[J].ExpMo1Patho1,2007,83(3):311-326
[9]ElKasmiKC,AndersonAL,DevereauxMW,etal.Tolllikereceptor4dependentKupffercellactivationandliverinjuryinanovelmousemodelofparenteralnutritionandintestinalinjury[J].Hepatology,2012,55(5):1518-1528
[10] 段学章,王慧芬. 脂多糖/Toll样受体4信号通路在乙型肝炎病毒相关的慢加急性肝衰竭发病中的研究进展[J]. 中华肝脏病杂志,2010,18(1):78-80
[11]MaL,GongX,KuangG,etal.Sesaminameliorateslipolplysaccharide/d-galactosamine-inducedfulminanthepaticfailurebysuppressionofToll-likereceptor4signalinginmice[J].BiochemBiophysResCommun,2015,461(2):230-236
[12]ZhouJ,SoltowM,ZimmermannK,etal.ExperimentalTLR4inhibitionimprovesintestinalmicrocirculationinendotoxemicrats[J].MicrovascRes,2015,24(101):33-37
[13]LuCY,ShihYL,SunLC,etal.Theinflammatorymodulationeffectofglutamine-enrichedtotalparenteralnutritioninpostoperativegastrointestinalcancerpatients[J].AmSerg,2011,77(1):59-64
[14] 张旸,吴银亚,谭善忠,等. 基于正虚机制观察益气健脾法治疗慢性乙型肝炎肝衰竭的临床疗效[J]. 中国中医急症,2012,21(6):872-874
Protection of Jianpi Jiedu Huayu prescription on rats with hepatic failure and the effect on the expression of TLR4
WANG Xuan1, PENG Tusheng1,WANG Hao1,MA Qunying1, XU Jiawei2
Objective It is to investigate the protection of Jianpi Jiedu Huayu prescription on rats with hepatic failure and the effect on the expression of TLR4. Methods The rats were randomly divided into normal group, model group, control group, and experimental group, the rat model of hepatic failure of every group was established by intraperitoneal injection of galactosamine except normal group. The rats were lagaved by corresponding drug including sodium chloride,glutamine,Jianpi Jiedu Huayu prescription at 4 days before being established model,until 24 hours after being established model,The rats were put to death 24 hours later after intraperitoneal injection,then the levels of serum ALT,AST and endotoxin were determined, the pathological changes was observed under microscope and TLR4 expression of liver tissue was detected by immunohistochemical method. Results The serum levels of ALT, AST and endotoxin in model group were higher than those in normal group(P<0.05), and the indexes in experimental group and control group were obviously lower than those in model group(P<0.05). The pathological grading of liver tissue of control group and experimental group were better than that in model group,and the liver injury score and optical density(OD) of TLR4 in experimental group and control group was obviously lower than model group(P<0.05). The differences between control group and experimental group were not significant(P>0.05). Conclusion Jian pi Jiedu Huayu prescription can protect the liver function of rat with hepatic failure,the effect maybe is related with down-regulation of TLR4 expression in liver.
Jianpi Jiedu Huayu prescription; hepatic failure; endotoxin;TLR4
王轩,男,医师,从事病毒性肝炎及肝衰竭防治工作。
E-mail:wangxuan_234@163.com
广州市医药卫生科技项目(2013A011039)
10.3969/j.issn.1008-8849.2015.34.005
R-332
A
1008-8849(2015)34-3778-04
2015-07-04
(1. The Fifth Affiliated Hospital of Guangzhou Medical University, Guangzhou 510700,Guangdong, China;2. Graduate School of Hunan University of TCM,Changsha 410007, Hunan, China)

