肺癌组织中Toll样受体9的表达及其对术后放疗生存的影响
高彩霞,乔田奎*,张 彬,袁素娟
(复旦大学附属金山医院肿瘤科,上海201508)
Toll样受体(Toll-like receptor,TLRs)是存在于哺乳动物且与Toll蛋白同源的分子,参与非特异性免疫。目前研究发现TLR9在多种肿瘤细胞中有表达,而且认为TLR9的表达参与了肿瘤细胞的增殖、侵袭和转移,影响着肿瘤的临床分期;也有报道肿瘤细胞TLR9高表达与放化疗抗拒有关,从而影响着肿瘤的放化疗结果。本文通过对63例在我院进行手术治疗的肺癌患者肿瘤组织TLR9阳性表达进行检测,旨在分析TLR9在肺癌组织中的表达特点及其对肺癌患者术后放疗生存的影响。
1 材料与方法
1.1 标本来源
收集2007年3月至2011年12月期间在本院进行手术切除的肺癌患者术后组织标本66例,病理蜡块保存完好,术前均未接受放化疗;其中鳞癌33例(角化型鳞癌和非角化性鳞癌各1例),腺癌27例(乳头状腺癌1例、肺泡癌2例),腺鳞癌3例,肉瘤样癌3例,小细胞肺癌2例,黏液腺癌1例(肠癌肺转移);局部淋巴结转移29例,无淋巴结转移37例,同侧肺内发生转移2例,发生胸壁肿瘤侵犯2例;剔除小细胞肺癌和肺转移癌病例,最终选择63例肺癌术后组织蜡块作为本实验的有效组织标本来源。
1.2 患者一般情况及随访资料
63例患者均在本院接受肺癌诊断和治疗,其中男性52例,女性11例,年龄最小36岁,最大76岁,中位年龄63岁,有吸烟史42例,无吸烟史者21例;2例患者接受单侧全肺切除术加局部淋巴结清扫,其余61例患者均为肺叶切除术加同侧肺门及纵膈淋巴结清扫。按照国际抗癌联盟(Union for International Cancer Control,UICC)1997年TNM分期标准,Ⅰ期12例、Ⅱ期35例、Ⅲ期12例、Ⅳ期4例(Ⅳ期患者中包括2例胸膜转移,1例胸壁局部侵犯和1例心包癌结节);纵隔淋巴结转移28例,35例无纵隔淋巴结转移;术后未行放疗者27例,术后放疗者36例,25例患者接受了术后化疗。术后化疗始于手术后1月左右,签订化疗知情同意书,化疗以含铂方案为主,NP(第1天和第8天盖诺30 mg/m2,第1~3天顺铂30 mg/m2)方案13例;TP(第1天多西紫杉醇100 mg/m2或紫杉醇135~175 mg/m2,第1~3天顺铂30 mg/m2)方案10例,GP(第1天和第8天吉西他滨1000 mg/m2,第1~3天顺铂30 mg/m2)方案2例,以术后化疗4个周期为准,7例患者完成4个周期化疗,13例患者完成2个周期化疗,5例患者因反应大未完成1个周期化疗,25例患者平均术后化疗2.5个周期。化疗期间常规止吐镇静抗过敏治疗,配合顺铂化疗加大补液量并给予呋塞米治疗;化疗后1周复查血常规,白细胞降低者给与升白治疗。
本组患者治疗结束后3个月开始进行随访,随访截止至2012年2月,术后2年每3个月随访1次,之后半年随访1次,随访时间最短为12个月,最长为56个月,中位随访时间38个月,期间记录患者无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS);截止随访结束死亡58例,均死于肿瘤局部复发或远处转移,4例仍然健在,1例失访,随访率为98.4%,随访形式以预约门诊为主,信函或电话随访作为补充。
1.3 术后放疗
依据美国国立综合癌症网络(National C omprehensive Cancer Network,NCCN)肺癌治疗指南进行肺癌术后放疗,针对切缘阳性患者和Ⅱb以上患者行术后放疗,放疗前进行卡氏评分和肺功能测定,静脉血化验血常规和肝肾功能,签订放疗知情同意书。共36例患者接受术后放疗,肺癌术后1~3个月开始术后放疗,或化疗后进行术后放疗。常规三维适形放疗体膜制作-定位-计划,CT扫描层厚4 mm,定位扫描图像直接传输至治疗计划系统(treatment planning system,TPS),常规勾画体表、肺脏、心脏及脊髓,肿瘤临床靶区(clinical target volume,CTV)包括气管支气管断端、同侧肺门淋巴结区、隆突下淋巴结区,右侧肺癌患者术后靶区CTV包括血管前气管后淋巴结区,左肺癌患者术后靶区CTV包括主动脉弓上淋巴结区和主动脉窗淋巴结区,CTV外放5 mm为计划靶区(planning target volume,PTV);计划要求95%等剂量线覆盖PTV,6 MV X射线三维适形放疗,三野或四野等中心照射,常规分割,处方剂量2 Gy/次,双肺平均剂量≤18 Gy,双肺V20(接受20 Gy照射的肺体积与肺总体积之比)≤30%,心脏剂量限制45 Gy,脊髓剂量限制45 Gy。对于手术切缘阳性患者,治疗50 Gy后缩野至支气管断端加量至56~60 Gy。36例患者均按计划完成术后放疗,未发生严重的放疗合并症。
1.4 实验方法
1.4.1 免疫组化SP法肿瘤组织蜡块4 μm切片固定,经二甲苯脱蜡、梯度乙醇水化,将切片置于0.01 mol/L(pH 6.0)柠檬酸盐缓冲液中进行微波抗原热修复,中高火修复40 min,室温冷却30 min,PBS冲洗;3% H2O2室温处理10 min,山羊血清室温孵育10 min,滴加稀释的一抗(鼠抗人TLR9单克隆抗体购自美国Abcam公司,TLR9稀释比1∶100),4 ℃过夜;滴加生物素标记的二抗(购自福州迈新生物技术有限公司),37 ℃孵育20 min,DAB显色(DAB显色试剂盒购自北京中杉金桥生物技术公司);经苏木精对比染色后脱水、透明、封片。用PBS代替一抗作为阴性对照。
1.4.2 结果判断TLR9蛋白阳性信号定位于细胞浆内呈棕黄色颗粒样物质。高倍镜下随机选取5个视野(×400),每个视野计数100个细胞,按染色细胞数和染色程度综合判断,最终结果采用双评分法:①按阳性细胞百分率评分。<25%为0分,≥25%~50%为1分,≥50%~75%为2分,≥75%为3分;②按染色强度评分。无显色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。将上述两项得分相加,0~1分为-,2~3分为+,4~5分为++,6分为+++,其中++~+++视为TLR9阳性表达,-~+视为TLR9阴性表达。
1.5 统计学分析
应用SPSS 17.0软件,TLR9与各临床病理特征之间的关系采用χ2检验;应用Kaplan-Meier法进行术后放疗单因素生存分析,采用对数Log-Rank检验和Cox比例风险模型进行术后放疗生存多因素分析。
2 结果
2.1 TLR9表达情况
免疫组化结果显示,TLR9蛋白定位于肺癌组织的肿瘤细胞质中,呈均匀的棕黄色颗粒样物质,而正常肺泡细胞内未见TLR9蛋白阳性表达(见图1);63例肺癌患者中TLR9阳性表达43例阳性表达率为68.3%;其中TLR9强阳性(+++)表达5例,TLR9未见表达5例。
2.2 TLR9阳性表达率与肺癌的临床病理特征分析
根据不同临床病理特征的TLR9表达情况进行单因素分析,见表1。结果显示:TLR9表达阳性率在肺癌不同性别、年龄、吸烟史、病变部位、有无术后放化疗、病理类型、TNM分期以及不同的肿瘤分化程度中差异均无统计学意义(P均>0.05);原发肿瘤直径和淋巴结转移情况不同的患者中,TLR9阳性表达率差异具有统计学意义(P均<0.05),提示TLR9表达与肺癌的肿瘤直径及淋巴结转移有相关性。
2.3 TLR9表达对肺癌患者术后生存的影响
截止随访结束,58例患者死亡,5例仍存活,OS中位值为34.0个月,PFS中位值为23.4个月,63例肺癌患者中,TLR9阴性和阳性表达的患者中位PFS依次为32.0±2.7和21.0±0.9,中位OS依次为47.0±8.0和31.0±1.1,TLR9阴性表达较TLR9阳性表达患者的PFS明显延长,TLR9阴性表达患者具有一个较长的OS。
进一步对36例术后放疗患者以不同TLR9表达水平(阴性或阳性)、淋巴结转移状况、病理类型(鳞癌或腺癌)以及肿瘤直径进行Kaplan-Meier单因素生存分析,采用对数Log-Rank检验,结果显示(见表2):肺癌病理类型与术后放疗患者的PFS有相关性(χ2=6.67,P=0.01),而对术后放疗患者的OS生存影响无统计学意义(P=0.07);淋巴结是否发生转移对术后放疗患者生存的OS影响有统计学意义(χ2=7.01,P=0.01),对PFS的影响无统计学意义(P=0.06);肿瘤直径对术后放疗患者生存的PFS和OS均显示出有统计学意义(P=0.00),肿瘤组织的TLR9表达状态对PFS和OS均有影响(P均=0.00),TLR9阴性表达的肺癌术后放疗患者具有较为明显的PFS和OS优势。
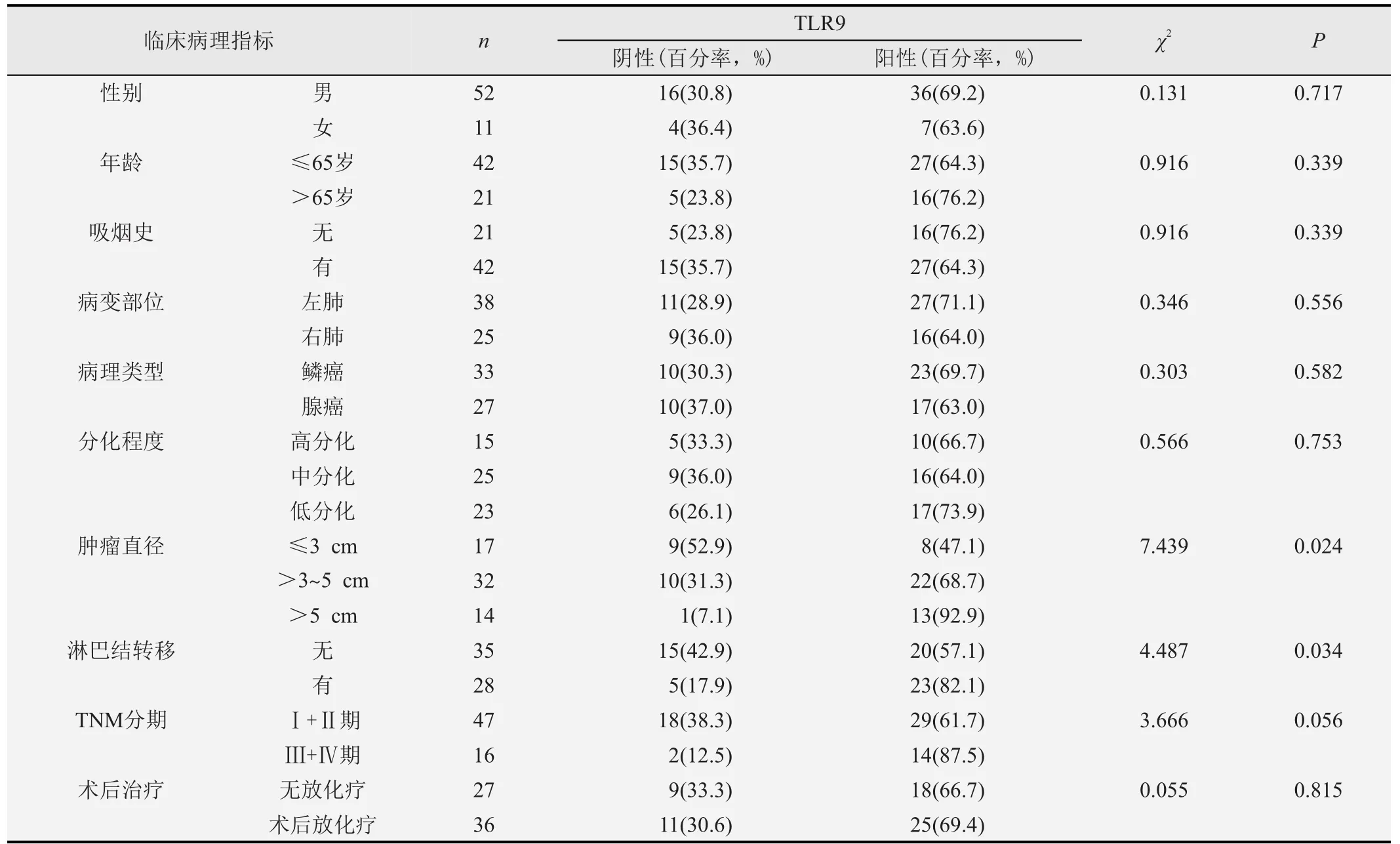
表1 肺癌的临床病理特征与TLR9表达
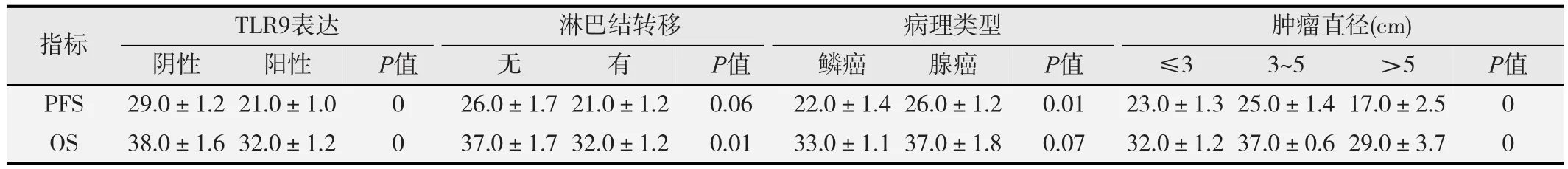
表2 36例肺癌患者术后放疗生存Kaplan-Meier单因素分析结果
2.4 肺癌术后放疗生存因素的Cox回归分析
将肺癌术后放疗生存的各因素作为自变量统一纳入Cox风险回归模型中,进行鳞癌或腺癌的肺癌病理类型、淋巴结转移、肿瘤直径和TLR9表达对肺癌术后放疗生存的预测分析,见表3。结果显示淋巴结转移和TLR9表达是肺癌术后放疗生存的独立预测因素(P值分别为0.020和0.003),淋巴结转移的相对危险度为2.809,TLR9表达的相对危险度为4.603,表明淋巴结转移和TLR9表达是预测肺癌术后放疗生存的风险因子。

表3 肺癌术后放疗生存的Cox回归结果
3 讨论
TLR9属于胞内受体,主要识别细菌和病毒DNA中的非甲基化CpG DNA配体,是TLRs的主要成员之一。已有研究证明[1-6],TLR9在乳腺癌、胃癌、肠癌、胰腺癌、肺癌、前列腺癌组织中表达增加,通过上调TLR9表达,一方面可以激活核转录因子AP-l、NF-κB促进肿瘤的生长,另一方面通过炎症介质合成增加参与肿瘤微环境的形成,从而促进肿瘤发生、增殖、侵袭和转移,进而影响肿瘤的临床分期[7]。
本研究针对63例肺癌患者,利用免疫组化SP法检测TLR9蛋白表达,结果TLR9蛋白在正常肺泡细胞中未见表达;而在肺癌组织中的阳性表达率为68.3%(43/63),其中TLR9强阳性表达5例(见图1);进一步将肺癌患者以性别、年龄、吸烟史、病变部位、肿瘤病理类型、肿瘤分化程度、肿瘤直径、淋巴结有无转移、TNM分期和术后有无放疗进行分组,比较组间TLR9表达,结果发现肿瘤直径、淋巴结有无转移与TLR9表达相关,肿瘤直径越大和发生淋巴结转移者,TLR9阳性率越高。而由于本研究例数较少,尽管与肿瘤TNM分期相关性的结果无统计学意义,但是P值达到0.056,因此更倾向于TLR9表达可能与肺癌TNM分期的存在相关性,与Qiu等[8]对乳腺癌TLR9在肿瘤体积大、有淋巴结转移以及分期较晚的患者中表达增强的结果相一致;在与肺癌性别、年龄、病理类型(鳞癌或腺癌)和肿瘤分化程度的相关性的统计学分析中,差异无统计学意义。
放射治疗是肺癌最重要的局部治疗手段,理论上术后放疗能有效增加肿瘤局部的控制率,减少局部肿瘤复发和远处转移的发生。Douillard等[9]研究中,840例非小细胞肺癌患者有232例接受术后放疗,仅有术后病理N2期(pN2)患者能从术后放疗中获得生存优势,其5年生存率提高仅有13%,多数患者最终死于肿瘤局部复发或淋巴结多发转移,因此肺癌术后放疗结果的影响因素仍不明朗。本研究团队在前期研究中发现[10],CpG ODN7909通过激活TLR9信号通路增加了放射抗拒肺癌细胞的放射敏感性,而TLR9表达状态对于肺癌术后放疗患者的生存是否有影响,这方面的临床研究还未见报道。本研究通过对36例肺癌术后放疗患者进行Kaplan-Meier生存分析,结果显示出TLR9阳性表达和肿瘤直径越大的患者PFS和OS均较短;对于发生淋巴结转移的患者,其术后放疗的OS明显缩短;传统理论认为,鳞癌属对放射治疗敏感的肿瘤,研究结果显示病理类型(鳞癌或腺癌)对术后放疗生存的PFS有影响。这无疑体现了肺癌术后放疗增加局部淋巴结转移控制率的优势,从而利于术后患者的生存。将以上影响术后放疗生存的诸因素纳入Cox比例风险模型,结果显示TLR9表达和淋巴结转移是影响肺癌术后放疗生存的独立风险因素,其相对危险度分别为4.603和2.809,因此TLR9高表达和发生淋巴结转移均不利于肺癌术后放疗患者的生存,TLR9则可能成为预测肺癌术后放疗生存的新的分子生物学因子。
通过本研究可以看出,TLR9信号通路的激活与肺癌肿瘤大小以及发生淋巴结转移关系密切,并且对肺癌术后放疗的预后产生影响。因本研究例数较少,统计数据可能出现偏差,希望今后针对更大样本量进行深入的研究。
[1] Schmanber B,Andndis M,Endrich S,et al.Toll-like receptors TLR4,TLR5 and TLR9 on gastric carcinoma cells: an implication for interaction with Helicobacter pylori[J].Int J Med Microbiol,2005,295:179-185.
[2] Jukkola-Vuorineo A,Rahko E,Vuopala KS,et al.Toll-like receptor-9 expression is inversely correlated with estrogen receptor status in breast cancer[J].J Innate Immun,2009,1(1):59-68.
[3] Droemarln D,Albrecht D,Gerdes J,et al.Human lung cancer cells express functionally active Toll-like receptor 9[J].Respir Res,2005,6(1):1-10.
[4] Wang C,Cap S,Ran Y,et al.TLR9 expression in glioma tissues correlated to glioma progression and the prognosis of GBM patients[J].BMC Cancer,2010,10:415.
[5] Wu HQ,Wang B,Zhu SK,et al.Effects of CpG ODN on biological behavior of PANC-1 and expression of TLR9 in pancreatic cancer[J].World J Gastroenterol,2011,17(8):996-1003.
[6] Väisänen MR,Jukkola-Vuorinen A,Vuopala KS,et al.Expression of Toll-like receptor-9 is associated with poor progression-free survival in prostate cancer[J]. Oncol Lett,2013,5(5):1659-1663.
[7] Chen K,Huang J,Gong W,et al.Toll-like receptors in inflammation,infection and cancer[J].Int Immunopharmacol,2007,7(10):1271-1285.
[8] Qiu J,Shao S,Yang G,et al.Association of Toll like receptor 9 expression with lymph node metastasis in human breast cancer[J]. Neoplasma,2011,58(3):25l-255.
[9] Douillard J. Impact of radiation on survival after complete resection of non small cell lung cancer:Descriptive analysis in the randomized adjuvant chemotherapy trial Anita 1[J].Int J Radiat Oncol Biol Phys,2006,66(3):2.
[10] Zha Lin,Qiao Tiankui,Yuan Sujuan,et al. Enhancement of radiosensitivity by CpG-oligodeoxyribonucleotide-7909 in human non-small cell lung cancer A549 cells[J]. Cancer Biother Radio,2010,25(2):165-170.

