Bhas 42细胞转化试验高通量检测方法的建立及应用
王颖,蒲江,齐乃松,文海若,王欣,胡燕平,宋捷,张海洲,王雪,*
(1. 中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室,北京100176;2.罗氏研发中国有限公司,上海201203)
非遗传毒性致癌物不通过作用于遗传物质产生致癌性,即不直接作用于DNA并产生相应的遗传损伤或突变,因此现有的遗传毒性试验方法无法将其检出。建立快速、简便、可靠的体外方法对非遗传毒性致癌物进行检测是当前安全性评价毒理学研究中亟待解决的问题,在药物早期研发阶段意义重大。本研究室利用导入v-Has-ras基因的Bhas 42细胞系,在成功建立了细胞转化试验高通量检测方法的基础上对Sasaki[1]建立的H2O2法进行了验证与改进,将试验结果量化从而实现了高通量筛选,提高了检测效率和结果判定的客观性。此外,我们将其应用在化学物致癌性研究中,对染料木黄酮(genistein,GEN)的潜在非遗传毒性致癌性进行了评价。
采用Bhas 42细胞进行的两阶段细胞转化试验是近些年发展起来的致癌物体外早期筛查的新方法,其特点是方便、快捷、经济。该试验分启动试验和促癌试验两部分。启动试验即在细胞对数生长期给予启动剂进行短暂处理,引起细胞基因突变而诱发转化,检测受试物的遗传毒性。而促癌试验是在细胞汇合后的生长静止期用促癌剂处理较长的时间,阻断细胞间通讯从而诱发转化,检测受试物的非遗传毒性[2]。Bhas 42细胞是将v-Has-ras基因转染到BALB/c 3T3细胞中建成的细胞系,被视为已处于启动状态,可根据细胞接种浓度、药物作用时间点和作用时间的不同[3],将遗传毒性和非遗传毒性致癌物的检测过程完全分开。因此该方法既可用于检测遗传毒性致癌物,也可检出非遗传毒性致癌物。该方法将试验周期缩短至3周[2,4], 可在短期内获得筛查结果,并对肿瘤发生发展不同阶段的细胞生物学特征进行研究[5-8]。
1 材料与方法
1.1 材料
1.1.1 实验细胞Bhas 42细胞系(日本健康科学基金会健康科学研究资源库,编号JCRB0149)由日本食品药品安全中心秦野研究所Sasaki博士馈赠。
1.1.2 试剂和仪器3-甲基胆蒽(3-methylcholanthrene,3-MCA,100 mg),佛波醇12-十四酸13-乙酸酯(12-O-tetradecanoylphorbol-13-acetate,TPA, 10 mg),GEN(25 mg),均购自Sigma; EMEM培养基(Eagle’s minimum essential m eduim),D MEM/F12培养基(Dulbecco’s m odified Eagle’s medium/ Ham’s F12),胎牛血清(批号737443) 均购自Gibco;H2O2(30%),购自国药集团化学试剂有限公司;Cell Counting Kit-8试剂盒(CCK-8),购自南京凯基生物科技发展有限公司;SPECTRA max-PLUS型酶标仪,购自Molecular Devices公司。
1.1.3 试剂配制启动试验和促癌试验分别以3-MCA和TPA为阳性对照,DMSO为阴性对照。3-MCA、TPA、染料木黄酮(GEN)均以DMSO为溶剂,配制成高浓度悬液储备液,-20 ℃条件下冻存。参照文献[4],3-MCA和TPA使用的终浓度为1 μg/mL和50 ng/mL,用配制1000×的储备液(3-MCA:1 mg/mL;TPA:50 μg/mL)进行稀释。GEN储备液的配制浓度为30 mg/mL。DMSO的终浓度为0.1%。
1.2 方法
1.2.1 细胞培养与冻存试验前扩增冻存Bhas 42细胞。Bhas 42细胞用含有15%胎牛血清的EMEM培养基,在37 ℃、CO2体积分数为5%的孵箱中培养。当细胞汇合度达到70%时,用PBS清洗后用0.25%的胰酶消化细胞,将细胞密度调至5×105/mL,重悬于新鲜的含5% DMSO、15%胎牛血清的EMEM培养基中,将细胞悬液分装于冻存管中,每管0.5 mL,并冻存于液氮中。在进行细胞转化试验时,为降低细胞的自发转发率,每次进行转化试验都需要重新复苏1个冻存管进行试验。
1.2.2 高通量检测方法[1,4]转化试验的结果判定采用细胞灶法和H2O2法两种方法。两种方法分别进行启动试验和促癌试验,每个试验设置的阳性、阴性组(H2O2法加设空白对照组),每组1个96孔板。
细胞灶法是以接种当日为第0天,消化细胞并调整细胞密度至4×103/mL,启动试验和促癌试验分别以每孔200、400个细胞的密度接种于96孔板,24 h后启动试验组将细胞暴露于受试物,处理3 d后更换新鲜培养基。促癌试验组于第4天更换为含TPA的培养基,作用10 d,每3 d换一次液,第14天更换为不含受试物的新鲜培养基。连续培养至第21天,用甲醇固定10 min,5% Giemsa染色30 min,计数转化灶个数。
H2O2法是在细胞灶法的基础上进行改进。连续培养至第19天时每孔加入50 μL 0.0016%的H2O2,共同培养24 h。第20天加入CCK-8(终浓度为5%)染色,培养4 h后,测定450 nm下的吸光度。之后用0.25%戊二醛固定,5% Giemsa染色,计数转化灶。
1.2.3 细胞生长试验在进行转化试验前,需要进行细胞生长试验以确定受试物对细胞的毒性作用。启动试验组和促癌试验组分别以每孔200和400个细胞的密度接种于96孔板,24 h后启动试验组不换液,配制含二倍终浓度GEN的培养基,使GEN以30、10、3、1、0.3、0.1、0.03、0.01 μg/mL的终浓度处理细胞,第4天更换不含药的新鲜培养基。促癌试验组于第4天时更换为含有不同浓度GEN的培养基,同样处理3 d。第7天采用结晶紫(crystal violet,CV)染色并于570 nm波长下测定吸光度,计算相对生长率,确定最适药物浓度。每个浓度至少8个复孔,并设置只含有培养基的空白对照孔。相对生长率计算方法如下式:
相对生长率(%)=[D(570)处理组-D(570)空白组]/[D(570)阴性组-D(570)空白组]×100%
D(570)处理组为药物处理孔的吸光度;D(570)空白组为空白对照孔的吸光度;D(570)阴性组为阴性对照孔的吸 光度。
1.2.4 细胞转化试验根据细胞生长试验结果选定5个浓度进行细胞转化试验,具体操作方法同1.2.2中的H2O2法。进行转化试验的同时也要对选定的药物浓度进行并行的细胞生长试验,每个浓度至少采用一块96孔板进行转化检测,且至少8个孔用于并行的细胞生长试验,并设立阳性、阴性及空白对照组。实验流程见图1、2。
1.3 结果判定方法
细胞转化灶的形态特征表现为:①多于100个细胞;②纺锤形细胞不同于接触抑制性单层细胞(纺锤形的);③强嗜碱性染料(嗜碱的);④在转化灶的边缘(交叉)细胞随机定位;⑤密集的多层排列的细胞(堆积);⑥侵入性生长到周边接触抑制性细胞的单层内。对96孔板中含有细胞灶的孔进行计数,表示为孔/板。
1.4 统计学方法
用SPSS 19.0进行数据的统计处理。细胞灶法的结果采用卡方检验,H2O2法的结果采用t检验。GEN各浓度的转化试验结果采用Dunnett-t检验[1,4,9],当受试物存在两个或两个以上浓度组的D(450)相对于阴性对照组有显著性差异,则该受试物是阳性的。当受试物存在一个或不连续浓度组的D(450)相对于阴性对照组有显著性差异,则该受试物是可疑的。当受试物各个浓度组的D(450)相对于阴性对照组均无显著性差异,则该受试物是阴性的。
2 结果
2.1 高通量检测方法的建立
经H2O2处理前,可在镜下观察到启动试验3-MCA组和促癌试验TPA组细胞形态由正常的长梭形变为短梭状,呈复层生长,细胞之间失去接触抑制并形成转化灶,转化灶边缘细胞随机排列,形成交叉和旋涡。而启动试验DMSO组和促癌试验DMSO组的细胞大小、形态基本一致并表现出良好的接触性抑制,仅见少数细胞出现自发转化,且转化灶较小。H2O2作用24 h后,大部分正常细胞皱缩成圆形并死亡,该处理对转化细胞无显著影响。细胞灶法在第21天进行固定染色。启动试验3-MCA组和促癌试验TPA组可见细胞发生明显的形态变化,失去接触抑制,形成交叉和旋涡。细胞复层生长,产生的转化灶较明显。而启动试验DMSO组和促癌试验DMSO组只有极少数细胞出现自发转化,且转化效果不明显,大部分细胞形态正常,呈长梭形(见图3)。
计数各组转化灶并进行统计分析。在细胞灶法中,启动试验3-MCA组、促癌试验TPA组的转化灶个数分别与启动、促癌试验DMSO组相比明显升高(P<0.01)。在H2O2法中,启动试验3-MCA组、促癌试验TPA组的转化灶个数、D(450)分别与启动、促癌试验DMSO组相比均明显升高(卡方检验,P<0.01)。此外H2O2法试验组利用酶标仪进行检测,阳性组的D(450)相对于阴性组也提示显著性差异( t 检验,P<0.01),结果见表1。
表1 细胞灶法和H O法细胞转化试验结果(n=96,±s)22
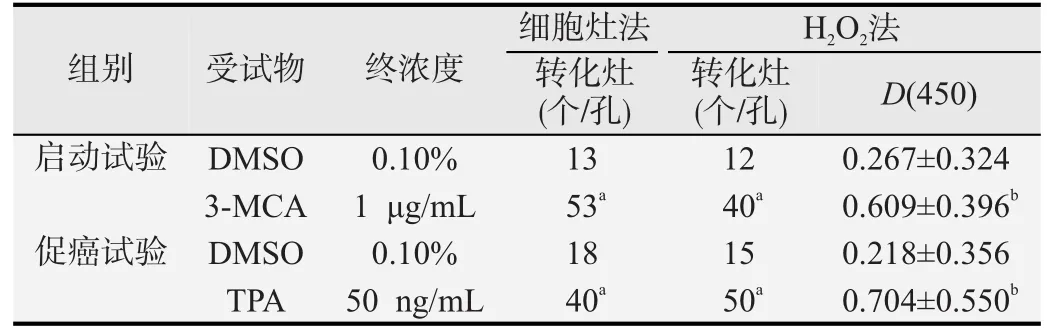
表1 细胞灶法和H O法细胞转化试验结果(n=96,±s)22
a:卡方检验,与DMSO组比较,P<0.01; b:t 检验,与DMSO组比较,P<0.01.
细胞灶法H2 O2法组别受试物终浓度转化灶(个/孔)转化灶(个/孔)D(450)启动试验DMSO 0.10%13120.267±0.3243-MCA 1 μg/mL 53a 40a 0.609±0.396b促癌试验DMSO 0.10%18150.218±0.356 TPA 50 ng/mL 40a 50a 0.704±0.550b
2.2 细胞生长试验
选择不同浓度的GEN处理细胞,第7天通过CV染色结果计算其相对生长率,启动试验和促癌试验各组数据见表2。基于生长试验结果设立5个浓度等级进行转化试验。在启动试验中,药物浓度等级覆盖范围从最高毒性(相对于对照组的生存率小于20%)到几乎无毒性。理想状态下在致癌检测中所作的评价[4],一个浓度等级低于无作用之剂量(no-observed effect level,NOEL),两个浓度等级介于NOEL与IC50之间,两个浓度等级介于IC50和IC90之间。由于在启动试验中,药物浓度大于1 μg/mL几乎没有毒性,低于1 μg/mL时相对生长率急剧下降且低于20%,因此选择0.03、0.1、0.3、1、3 μg/mL作为转化试验中启动试验组药物作用浓度。在促癌试验中,所选择的检测浓度范围覆盖从对细胞生长具有生长促进作用的浓度到对细胞生长几乎没有作用的浓度。由表2可看出,促癌试验中GEN对细胞具有较弱的促生长作用,浓度为0.03、0.1、0.3、1、3 μg/mL时的相对生长率均大于50%,因此选择其作为转化试验促癌试验组药物作用浓度。
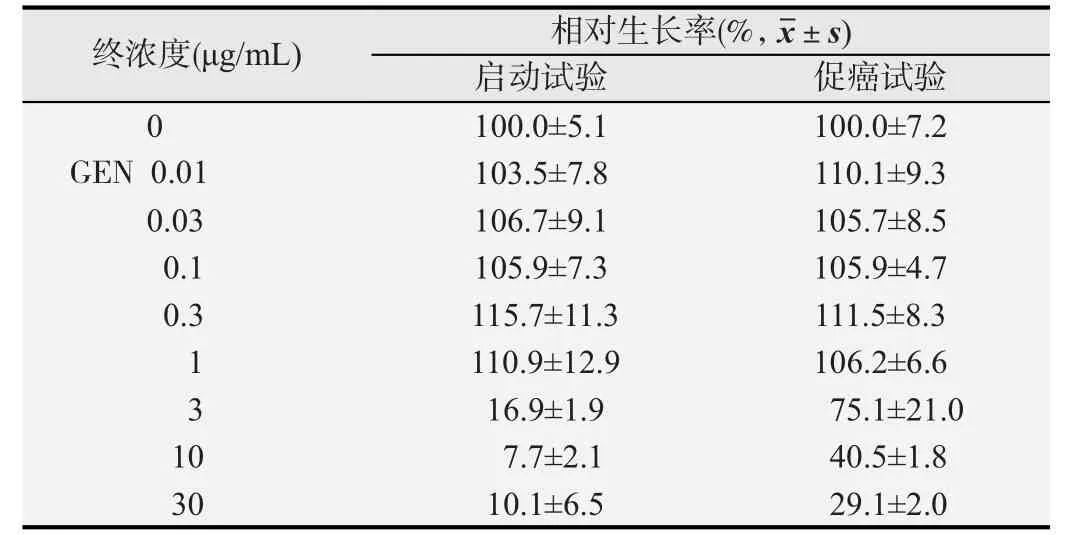
表2 染料木黄酮(GEN)对Bhas 42细胞生长的影响(n=8)
2.3 细胞转化试验
于第7天测定细胞的相对生长率和第20天测得的D(450)结果见图4。并采用Dunnett-t检验进行统计分析。启动试验GEN各浓度组D(450)相对于启动试验DMSO组均无明显差异。而当促癌试验GEN终浓度为0.03、1、3 μg/mL时相对促癌试验DMSO组明显升高(P<0.01)。表明GEN无遗传毒性,而具有非遗传毒性。
3 讨论
非遗传毒性致癌物的相关检测方法近年来发展迅速,如针对细胞间隙连接通讯障碍、EB病毒早期抗原(EBV-EA)的表达、基因表达谱的改变等机制或生物标志物对非遗传毒性致癌物进行检测。然而以上方法目前均未形成标准化方法,应用尚不广泛。
虽然通过观察转化灶判定细胞转化试验结果的细胞灶法已经获得广泛认可,但因较为费时和主观性的缺点大大限制了该方法的发展。为快速而客观地评价转化效率,Sasaki[1]对方法学进行了改良,采用分光光度法而非人工计数法来测定转化效率(即H2O2法)。如Bhas 42细胞的培养皿中含有转化灶,H2O2处理可选择性杀死正常细胞,但对转化灶无明显影响。H2O2法可结合自动化仪器的使用实现高通量选择,跳过固定、染色、洗板、晒干等一系列过程。实验人员也不必经过鉴定转化灶的专业培训便可完成结果的判定。结果更为客观,且极大地节省了实验成本。
本研究对Sasaki建立的H2O2法进行了验证与改进,将H2O2作用时间点从第21天改至第19天,进一步缩短试验周期,并对H2O2浓度和CCK-8的作用时间根据实际条件进行了调整。为验证该试验结果的准确性,测定D(450)后对细胞进行戊二醛固定和Giemsa染色。比较D(450)可发现,含有转化灶的孔D(450)较高,而没有转化灶的孔D(450)很低甚至接近空白孔,具体的选择机制还有待深入研究。但经统计分析获得的结果与细胞灶法结果基本一致,验证了该方法的准确性与可靠性。
本研究室成功建立了Bhas 42细胞转化试验高通量检测方法,并将其应用在非遗传毒性致癌物研究中。植物雌激素是植物中具有弱雌激素作用的化合物,可通过与甾体雌激素受体以低亲和度结合而发挥弱的雌激素样效应,具有组织特异性,在不同组织中发挥雌激素或抗雌激素作用。GEN是大豆异黄酮的一种苷元形式,是大豆异黄酮中最有效的功能成分[10]。在结构上与哺乳动物的雌激素雌二醇相似,具有雌激素的活性基团二酚羟基,与雌激素受体的亲和力比雌二醇低100倍。迄今为止,植物雌激素的抗肿瘤、预防骨质疏松、减轻更年期综合症等有益作用及机制逐渐被发现[11]。许多人除在饮食中摄入外,还主动摄入含有植物雌激素的保健品,GEN的安全性日益引起人们的关注。微团培养模型研究表明GEN是强致畸物[12],且孕酮等雌激素有促进Bhas 42细胞转化的作用[1],是非遗传毒性致癌物。本研究应用Bhas 42细胞转化试验检测GEN的细胞转化作用,以评价GEN的遗传毒性和非遗传毒性。细胞生长试验结果表明GEN对细胞生长有一定的促进作用,但当GEN浓度高于3 μg/mL时,表现出抑制细胞生长的作用。两次生长试验结果基本一致,表明两次试验细胞的状态基本一致,验证了试验的可重复性。转化试验结果显示,GEN在启动试验中各剂量组和对照组比较,差异均无统计学意义,表明GEN无遗传毒性。而在促癌试验中,有3个浓度相对对照组差异显著,且有两个为连续浓度,表明在本实验条件及剂量范围内,GEN在促癌阶段可促进Bhas 42细胞发生恶性转化。因此初步认为GEN具有非遗传毒性,属于非遗传毒性致癌物。目前对GEN的促癌机制尚不明确。有文献报道[13]GEN在人体可能达到的血清浓度下,可抑制HaCaT细胞的细胞间隙连接通讯功能,提示在一定条件下可能有促癌作用。另一项研究则提示[14]GEN对N-甲基-N´-硝基-N-亚硝基胍(N-methyl-N´-nitro-N-nitrosoguanidine,MNNG)所诱发的NIH 3T3细胞恶性转化有明显的抑制作用,推测其可能是化学致癌过程的抑制剂。GEN与苯并[e]芘共同作用时细胞转化率高中于单独使用苯并[e]芘,但与TPA共同作用时,抑制3-MCA诱导的BALB/c-3T3细胞转化[15],推测GEN既可诱导细胞恶性转化,又可抑制细胞恶性转化,具有双重性。
[1] Sasaki K. A method for selecting mammal transformed cells:Europe,09169631.0[P]. 2011-8-17.
[2] 王颖,王雪,李波. 两阶段细胞转化试验研究进展[J]. 中 国新药杂志,2013,22(10):1133-1136.
[3] Muramatsu D,Sasaki K,Kuroda S,et al. Comparison of sensitivity to arsenic compounds between a Bhas 42 cell transformation assay and a BALB/c 3T3 cell transformation assay[J]. Mutat Res,2009,675:66-70.
[4] Sakai A,Sasaki K,Muramatsu D,et al. A Bhas 42 cell transformation assay on 98 chemicals:The characteristics and performance for the prediction of chemical carcinogenicity[J].Mutat Res,2010,702:100-122.
[5] Yamakage K,Sui H,Ohta R,et al. Genotoxic potential and in vitro tumour-promoting potential of 2-dodecylcyclobutanone and 2-tetradecylcyclobutanone,two radiolytic products of fatty acids[J]. Mutat Res Genet Toxicol Environ Mutagen,2014,770(1):95-104.
[6] Weisensee D,Poth A,Roemer E,et al. Cigarette smokeinduced morphological transformation of Bhas 42 cells in vitro[J].Altern Lab Anim,2013,41(2):181-189.
[7] Ohmori K,Sato Y,Nakajima D,et al. Characteristics of the transformation frequency at the tumor promotion stage of airborne particulate and gaseous matter at ten sites in Japan[J]. Environ Sci Process Impacts,2013,15(5):1031-1040.
[8] Benigni R,Bossa C,Tcheremenskaia O. In vitro cell transformation assays for an integrated,alternative assessment of carcinogenicity:a data-based analysis[J]. Mutagenesis,2013,28(1):107-116.
[9] Corvi R,Aardema M,Gribaldo L,et al. ECVAM prevalidation study on in vitro cell transformation assays:General outline and conclusions of the study[J]. Mutat Res,2012,744:12-19.
[10] Kim Sh,Kim Cw,JeonSy,et al. Chemopreventive and chemotherapeutic effects of genistein,a soy isoflavone,upon cancer development and progression in preclinical animal models [J]. Lab Anim Res,2014,30(4):143-150.
[11] Mahmoud Am,Yang W,BoslandMc. Soy isoflavones and prostate cancer:a review of molecular mechanisms [J]. J Steroid Biochem M ol Biol,2014,140(1):116-132.
[12] 肖杨,刘然,刑丽娜,等. 采用微团培养模型探讨染料木黄酮的发育毒性[J]. 癌变·畸变·突变,2010,22(4):271-275.
[13] 严继承,郑季彦,郑一凡,等. 几种植物雌激素对细胞间隙连接通讯的影响[J]. 中 华预防医学杂志,2005,2:55-57.[14] 王晨,张立实,何涛. 染 料木黄酮对NIH/3T3细胞体外短期转化实验的影响[J]. 中 国公共卫生,2002,16(11):48-49.
[15] 王李伟,仲伟鉴,应贤平,等. 三 羟异黄酮对BALB/c-3T3细胞的转化作用[J]. 癌 变·畸变·突变,2005,27(1):48-51.

