Caspase-8、Caspase-9在急性百草枯中毒大鼠肾组织中的表达及作用研究
王 鑫,赵艳霞,李海霞,李爱军
(河北省邯郸市中心医院,河北 邯郸 056002)
Caspase-8、Caspase-9在急性百草枯中毒大鼠肾组织中的表达及作用研究
王 鑫,赵艳霞,李海霞,李爱军
(河北省邯郸市中心医院,河北 邯郸 056002)

目的 观察Caspase-8、Caspase-9在急性百草枯中毒大鼠肾组织中的表达情况,并探讨二者在百草枯中毒肾损伤中所起的作用。方法 将140只SD大鼠(雌雄各半)随机分成对照组70只、染毒组70只,对照组给予生理盐水灌胃,染毒组给予50 mg/kg百草枯灌胃染毒。2组分别于灌胃后1,3,7,14,21,28,35d取肾组织标本行光镜下观察肾组织病理变化,用免疫组化染色法测定Caspase-8、Caspase-9的表达情况,原位末端标记法(TUNEL法)标记凋亡细胞。结果 染毒组大鼠肾组织中Caspase-8从第1天就明显表达,第3天达到高峰,第35天虽有下降,但仍高于对照组;而Caspase-9的表达第1天明显增加,第14天达到高峰,第35天仍明显高于对照组。染毒组第3天凋亡指数增加,第21天达到高峰,第35天仍高于对照组。结论 Caspase-8、Caspase-9在百草枯中毒大鼠肾组织的表达发生改变,细胞凋亡是百草枯导致肾损伤的机制之一。
百草枯;中毒;Caspase-8;Caspase-9;肾损伤;细胞凋亡
百草枯(paraquat,PQ) 是一种有机杂环类除草剂,随着其在农业上的广泛应用,百草枯中毒也日益增多。它对人畜毒性很高,误服后病死率在50%~70%[1]。百草枯中毒可导致多脏器损伤,主要是肺脏,其次是肾脏,其以原形从肾脏排出,因此肾功能的损伤程度对百草枯在体内的清除至关重要。然而,百草枯中毒导致肾损伤的具体机制还未完全阐明。半胱氨酸天冬氨酸蛋白酶(Cysteine aspartic acid protease,Caspase)是细胞凋亡的重要传导通路,Caspase-8、Caspase-9 分别是线粒体途径和内源性途径的代表性凋亡因子,对凋亡过程有重要调控效应作用[2]。但二者在百草枯中毒所致肾损伤中的表达变化在国内外还鲜有报道。本研究通过观察、测定Caspase-8、Caspase-9在百草枯中毒大鼠肾脏中表达情况,探讨它们在百草枯中毒导致肾损伤中的作用,现将结果报道如下。
1 实验资料
1.1实验动物及试剂 健康成年清洁级Sprague Dawley大鼠80只(雌雄各半),体质量250~300 g,由河北医科大学实验动物中心提供,动物合格证号:SCXK(冀)2011-0004。20%百草枯溶液由英国先正达公司提供,SABC免疫组化染色试剂盒、兔抗鼠Caspase-8多克隆抗体、兔抗鼠Caspase-9多克隆抗体、原位末端标记(TUNEL)试剂盒均由武汉博士德生物工程有限公司生产提供。
1.2 动物分组及模型制备 将170只Sprague Dawley大鼠随机分成对照组70只和染毒组70只。对照组用1 mL生理盐水一次性灌胃。染毒组将百草枯50 mg/kg用生理盐水稀释至1 mL一次性灌胃建立中毒模型。2组分别于灌胃第1,3,7,14,21,28,35天取10只,麻醉下取肾组织标本,常规石蜡包埋连续切片以备HE染色、免疫组化染色及TUNEL法标记。
1.3 免疫组化染色及TUNEL染色 按照SABC试剂盒说明书进行免疫组化染色,从肾上极取出肾组织,中性甲醛液固定,制成石蜡切片,镜下观察每张切片的阳性细胞。以细胞浆和/或细胞核出现棕黄色颗粒为阳性细胞,应用免疫组化分析软件(北京航天航空大学医学图像分析系统监测处理),每张切片随机选取10个不重叠的10×40倍显微镜视野,分别计算每个视野内阳性染色的平均光密度,取其平均值进行统计学处理。TUNEL法标记:严格参照检测试剂盒说明书对肾组织切片进行染色,结果判定:细胞浆和/或细胞核出现棕黄色颗粒为阳性细胞,每张切片随机选取10个不重叠的10×40倍显微镜视野,计算出平均阳性细胞百分数。
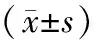
2 结 果
2.12组大鼠肾组织病理学比较 对照组光镜下观察可见肾小管、肾小球结构清晰,肾间质及血管周围无充血、无炎细胞浸润,见图1。染毒组于染毒后肾小球内就开始出现红细胞增多,肾间质不同程度的充血、水肿,可伴有小灶状、大片状炎性细胞浸润。染毒后第1天,可观察到肾小管上皮细胞空泡样变性、水肿,管腔轻度狭窄,偶尔出现上皮细胞脱落坏死;第21天,肾小管上皮细胞严重水肿,可看到核破裂、溶解、胞浆脱失,上皮细胞大量坏死、脱落,管腔内有不同程度的狭窄,见图2;第28天以后上皮细胞水肿减轻,肾小管管腔内坏死物逐渐减少。
2.2 大鼠肾组织中Caspase-8表达情况 对照组肾组织中Caspase-8轻度表达,见图3。染毒组Caspase-8的表达主要位于肾小管上皮细胞中,在细胞质和细胞核中可观察到棕黄色颗粒,第1天表达就明显增强(P<0.01),第3天阳性表达最强(见图4),此后开始缓慢下降,第14天、第28天仍明显强于对照组(P<0.01或P<0.05)。见表1。
2.3 大鼠肾组织中Caspase-9表达情况 对照组肾组织中Caspase-9轻度表达,见图5。染毒组第1天肾组织中Caspase-9即有高表达,细胞质中出现棕黄色颗粒,其表达呈持续高水平第14天达到高峰(见图6),到第35天仍高于对照组(P<0.01)。见表2。
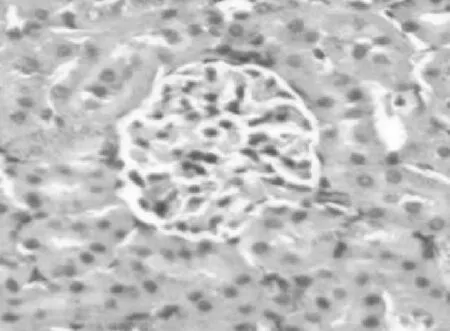
图1 对照组第21天肾组织HE染色表现(400×)
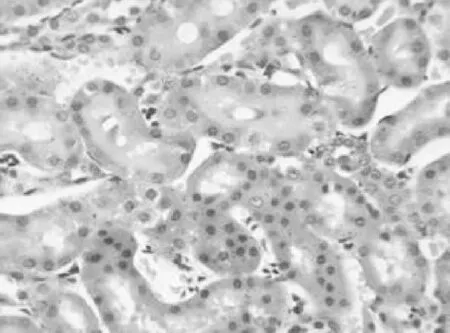
图2 染毒组第21天肾组织HE染色表现(400×)
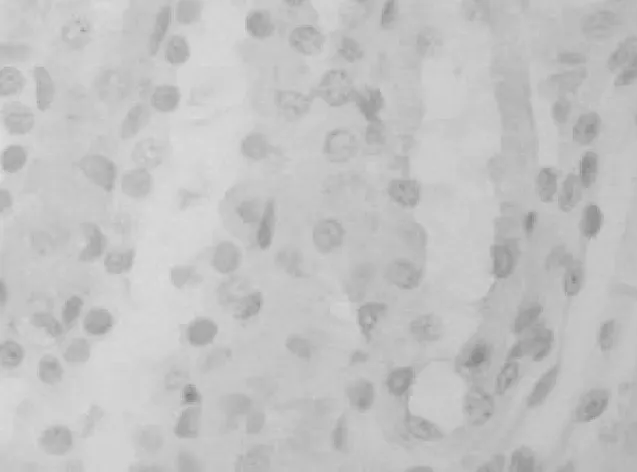
图3 对照组第3天肾组织中Caspase-8表达情况(400×)
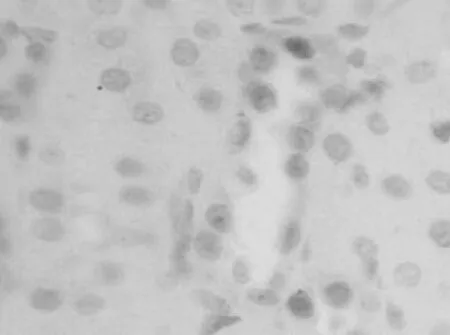
图4 染毒组第3天肾组织中Caspase-8表达情况(400×)
2.4 大鼠肾组织中TUNEL测定结果 对照组、染毒组第21天肾组织中TUNEL标记阳性凋亡细胞情况见图7及图8。染毒组第3天时在肾小管可观察到标记阳性的凋亡细胞,在第7天时明显增加(P<0.01),第21天时达到高峰,第28天时虽有下降,但仍明显高于对照组(P<0.01),第35天时仍高于对照组(P<0.05)。见表3。
表1 不同时点大鼠肾组织中Caspase-8表达情况
注:①与对照组比较,P<0.01;②与对照组比较,P<0.05。

图5 对照组第14天肾组织中Caspase-9表达情况(400×)
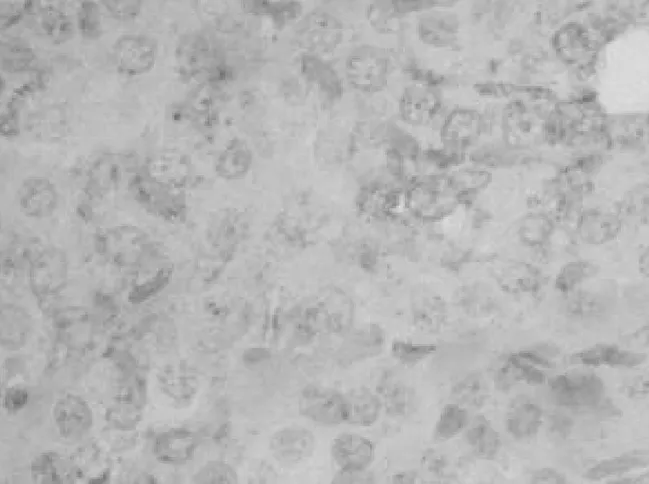
图6 染毒组第14天肾组织中Caspase-9表达情况(400×)
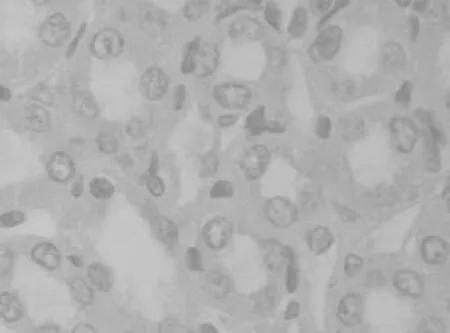
图7 对照组第21天时肾组织TUNEL标记阳性凋亡细胞情况(400×)
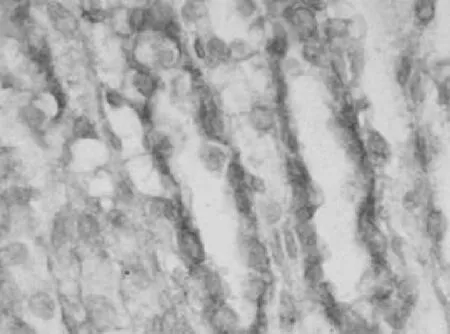
图8 染毒组第21天时肾组织TUNEL标记阳性凋亡细胞情况(400×)
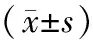
表2 不同时点大鼠肾组织中Caspase-9表达情况
注:①与对照组比较,P<0.01。
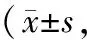
表3 不同时点大鼠肾组织中TUNEL标记凋亡细胞情况%)
注:①与对照组比较,P<0.05;②与对照组比较,P<0.01。
3 讨 论
百草枯是1,1’-二甲基-4,4’-联吡啶二氯化物,分子式为C12H14N2·2Cl。由于它对周围环境无害,而且除草效果好,因此在全世界范围内广泛应用[3]。如果使用不当、误服、自杀性服用都可导致中毒,一旦中毒,病程进展快且尚无特效解毒药物,临床上病死率很高。百草枯导致的肺损伤以及多脏器功能衰竭是死亡的主要原因,但其进入机体后,以分子原形从肾脏排泄,肾功能的健全对清除体内已吸收的百草枯至关重要,因此肾损伤是影响预后的重要因素。本实验观察到急性百草枯中毒大鼠肾小管上皮细胞出现程度不同的水肿、变性、坏死、脱落,肾小管管腔变窄,肾间质充血、水肿,有小灶状或大片状炎细胞浸润,提示百草枯可引起肾损伤。但其肾损伤的具体机制还不十分清楚。目前研究认为,百草枯引起的肾损伤可能与其联吡啶阳离子的氧化、还原反应生成的大量氧自由基有关[4]。大量活性氧(ROS)的产生,不仅引起细胞膜的脂质过氧化、线粒体结构和功能的破坏、细胞内的DNA双链损伤,还可以诱导细胞凋亡。丁正同等[5]发现百草枯中毒小鼠黑质多巴胺能神经元有凋亡现象。Takeyama等[6]将肺泡上皮细胞暴露于低浓度百草枯中也发生了凋亡现象。
凋亡是一种自然生理过程,在细胞的生长、发育、分化及维持细胞的数量和质量,稳定内环境等方面起着重要作用。在凋亡的效应节段和控制中心,Caspase是细胞凋亡的效应器,它可以和许多底物起反应,导致凋亡细胞发生特有的生化和形态学改变,因此它的活化是最为关键的环节。目前发现,参与凋亡的Caspase可分为2大类:一类是启动Caspase,成员有Caspase-2,8,9,10等;另一类是效应Caspase,包括Caspase-3,6,7等[7]。在哺乳动物中,Caspase的激活有2个主要信号通路:一是TNFR/NGFR家族成员Fas、TNFR1、DR3、DR4及DR5等参与的死亡受体介导的外源性途径,另一个是以线粒体、细胞色素C(CytC)为中心的内源性凋亡通路。2条通路不是相互独立的过程,在信号启动、传导、信号调节等方面各不相同,但又有相似之处及交汇点。在外源性途径中,死亡受体Fas、TNFR1、DR3、DR4及DR5等是位于细胞膜表面的跨膜蛋白,属于TNFR/NGFR家族成员,这些膜蛋白在细胞外具有与其特异性的配体相结合继而诱导凋亡的死亡信号激发域,在细胞内含有转导细胞凋亡信号所必需的死亡功能域,当细胞膜表面的死亡受体受到其配体或其他激动性抗体激活后,受体分子相互交联,其死亡功能域聚集成簇,细胞内接头蛋白FADD相应的死亡功能域与聚体成簇的受体分子的死亡功能域结合而被募集,聚集在一起的FADD通过N端的DED结合pro-Caspase8的DED,从而使pro-Caspase8进行寡聚化,死亡受体、接头蛋白FADD、pro-Caspase8以串联的形式,组合形成死亡诱导信号传导复合体(DISC)[8]。DISC中的pro-Caspase8发生自身裂解成为有催化活性的Caspase-8,从而激活下游的效应因子Caspase-3、Caspase-6和Caspase-7,启动级联反应的凋亡程序;同时活化的Caspase-8还可以使Bcl-2家族中促凋亡相关蛋白Bid裂开,诱导线粒体外膜通透性发生改变,导致线粒体膜电位崩解,引起凋亡相关因子的释放,激活Caspase-9,最后激活效应器Caspase-3,进入内源性线粒体凋亡通路,引起细胞凋亡[9]。在内源性凋亡通路中,细胞内外的死亡信号传递到线粒体,细胞色素C(CytC)释放出来,和dATP作为复合因子与胞液中凋亡蛋白酶激活因子1(Apaf-1)结合,提供能量诱导Apaf-1自身聚集,形成Apaf-1多聚物,该多聚物募集Caspase-9组成高分子量的复合物,称为凋亡小体,凋亡小体中的Caspase-9构象发生改变而活化,进而激活下游的Caspase-3[10]。
本研究中观察到染毒大鼠肾组织中Caspase-8、Caspase-9的表达明显高于正常对照组,凋亡细胞率显著升高。表明由Caspase-8、Caspase-9调控和介导的凋亡过程在肾组织的损伤中可能发挥重要作用。但在实验中发现, Caspase-8在第3天达到峰值,Caspase-9在第14天达到峰值,Caspase-9达峰值时间晚于Caspase-8,这可能与Caspase-9既可以通过内源性凋亡通路激活,又可以在外源性通路中被有催化活性的Caspase-8激活有关。通过TUNEL检测凋亡细胞,结果观察到凋亡细胞率的高峰值与Caspase-8、Caspase-9的高表达在时间点上不同步。导致这种结果的原因可能有以下几个:①细胞凋亡是十分复杂的过程,受到多因子及多种因素的调控。Caspase-8、Caspase-9的表达增加并不一定说明凋亡反应的增强。最近的研究发现,Caspase在凋亡级联反应中,分子的某个部位可能发生化学修饰,使其活性发生改变[11]。Caspase-8的甲基化程度及阳性表达与凋亡指数成正相关,在凋亡过程中起着重要的调节作用,而磷酸化修饰的Caspase-9活性在级联反应中受到抑制[12]。②虽然Caspase-8、Caspase-9呈高表达,但在此时间点上,凋亡蛋白抑制因子的作用也可能增强[13]。③细胞凋亡过程是多基因、多步骤的复杂过程,在不同的时间点,组织细胞对凋亡刺激的应答能力可能存在不同,这需要运用基因检测,分子生物学技术等多种更精确的检测方法进一步阐明其发生机制。
虽然目前百草枯中毒导致肾损伤的具体机制尚未完全阐明,也无特效治疗方法,但大量的ROS及Caspase-8、Caspase-9的高表达可能是促进疾病进展的关键因素,因此明确Caspase-8及Caspase-9表达调控机制并予以干预,可能是治疗百草枯中毒的新途径之一。
[1] 中国医师协会急诊医师分会.急性百草枯中毒诊治专家共识(2013)[J].中国急救医学,2013,33(6):484-489
[2] Jeong SY,Seol DW,et al.The role of mitochondria in apoptosis[J].BMB Rep,2008,41(1):11-12
[3] 闫伟华,杨长成.泥浆水洗胃对急性百草枯农药中毒患者存活率的影响[J].中国社区医师:医学专业,2012,14(21):69-70
[4] 胡建秀.血液灌流联合血液透析对百草枯中毒血药浓度及预后的影响[J].中国误诊学杂志,2011,7(15):3581
[5] 丁正同,任惠民,蒋雨平,等.百草枯致小鼠黑质部多巴胺能神经细胞凋亡的作用[J].中国临床神经科学,2003,11(1):53-56
[6] Takeyama N,Tanaka T,Yabuki T,et al.The involvement of p53 in paraquat-induced apoptosis in human lung epithelial-like cells[J].Int J Toxicol,2004,23(1):33-40
[7] Chen YL,Li JH,Yu CY,et al.Novel cationic antimicrobial peptide GW-H1 induced caspase-dependent apoptosis of hepatocellular carcinoma cell lines[J].Peptides,2012,36(2):257-265
[8] Welz PS,Wullaert A,Vlantis K,et al.FADD prevents RIP3-mediated epithelial cell necrosis and chronic intestinal inflammation[J].Nature,2011,477(7364):330-334
[9] Wang JJ,Sun BC.Expression of caspase-3 and caspase-9 and their significance in breast cancer[J].Chinese Journal of Clinical and Experimental Pathology,2012,28(4):378-381
[10] Bratton SB,Salyesen GS.Regulation of the Apaf-1-caspase-9 apoptosome[J].J Cell Sci,2010,123(Pt19):3209-3214
[11] Ohgidani M,Komizu Y,Goto K,et al.Residual powders from Shochu distillation remnants induce apoptosis in human hepatoma cells via the caspase-independent pathway[J].J Biosce Bioeng,2012,114(1):104-109
[12] Guerrero AD,Schmitz I,Chen M,et al.Promotion of Caspase Activation by Caspase-9-mediated Feedback Amplification of Mitochondrial Damage[J].J Clin Cell Immunol,2012,3(3):100-126
[13] Ekonomopoulou MT,Babas E,Mioglou-Kalouptsi E.Changes in activities of caspase-8 and caspase-9 in human cervical malignancy[J].Int J Gynecol Cancer,2011,21(3):435-438
Expressions of Caspase-8,Caspase-9 in the renal tissue of rats with acute paraquat poisoning and the research of cell apoptosis
WANG Xin,ZHAO Yanxia,LI Haixia,LI Aijun
(Handan Central Hospital,Handan 056002,Hebei,China)
Objective It is to investigate the expressions of Caspase-8,Caspase-9 in the renal tissue of acute paraquat-induced poisoning rats,and to explore their function in renal injury induced by paraquat poison.Methods One hundred and forty healthy adult Sprague-Dawley (SD) rats with half males and half females were randomly divided into tow groups: control group with 70 rats which were given normal saline by gavage and poisoned group with 70 rats which were given 50 mg/kg paraquat by gavage.At 1,3,7,14,21,28 and 35 days after poisoning,examples of renal tissue of the rats in both groups were gotten to observe the pathological changes of renal tissue under light microscope,and the expression of Caspase-8,Caspase-9 in kidney were evaluated by immunohistochemistry.TUNEL was used to label apoptotic cells.Results Compared with control group,the expression of Caspase-8 in renal tissue of poisoned group significantly rose at the first day,reached the peak at the 3th day and afterwards decreased slowly,at 35th day,the expression was still higher than that in the control group.The expression of Caspase-9 reached the peak at the 14th day,and kept at relatively high levels up to the 35th day.Apoptosis index of poisoned group significantly rose at the thrid day,reached the peak at the 21th day and at 35th day,the index was still higher than that in the control group.than those in group A.Conclusion The expressions of Caspase-8,Caspase-9 were changed in renal injury of acute paraquat-poisoning rats.The cell apoptosis is one of the mechanism leading to kidney damage.
paraquat; poisoning; Caspase-8; Caspase-9; renal injury; cell apoptosis
王鑫,男,硕士,主治医师,研究方向为中毒及危重症救治。
10.3969/j.issn.1008-8849.2015.16.008
R-332
A
1008-8849(2015)16-1734-04
2015-01-11

