自发性高血压大鼠血液中SOD、MDA、NO、ET的变化及瑞舒伐他汀干预的影响
闫洪娟,谢悦陶,刘 光,于明月,边树怀,罗秋华
(1.河北省邯郸市第一医院,河北 邯郸 056000;2.河北省人民医院,河北 石家庄 050000;3.河北医科大学第四医院,河北 石家庄 050000)
自发性高血压大鼠血液中SOD、MDA、NO、ET的变化及瑞舒伐他汀干预的影响
闫洪娟1,谢悦陶2,刘 光3,于明月2,边树怀2,罗秋华1
(1.河北省邯郸市第一医院,河北 邯郸 056000;2.河北省人民医院,河北 石家庄 050000;3.河北医科大学第四医院,河北 石家庄 050000)

目的 探讨氧自由基损害和血管内皮功能失调与高血压发生的关系及不同剂量的瑞舒伐他汀对氧化应激及内皮功能的影响。方法 将8只Wistar-Kyoto大鼠(WKY)作为正常对照组;32只自发性高血压大鼠(SHR)随机分为瑞舒伐他汀3.125 mg/(kg·d)组(T1组)、瑞舒伐他汀6.25 mg/(kg·d)组(T2组)、瑞舒伐他汀12.5 mg/(kg·d)组(T3组)和SHR组,每组8只。各给药组分别给予相应剂量瑞舒伐他汀加蒸馏水1 mL灌胃,SHR组及WKY组给予相同容积的蒸馏水,共喂药4周。喂药前后测量各组大鼠血压。4周后,麻醉后抽取血液,检测血液中超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)、内皮素(ET)水平。结果 SHR组血液SOD活力、NO含量明显低于正常对照组,T1组、T2组、T3组明显高于SHR组。SHR组血液MDA含量、ET-1的表达明显高于正常对照组,T1组、T2组、T3组明显低于SHR组。结论SHR大鼠存在着氧化应激反应的增强和血管内皮功能损害,瑞舒伐他汀可以改善内皮功能。
自发性高血压大鼠;内皮功能;氧化应激反应;一氧化氮;内皮素;瑞舒伐他汀
高血压是常见的心血管疾病,严重危害人类健康,常引起严重的心、脑、肾等并发症。其病因复杂,病程长,发病机制涉及体内多个系统,其主要危害在于通过增加动脉粥样硬化病变的发病风险,进而导致心脑肾等重要器官发生缺血性功能与结构损害。氧化应激和内皮功能失调与高血压的发生、发展、转归有密切关系,高血压时,体内氧自由基增多,而超氧化物歧化酶(SOD)活性下降,体内脂质过氧化作用增强,进而损伤组织和细胞,造成血管内皮功能障碍,使一氧化氮(NO)合成释放不足,内皮素(ET)合成释放增加,使血管收缩,血压增高[1]。而血压增高可进一步加重内皮损伤,加剧内皮功能障碍,由此形成恶性循环。因此,高血压患者除应积极控制血压外,还应重视氧自由基的清除,减少脂质过氧化作用,改善内皮功能,以减少高血压患者临床终点事件[2]。本实验通过检测自发性高血压大鼠(SHR)血液中SOD、丙二醛(MDA)、NO、ET的变化,以探讨氧自由基损害和血管内皮功能失调与高血压发生的关系;通过应用不同剂量的瑞舒伐他汀干预后了解上述指标的变化,探讨其对氧化应激及内皮功能的影响及可能的机制,进而为临床治疗提供实验依据。
1 实验资料
1.1实验动物 雄性清洁级Wistar-Kyoto(WKY)大鼠8只,购自河北医科大学实验动物中心,动物合格证号:DK1009-0005;雄性清洁级SHR大鼠32只,购自北京维通利华动物中心,动物合格证号:SCXK(京)2010-0005,常规饲养于河北省人民医院动物中心,自由进食,室温维持在(22±2)℃。本试验的环境条件符合中国国家标准《实验动物环境及设施》(GB14925-2001)对动物实验设施的有关标准,动物饲养管理和动物实验操作符合《北京市实验动物管理条例》等法规的要求,并经医院动物实验伦理委员会批准。
1.2 试剂 SOD试剂盒购自南京建成生物工程研究所,变异系数CV=1.7%。MDA试剂盒购自南京建成生物工程研究所,变异系数CV=1.5%。NO试剂盒购自南京建成生物工程研究所,批内变异系数<3.8%,批间变异系数<6.8%。ET水平测定所需试剂多聚赖氨酸、一抗(ET-1河北博海生物工程开发有限公司分装美国SANTA CRUZ公司产品),SP、Dab(购自河北博海生物工程开发有限公司)。变异系数CV=1.5%。
1.3 分组 将8只WKY大鼠作为正常对照组,体质量250~280 g,血压(108.07±2.11)mmHg(1 mmHg=0.133 kPa)。将SHR大鼠随机分为瑞舒伐他汀3.125 mg/(kg·d)组(T1组)、瑞舒伐他汀6.25 mg/(kg·d)组(T2组)、瑞舒伐他汀12.5mg/(kg·d)组(T3组)及SHR组,每组8只,体质量240~270 g,各组间体质量比较差异均无统计学意义(P均>0.05)。
1.4 给药方法 各组大鼠适应性饲养2周后,T1、T2、T3组于16:00分别给予瑞舒伐他汀3.125 mg/(kg·d)、6.25 mg/(kg·d)、12.5 mg/(kg·d)加蒸馏水1 mL灌胃,SHR组及正常对照组给予相同容积的蒸馏水,共喂药4周。
1.5 大鼠血压的测定 实验前及喂药结束3 d后采用中日友好医院生产的RBP-1B型光电法鼠尾血压测定仪测定大鼠的尾动脉血压。测量血压前将大鼠置于38~40 ℃温箱内预热10~20 min,使鼠尾部动脉充分扩张,用尾箍代替袖带,后接一换能器,连接脉冲感受器,待大鼠适应环境、行为稳定后,打开主机电源。调整脉冲感受器的高度及位置,当听到规律声音时,反复挤捏气球,向尾套内充气,直至容积脉搏波动消失,再缓慢放气,当再次听到规律声音时,此时血压表指针所指的刻度为鼠尾动脉收缩压,连续测3次,每次间隔1 min,以均值作为收缩压值。
1.6 标本的收集及检测 喂药结束3d后,10%水合氯醛(0.5 mL/100 g)腹腔注射,待动物麻醉后迅速开胸,暴露心脏,10 mL注射器抽取心室内血液。取血2 mL迅速注入放在冷水浴冷却盛有10%依地酸二钠30 μL、抑肽酶40 μL的Eppendorf管中,轻轻颠倒混匀,低温离心,3 000 r/min 10 min,留取血浆,-20 ℃保存用于检测血ET(放免法)。另取血6 mL缓慢置入试管中,室温下静置15 min后低温离心,3 000 r/min 10 min,留取血清,-20 ℃保存用于检测SOD、MDA、NO(比色法)。所有标本同批检测,严格按说明书操作。
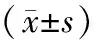
2 结 果
2.1各组大鼠收缩压水平比较 给药前,SHR组、T1组、T2组、T3组收缩压均高于正常对照组(P均<0.05),SHR组、T1组、T2组、T3组间比较差异无统计学意义(P均>0.05)。药物干预4周后,正常对照组、SHR组大鼠收缩压略有升高,但差异无统计学意义(P>0.05);T2组、T3组均较干预前明显下降(P均<0.05)。给药后T1组、T2组、T3组收缩压均低于SHR组(P均<0.05)。T1组、T2组、T3组组间比较差异无统计学意义(P均>0.05)。见表1。
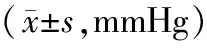
表1 各组大鼠血压比较
注:①与正常对照组比较,P<0.05;②与基础血压比较,P<0.05;③与SHR组比较,P<0.05。
2.2 各组大鼠血液SOD、MDA、NO、ET-1水平比较 SHR组SOD活力和NO水平明显低于正常对照组(P均<0.05),MDA及ET-1水平明显高于正常对照组(P均<0.05)。T1组、T2组、T3组血SOD活力和NO水平明显高于SHR组(P均<0.05),MDA及ET-1水平明显低于SHR组(P均<0.05),且T1组、T2组、T3组逐渐增高或降低(P均<0.05)。见表2。
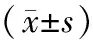
表2 各组大鼠血液中SOD、MDA、 NO、 ET-1水平比较
注:①与正常对照组比较,P<0.05;②与SHR组比较,P<0.05;③与T1组比较,P<0.05;④与T2组比较,P<0.05。
3 讨 论
近年研究证实,氧化应激反应广泛存在于高血压、动脉粥样硬化以及内皮功能障碍的患者中[3]。氧化应激是体内自由基及其相关物质过量聚集的一种状态。生物体内的自由基主要为氧自由基(OFR),包括超氧化物自由基(O2-)、羟自由基(OH·)、过氧化氢(H2O2)、单线氧(1O2)、脂质过氧自由基(RO2-)、脂质过氧化物(ROOH)等,统称为活性氧(ROS)。体内抗氧化系统包括SOD、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)及抗氧化剂维生素A、维生素C、维生素E、谷胱甘肽。ROS生成过多或抗氧化机制减弱都将导致氧化应激状态[2]。
目前研究认为,氧化应激可能通过以下途径参与高血压病的发生、发展:①ROS增多使血管内皮NO合成减少或降解增加,导致血管舒张功能下降,破坏血管自身血压稳定机制,血压升高[2,4-5]。②刺激血管内皮缩血管物质释放。超氧阴离子可激活前列腺素H2/血栓素A2受体,使前列腺素H2和血栓素A2增加,它们属于环氧化酶源性内皮依赖性收缩因子。超氧阴离子也可通过氧化低密度脂蛋白刺激血管ET释放[2,4-6]。ET是强烈的缩血管因子,并能促进血管紧张素Ⅱ、醛固酮分泌。③参与血管平滑肌细胞增殖。由还原型辅酶Ⅱ(NADPH)氧化酶诱发的超氧阴离子和过氧化氢促进血管紧张素Ⅱ介导的血管平滑肌细胞增殖,参与高血压发病环节。ROS可通过氧化低密度脂蛋白刺激血管紧张素Ⅱ Ⅰ型受体表达,也可通过刺激ET释放,使血管紧张素Ⅱ合成增加,从而促进血管平滑肌细胞增殖[4,6]。④ROS增加细胞内钙离子内流。ROS造成血管内皮细胞钙离子内流增加和钙超载,使内皮细胞损伤。ROS可直接作用于钠离子/钙离子交换蛋白,使之失去胞内钙离子依赖的调节,进而使胞内钙离子内流增加。ROS还可通过刺激ET、前列腺素H2、血栓素A2生成,激活磷脂酶C-酰基甘油-蛋白激酶C途径,促进血管平滑肌钙离子内流,引起血管平滑肌张力增加[7]。⑤促进黏附分子表达。ROS通过激活核转录因子诱使内皮细胞表达细胞间黏附分子-1(ICAM-1),ICAM-1介导中性粒细胞与内皮细胞黏附及穿出血管壁。ICAM-1表达增加,使中性粒细胞黏附功能加强,黏附于内皮细胞的中性粒细胞激活产生ROS及血管活性物质白三烯、血小板激活因子等,加重内皮细胞损伤,促进高血压的发生、发展[2,5]。本研究结果显示,SHR组心肌组织SOD活力下降,MDA含量增高,提示高血压状态时体内ROS增多,氧化应激增强;血液中ET含量增高,NO浓度降低,提示高血压状态时血管内皮舒张功能减退,内皮功能障碍可能参与高血压的发生、发展过程,进一步论证了上述观点。
研究表明,各种血管细胞都可产生ROS,ROS过多造成细胞和组织过氧化损伤[6-7]。许多基础和临床实验发现:在原发性高血压,血管中ROS水平升高,血管内皮NO生成减少或降解增加,或生物利用度降低[8-11],均可促使ET[12]、血管紧张素Ⅱ进一步升高[13],使血管内皮依赖性舒张功能减退,而内皮依赖性收缩功能增强,促进血管平滑肌细胞增殖、肥大,导致血管结构和功能改变。因而在非血流动力学调节障碍的高血压机制中,内皮-NO-一氧化应激链成为讨论的焦点之一[1]。此外,在一些动物和临床实验中,人们用钙拮抗剂[14]、第三代β受体阻断剂[15]、血管紧张素Ⅱ Ⅰ型受体拮抗剂[16]、SOD模拟物[17]、维生素C[18]、维生素E[19]治疗原发性高血压,它们发现通过清除ROS,减少过氧化损伤,增加NO生成,减少ET,可逆转和改善血管内皮功能障碍,从而提出了高血压治疗中的抗氧化问题。本研究发现,瑞舒伐他汀能显著降低SHR大鼠心肌组织ET、MDA水平,增加心肌组织NO、SOD水平,提示瑞舒伐他汀可以改善血管内皮功能,可以减少体内氧化应激反应,此结果与上述研究发现相一致。
他汀类药物是近年研究热点。他汀类药物即3-羟基3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是一类可有效降低总胆固醇与低密度脂蛋白胆固醇的药物。然而他汀类药物还具有不依赖于调脂作用的有益功效,如改善内皮功能,抑制炎症反应,抗氧化应激,抑制平滑肌细胞的增殖与促进平滑肌细胞的凋亡,稳定动脉粥样斑块,抑制血小板聚集等。大量基础与临床研究表明,他汀类药物可以通过其调脂作用以及多种调脂以外途径对心血管系统发挥有益影响,其中抑制氧化应激反应是近年来最受关注的他汀类药物的非调脂作用。ALLHAT-LIT与ASCOT等大规模临床试验证实,高血压患者联合应用降压药物与他汀类药物,可以更为显著地降低心血管事件的发生率和病死率[20]。由于他汀类药物可以通过减少NO降解、增加NO合成、抑制氧化应激反应等机制有效改善血管内皮功能,因此可能对血压水平具有一定影响。本研究发现,瑞舒伐他汀干预各组血压均显著降低,并且其降压作用呈剂量相关性。进一步证实了他汀类药物可能具有一定降压作用。虽然与常用降压药物相比他汀类药物降压幅度较小,但大量循证医学试验显示,即便轻微的血压下降就可以显著降低脑卒中及/或冠心病事件的危险性。
本研究是一小样本量的观察,对于他汀类药物对人的血压的影响及机制还需进一步观察和研究,相信随着相关研究的逐渐深入,对于他汀类药物的作用会有进一步的认识。
[1] 赵光胜.抗高血压治疗的新观念:内皮-一氧化氮-氧化应激链[J].中华医学杂志,2003,83(7):532-533
[2] 隋辉,王文.氧自由基与高血压关系研究进展[J].高血压杂志,2002,10(5):414-416
[3] Touyz RM.Reactive oxygen species in vascular biology:role in arterial hypertension[J].Expert Rev Cardiovasc Ther,2003(1):91-106
[4] Berry C,Brosnan MJ,Fennell J,et al.Oxidative stress and vascular damage in hypertension[J].Curr Opin Nephrol Hypertens,2001,10(2):247-255
[5] 任德成,杜冠华.血管内皮细胞的氧化性损失机理[J].心血管病学进展,2002,23(4):235-238
[6] Channon KM,Guzik TJ.Mechanisms of superoxide production in human blood vessels:relationship to endothelial dysfunction,clinical and genetic riscfactors[J].J Physiol Pharmacol,2002,53(4 pt 1):515-524
[7] Majid DS,Nishyama A.Nitric oxide blockade enhances renal responses to superoxide dismutase inhibition in dogs[J].Hypertension,2002,39(2):293-297
[8] Zalba G,San Jose G,Moreno MU,et al.Oxidative stress in arterrial hypertension role of NADPH oxidase[J].Hypertension,2001,38(6):1395-1399
[9] Yan HM,Zhao J,Ma DZ,et al.The effect of pitavastatin calcium on endothelial dysfunction induced by hypercholesterolemia[J].Expert Opin Pharmacother,2011,12(10):1463-1471
[10] Wu R,Lamontagne D,de Champlain J.Antioxidative properties of acetylsalicylic Acid on vascular tissues from normotensive and spontaneousely hypertension rats[J].Circulation,2002,105(3):387-392
[11] Rey FE,Li XC,Carreteto OA,et al.Perivascular supperoxide anion contributes to impairment of endothelium-dependent relaxation:role of gp91(phox)[J].Circulation,2002,106(19):2497-2502
[12] Harrison DG,Gongora MC. Oxidative stress and hypertension[J]. Med Clin North Am,2009,93(3):621-635
[13] Ogura S,Shimosawa T.Oxidative stress and organ damages[J].Curr Hypertens Rep,2014,16(8):452
[14] Taddei S,Virdis A,Ghiadoni L,et al.Restoration of nitric oxide availability after calcium antagonist treatment in essential hypertension[J].Hypertension,2001,37(3):943-948
[15] Dandona P,Karne R,Ghanim H,et al.Carvedilol inhibites reactive oxygen species generation by leukocytes and oxidative damage to aminacids[J].Circulation,2000,101(2):122-124
[16] Bayorh MA,Ganafa AA,Socci RR,et al.Effect of losartan on oxidative stress induced hypertension in sprague dawley rats[J].Am J Hypertension,2003,16(5):387-392
[17] Deiterich S,Bieaumont FJ,Jones GS,et al.Gene expression of antioxidative enzymes in the human heart.Increased expression of catalase in the end stage failing heart[J].Circulation,2000,101(1):33-39
[18] Pechanova O,Simko F. Chronic antioxidant therapy fails to ame·lioratc hypertension:potential mechanisms behind[J]. J Hypertens,2009,27(Suppl 6):S32-36
[19] Han X,Shen Y H,Li C,et al. PPARalpha agonist enoilbrate protects the kidney from hypertensive injury in spontaneously hypertensive rats via inhibition of oxidative stress and MAPK activity[J]. Biochem Biophys Res Commun,2010,394(3):653-659
[20] Pitocco D,Tesauro M,Alessandro R,et al.Oxidative stress in diabetes: implications for vascular and other complications[J].Int J Mol Sci,2013,14(11):21525-21550
[21] Zheng F,Lu W,Jia C,et al.Relationships between glucose excursion and the activation of oxidative stress in patients with newly diagnosed type 2 diabetes or impaired glucose regulation[J].Endocrine,2010,37(1):201-208
Changes of SOD,MDA,NO,ET from blood of spontaneously hypertensive rats,and the influence after rosuvastatin intervention
YAN Hongjuan1,XIE Yuetao2,LIU Guang3,YU Mingyue2,BIAN Shuhuai2,LUO Qiuhua1
(1.The First Hospital of Handan,Handan 056000,Hebei,China;2.HeBei General Hospital,Shijiazhuang 050000,Hebei,China;3.The Fourth Hospital of Hebei Medical University,Shijiazhuang 050000,Hebei,China)
Objective It is to explore the relationship of oxygen free radical damage and endothelial dysfunction occurs with hypertension,and to explore the effect of different doses of rosuvastatin on hypertension oxidatie stress and endothelial function.Methods Eight Wistar-Kyoto rats (WKY) were designated as normal control group(group N),and thirty-two spontaneously hypertensive rats (SHR) were randomly divided into four groups,which were designated as rosuvastatin 3.125 mg/(kg·d) group (group T1),rosuvastatin 6.25 mg/(kg·d) group (group T2),rosuvastatin 12.5 mg/(kg·d) group (group T3) and SHR control group (group H).Each group had 8 rats.Every medication group was given the respective dose of rosuvastatin+1 mL normal saline by gavage,and the control groups were given the same volume of tap water.All the rats were treated for 4 weeks.The blood pressure was measured by means of a noninvasive tail-cuff method before and after the 4-week treatment.In 4 weeks,blood of the rats was drew after anesthesia to determined the levels of superoxide dismutase (SOD),malonaldehyde (MDA),nitric oxide (NO) and endothelin (ET).Results Compared with group N,the activity of SOD,the level of NO from blood were significantly lower in group H,the indexes were higher in group T1,group T2,group T3 compared with group H.Compared with group N,the level of MDA,ET-1 were significantly higher in group H,the indexes were lower in group T1,group T2,group T3 compared with group H.Conclusion SHR rats have enhanced oxidative stress and damaged vascular endothelialfunction,rosuvastatin can improve their endothelial function.
spontaneously hypertensive rat; endothelial function; oxidative stress; nitric oxide; endothelin; rosuvastatin
闫洪娟,女,硕士研究生,主治医师,研究方向为高血压的诊治。
边树怀,E-mail:yy021223@163.com
10.3969/j.issn.1008-8849.2015.16.006
R-332
A
1008-8849(2015)16-1727-04
2015-01-10

