髓样分化因子88抑制剂ST2825对重组耻垢分枝杆菌感染THP-1细胞自噬的影响
胡少婷,李升锦,黄秦
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
·论著·
髓样分化因子88抑制剂ST2825对重组耻垢分枝杆菌感染THP-1细胞自噬的影响
胡少婷,李升锦,黄秦
(重庆医科大学附属第二医院呼吸内科,重庆 400010)
目的探讨髓样分化因子88抑制剂ST2825对重组耻垢分枝杆菌感染THP-1细胞自噬的影响。方法使用髓样分化因子88抑制剂ST2825作用于重组耻垢分枝杆菌感染的THP-1细胞,确定ST2825干预的实验组、无ST2825作用的对照组以及空白组。运用荧光显微镜观察自噬小体,RT-PCR检测Beclin-1基因和Bcl-2基因的mRNA的表达。结果与对照组比较,实验组的自噬荧光小点数目明显减少,差异具有统计学意义(P<0.05);RT-PCR检测结果显示Beclin-1和Bcl-2mRNA表达较对照组下调。结论髓样分化因子88抑制剂ST2858可能通过干扰Beclin-1和Bcl-2的分离,抑制THP-1细胞自噬。
髓样分化因子88;ST2825;重组耻垢分枝杆菌
自噬是巨噬细胞执行免疫防御的重要手段,巨噬细胞通过自噬可杀灭入侵的病原微生物,其中包括结核分枝杆菌(mycobacterium tuberculosis,MTB)。在结核分枝杆菌感染的巨噬细胞内,在自噬相关基因的调控下,形成自噬体结构。自噬体形成后可与溶酶体融合,并借助于溶酶体酸性环境降解入侵的MTB,达到免疫防御的目的。MTB以及其组成成分,可通过Toll样受体(Toll-like receptors,TLRs)识别后激活机体免疫反应。髓样分化分子88(myeloid differentiation factor 88,Myd88)是TLRs信号途径的重要转载分子,ST2825是Myd88特异性免疫抑制剂,可阻断TLRs信号转导[1]。本研究通过观察Myd88抑制剂ST2825对重组耻垢杆菌感染THP-1细胞形成自噬小体、自噬相关基因表达的影响,探讨Myd88在调节细胞自噬中的作用,为寻求以Myd88为作用点研究新的抗结核药物加强宿主巨噬细胞自噬作用,更有力清除机体内MTB提供思路。
1 材料与方法
1.1 材料
重组耻垢杆菌MS-pMV-eis(重庆医科大学附属第二临床学院检验科保存)、LB培养基(重庆医科大学附属第二临床学院中心实验室)、人单核巨噬细胞THP-1细胞(重庆医科大学附属第二临床学院中心实验室)、自噬体荧光表达质粒GFP-LC3质粒(重庆医科大学附属第二临床学院检验科保存)、pCDNA3.1-3flag质粒(重庆医科大学附属第二临床学院检验科保存),Beclin-1引物和Bcl-2引物(大连宝生物公司)、RNA提取剂(大连宝生物公司)、细胞培养用1640培养基+胎牛血清(Hyclone)、雷帕霉素(上海生物工程有限公司)、PMA(Sigma公司)、ST2825(美国MCE公司)。
1.2 方法
1.2.1 菌株的培养:从平板上挑取MS-pMV-eis,接种于卡那霉素抗性的LB培养基(烧瓶),在37℃下震荡培养下培养7 d,取对数生长期细菌用RMPI1640培养液重悬浮,调整浓度为1×105/mL。
1.2.2 THP-1细胞的制备及培养:采用含有10%胎牛血清的RMPI1640培养液,于37℃、5%CO2培养箱中培养THP-1细胞,加入PMA培养24 h使细胞分化为贴壁的巨噬细胞,弃去培养液,调整为1×104/mL铺于6孔板。
1.2.3 重组耻垢分枝杆菌感染细胞模型的制备:THP-1细胞标本分为3组:实验组(THP-1细胞+MS-pMV-eis)、对照组(THP-1细胞+MS-pMV-eis)、空白组(THP-1细胞)。按感染复数(multiplicity of infection,MOI)10∶1的比例以MS-pMV-eis感染实验组及对照组的THP-1细胞,继续培养48 h。
1.2.4 药物干预:上述细胞和细菌共培养48 h后,将实验组细胞弃去培养液,加入浓度为20 μmol/L ST2825,继续培养24 h。
1.2.5 自噬体检测:上述各组细胞将空质粒pCDNA3.1-3flag质粒(0.4 μg)与GFP-LC3质粒(0.4 μg)共转染细胞,具体转染方法按试剂说明书进行。转染6 h后换液,荧光显微镜下观察各组细胞中自噬荧光小点的形成数目。
1.2.6 RT-PCR检测自噬基因Beclin-1和抑制自噬基因Bcl-2的表达水平:上述各组细胞收集后运用RNA提取试剂提取总RNA。GAPDH及Beclin-1、Bcl-2引物序列由大连宝生物合成,以GAPDH作内对照(表1)。PCR扩增条件:94℃5 min;94℃40 s,56℃30 s,72℃32 s,共35个循环;72℃10 min。反应结束后,取反应液1 μL进行琼脂糖胶电泳,确认RT-PCR产物。
1.3 统计学处理
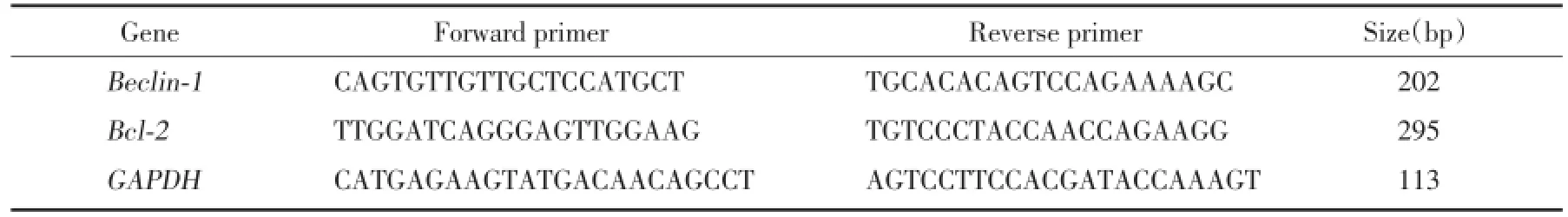
表1 各基因引物序列Tab.1 Gene primer sequences
2 结果
2.1 ST2825影响自噬小体表达情况
荧光显微镜下发现实验组和对照组细胞均可观察到自噬荧光小点,但在ST2825作用下,THP-1细胞中自噬荧光小点数目明显减少(7±2),而对照组细胞中自噬荧光小点数目较多(112±3),2组差异有统计学意义(P<0.05),表明Myd88在THP-1细胞的自噬形成过程中起着重要作用(图1)。
2.2 ST2825影响Beclin-1和Bcl-2mRNA表达情况
用RT-PCR在RNA水平上检测Beclin-1和Bcl-2 mRNA的表达,结果发现使用ST2825处理细胞后,实验组的Beclin-1和Bcl-2的条带较对照组变暗变窄,表示上述基因的表达较对照组明显下调,表示Myd88影响其表达,见图2。
3 讨论
自噬作为胞内物质降解的通路,在机体的抗感染免疫中发挥着重要作用,尤其在对抗MTB等胞内病原体感染过程中,宿主细胞可以通过自噬识别并靶向清除胞内菌。近期研究发现TLRs能够识别MTB及其组分,直接启动天然免疫,也可以同时上调抗原提呈细胞表面的主要组织性复合物Ⅱ分子和共刺激分子的表达,诱导抗原特异性免疫应答。现国外研究发现TLRs可介导自噬,并增强巨噬细胞的杀菌效应。Shin等[2]报导MTB的脂蛋白LpqH与巨噬细胞表面的TLR2/CD14结合,可启动AMPK和p38-MAPK信号途径,启动抗菌肽,抗菌肽表达后可诱导自噬相关基因及蛋白的表达,形成自噬小体。除TLR3外,其他TLR都完全或部分依赖于Myd88转到信号,因此Myd88是TLRs途径的关键分子点。阻断Myd88依赖性信号通路,增加宿主感染化脓性细菌、疱疹病毒的机会[3]。

图1 荧光显微镜下观察各组THP-1细胞的自噬小体的表达 ×40Fig.1 Counting of autophagosomes of THP-1 cells in different groups under fluorescence microscopy×40

图2 RT-PCR检测各组THP-1细胞的Beclin-1和Bcl-2基因的mRNA的表达变化Fig.2 Expression of Beclin-1mRNA and Bcl-2mRNA in THP-1 cells detected by RT-PCR
Myd88在1900年首次认为是髓样分化初级反应的基因,本质上是一种胞质可溶性蛋白,其结构上有3个功能区域:N端死亡区域(death domain,DD)、中间区域、C端区域。它的DD区类似于IL-1受体的胞质区,通过招募链接蛋白传递信号;中间区域与白细胞介素1受体相关激酶(interleukin-1 receptor associated kinase,IRAK)作用有关,在TLR信号通路中能诱导启动NF-κB、P38、JNK[4,5]。已有实验证明,myd88基因在抵御及清除卡介苗方面发挥重要作用。德国研究者敲除小鼠Myd88基因后,与正常组感染相同数量的卡介苗5 d后,CT检查发现基因敲除组小鼠的肺、肝脏、脾脏均可看到荧光素阳性区域,而正常组未发现[6]。有学者[1]发现敲除小鼠Myd88基因的外显子1和2部分,其鼠感染卡介苗后不能清除卡介苗,表示该小鼠清除卡介苗的能力被破坏[7]。
本实验以设计ST2825干预重组耻垢分枝杆菌感染THP-1细胞的模型,观察Myd88特异性抑制剂ST2825对THP-1细胞自噬的影响,试图为研究以Myd88为作用点的药物调节自噬,增强机体抗结核效应提供依据。既往Loiarro等[1]已经证明ST2825是以Myd88 TIR域BB环七肽为模板进行合成的,能特异性抑制Myd88的TIR区域的同源二聚化作用及下游信号分子IL-1受体相关激酶4(interleukin-1 receptor assiociated kinase4,IRAK4)、IRAK1活性,进而不能激活NF-κB、P38和JNK信号途径。我们的实验结果发现,重组耻垢杆菌感染的THP-1细胞在荧光显微镜下可观察到大量的自噬小体,而加入ST2825干预后,自噬小体数量明显减少。同时运用RT-PCR检测检测自噬相关基因Beclin-1和抑制自噬基因Bcl-2的mRNA表达水平,发现实验组两基因的mRNA表达较对照组下调明显。上述实验结果表示ST2825可抑制自噬的形成,并干预Beclin-1基因和Bcl-2基因的表达。本研究结果说明Myd88可调节THP-1细胞自噬形成及相关基因的表达。之前Shi等[8]将shRNAs沉默Myd88基因,用LPS刺激该基因沉默的RAW264.7细胞,在电子显微镜下观察到正常组的自噬小体数目明显高于基因沉默组,与本研究结论相一致。Bcl-2作为抗凋亡蛋白,在正常情况下与Beclin-1持续结合,抑制自噬,而进一步运用免疫共沉淀方法发现Myd88可干预Beclin-1和Bcl-2的分离,诱导自噬的发生[8]。在本实验中发现Myd88抑制剂ST2825可导致THP-1细胞的Beclin-1基因和Bcl-2基因的表达下调,证实了Shi等[8]的研究观点。故我们推测ST2825通过干扰Beclin-1和Bcl-2的分离抑制自噬。
[1]Loiarro M,Capolunghi F,Fantò N,et al.Pivotal advance:Inhibition of MyD88 dimerization and recruitment of IRAK1 and IRAK4 by a novel peptidomimetic compound[J].Leuko Biol,2007,82(4):801-810.
[2]Shin DM,Yuk JM,Lee HM,et al.Mycobacterial lipoprotein activates autophagy via TLR2/1/CD14 and a functional vitamin D receptor signaling[J].Cell Microbiol,2010,12(11):1648-1665.
[3]Netea MG,Wijmenga C,O'Neill LA.Genetic variation in Toll-like receptors and disease susceptibility[J].Nat Immunol,2012,13(6):535-542.
[4]吴燕燕,王易.Toll样受体信号通路中MyD88的研究进展[J].免疫学,2012,28(3):262-265.
[5]Warner N,Núñez G.MyD88:A critical adaptor protein in innate immunity signal transduction[J].J Immunol,2013,190(1):3-4.
[6]Berod L,Stüve P,Swallow M,et al.MyD88 signalling inmyeloid cells is sufficient toprevent chronic mycobacterial infection[J].Eur J Immunol,2014,44(5):1399-1409.
[7]Gais P,Reim D,Jusek G,et al.Cutting edge:divergent cell-specific functions of MyD88 for inflammatory responses and organ injury in septic peritonitis[J].Immunology,2012,188(12):5833-5837.
[8]Shi CS,Kehrl JH.MyD88 and trif target Beclin 1 to trigge autophagy in macrophages[J].Biol Chem,2008,283(48):33175-33182.
(编辑武玉欣)
The Effect of Myeloid Differentiation Factor 88 Inhibitor ST2825 on the Autophagy of THP-1 Cells Infected with Recombinant Mycobacterium smegmatis
HU Shao-ting,LI Sheng-jin,HUANG Qin
(Department of Respiratory Medicine,The Second Affiliated Hospital of Chongqing Medical University,Chongqing 400010,China)
Objective To investigate the effect of myeloid differentiation factor88 inhibitor ST2825 on the autophagy of THP-1 cells infected by recombinant mycobacterium smegmatis.MethodsThe myeloid differentiation factor 88 inhibitor ST2825 was applied on the THP-1 cells infected by recombinant mycobacterium smegmatis,and three groups were defined:the test group with ST2825 treatment,the control group without ST2825 treatment,and the blank group.Autophagosomes were observed under the fluorescence microscope,and the mRNA expression of Beclin-1gene and Bcl-2gene was analyzed by RT-PCR.ResultsCompared with the control group,the number of autophagy fluorescent dots in the test group was obviously reduced(P<0.05),and the expression levels of Beclin 1 gene and Bcl-2 gene were declined as indicated by the RT-PCR detection.ConclusionThe myeloid differentiation factor 88 inhibitor ST2825 might inhibit the autophagy of THP-1 cells through interfering the separation of Beclin-1 and Bcl-2.
myeloid differentiation factor 88;ST2825;recombinant mycobacterium smegmatis
R372
A
0258-4646(2015)06-0562-04
胡少婷(1989-),女,硕士研究生.
李升锦,E-mail:lsj1025@163.com
2015-01-03
网络出版时间:

