Nrf2的失活对应力负荷下的骨形成的影响
杨杨,徐爱华,戴奇,张佳星,孙永新
(中国医科大学附属第一医院康复医学科,沈阳 110001)
·论著·
Nrf2的失活对应力负荷下的骨形成的影响
杨杨,徐爱华,戴奇,张佳星,孙永新
(中国医科大学附属第一医院康复医学科,沈阳 110001)
目的通过核转录因子2(Nrf2)基因敲除小鼠探索Nrf2在应力所致骨形成中的作用。方法通过PCR检测选取同窝杂交出生的小鼠Nrf2基因敲除(KO)组及野生(WT)组,按时给予尺骨2 Hz峰值4 000压力连续3 d(120转/d),测量2组尺骨相对矿化面积及相对骨形成率。结果负荷引起的骨形成在KO组小鼠中被抑制。与WT组相比,KO组小鼠的相对骨形成率降低约84%(P<0.01)。结论骨内Nrf2的失活将影响应力负荷所致的骨形成。
核转录因子2;应力负荷;骨形成
骨在生长过程中与成熟后,随着内、外环境因素的改变,在不断进行骨形成与破坏。活骨组织中存在一种反馈系统,能通过对外部条件变化的感受来重建骨形成。在重建过程中,应力负荷是一个重要因素[1]。骨对应力的改变及机械刺激高度敏感,应力的改变及机械刺激可促进骨形成[2]。然而,该反应的确切机制尚不完全清楚。研究表明,负荷可增加线粒体的活性,但骨细胞中活性氧水平的增高对机械诱导的骨形成有负面影响[3]。事实上,应力负荷(运动)可能会同时增加骨细胞的氧化应激和抗氧化作用[4]。然而,骨细胞受到机械刺激时,抗氧化及氧化应激作用的调节机制尚未明确。
核转录因子2(核因子E2相关转录因子2,nuclear factor-E2-related factor 2,Nrf2)是一种具有细胞抗氧化和化学刺激作用的主要调控因子,同时也是一个重要的转录因子,属于碱性亮氨酸拉链蛋白家族[5]。之前对Nfr2的研究主要集中在具有代谢和解毒功能的器官(如肝脏、肾脏)以及一些长期暴露于环境中的器官(如皮肤、肺及消化道)方面。正常静止条件下,细胞质中的Nrf2被其抑制蛋白Kelch样ECH相关蛋白1(Keap1)禁锢在细胞质中,该蛋白会导致Nrf2的蛋白酶体降解,抑制其转录激活活性[6]。受到氧化刺激时,Keap1被修饰,Nrf2从Keap-1释放,转移到细胞核中[7]。与抗氧化反应元件(antioxidant response element,ARE)结合。Nrf2-ARE通路是目前公认的抗氧化和外源性应力的一个重要的细胞防御机制。Nrf2基因敲除小鼠更容易受到氧化刺激,表明Nrf2在保护组织器官避免毒性刺激中起着关键的作用。本研究拟确定Nrf2基因敲除小鼠的骨骼基因表型,并进一步探讨Nrf2在应力所致骨形成中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:C57BL6/129SV混合的背景环境的雄性野生型和Nrf2基因敲除小鼠由LI Ji-liang教授(Indiana University-Purdue University Indianapolis,IUPUI,印第安纳波利斯)友情提供。本研究中的所有实验均按照中国医科大学附属第一医院实验动物要求基本条例执行。
1.1.2 试剂与器材:钙黄绿素、茜素、异氟醚(Sigma公司,美国),甲基丙烯酸甲酯(齐鲁石化开泰,中国),电磁制动器(Endura TEC公司,美国),组织锯(钻石锯)(米力光公司,中国),显微镜(尼康公司,日本)。
1.2 方法
通过PCR技术检测选取Nrf2-/-与Nrf2+/+雄性小鼠21只进行实验,其中,Nrf2-/-11只(KO组),Nrf2+/+10只(WT组)。对21只小鼠进行轴向尺骨的应力负荷实验和骨组织形态学检测。
应力负荷实验:采用16周龄雄性小鼠,3%异氟醚全麻下,连续3 d使用电磁制动器(Endura TEC,美国)对小鼠右前肢施加动态应力负荷(120次/d,2 Hz,KO组峰值为2.24 N,WT组峰值为2.8 N),左前肢作为无负荷对照组,不施加负荷。在负荷施加后的饲养期间,允许所有小鼠在笼中正常活动。在第1次施加应力负荷后的第5和第11天,分别给予小鼠腹腔注射钙黄绿素(30 mg/kg)和茜素(50 mg/kg)。所有动物在14 d后处死。对右前肢(负荷)和左前肢(无负荷)的尺骨进行组织形态学检测。
骨组织形态学检测:将尺骨标本浸入10%的中性甲醛缓冲液48 h后,分级乙醇脱水,二甲苯中洗涤,置入甲基丙烯酸甲酯。用钻石镶嵌的组织锯在尺骨干中段横向切断,约20 μm厚,置于载玻片上。采用尼康显微镜和数字化系统(R&M Biometrics)观察尺骨组织形态学。250倍镜下收集骨膜表面数据:总周长(total perimeter,B.Pm),单标记周长(single label perimeter,sL.Pm),双标记周长(double label perimeter,dL.Pm),和双标记区(double label area,dL.Ar)。并计算以下参数:矿化表面[MS/BS=(1/2 sL.Pm+dL.Pm)/B.Pm×100%],矿化沉积率(MAR= dL.Ar/dL.Pm/6 days;μm/day),和骨形成率[BFR/BS= MAR×MS/BS×3.65;μm3/(μm2·year)]。此外,通过计算[右尺骨值(负荷)-左尺骨值(无负荷)]获得一组相对值(r),如rMS/BS,rMAR和rBFR/BS。
1.3 统计学分析
采用SPSS 15.0统计学软件进行统计学分析。实验数据以表示。采用t检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
为了研究Nrf2在负荷诱导骨形成中的作用,KO组和WT组分别给予尺骨应力负荷,并对骨形成的反应进行了评估。结果显示,与对照组相比,KO组小鼠的相对骨形成率降低约84%(P<0.01),见图1。提示KO组小鼠负荷诱导的骨形成被抑制,表明Nrf2在负荷诱导的骨形成中起重要作用。
3 讨论
目前的研究表明,骨中Nrf2的失活会减少骨形成,从而可能导致低骨量。本研究结果显示,Nrf2基因敲除小鼠与野生型相比,负荷诱导的骨形成明显受到抑制,提示Nrf2在骨的信号转导中起关键的作用。然而,Park等[8]对8周龄的Nrf2基因敲除小鼠进行分析,结果发现Nrf2基因敲除组比对照组具有更高的骨密度。但这项研究未提及实验动物的性别,因此,不能确定性别和年龄是否会导致该研究结果与本研究之间的差异。Park等[8]的研究结果显示,Nrf2的过表达抑制了RUNX2的表达,从而可能对骨形成产生有害影响。例如,通过Keap基因失活导致Nrf2过表达的小鼠会由于食道和胃的角化性病变引起上消化道梗阻,导致小鼠在断奶前死亡。Nrf2的激活会导致小鼠肝损伤,延缓干细胞增殖,增加干细胞凋亡,从而阻碍肝再生[9]。在角质形成细胞中,Nrf2的激活能引起包括脱发在内的皮肤异常[10]。这些研究表明,细胞中Nrf2的表达激活对机体各系统均可有不同程度的影响。
本研究通过应力负荷实验进一步证明了Nrf2在小鼠骨形成中的关键作用。在本研究中,Nrf2基因的敲除抑制了机械诱导(负荷)的小鼠骨形成。矿化表面(MS/BS)和骨矿沉积率(MAR)的减少表明Nrf2的缺乏抑制了成骨细胞的增长和活性。既往的研究表明,机械负荷能增加成骨细胞内的氧化应激作用,而运动也可导致骨内抗氧化作用的增强[11]。为了对抗微环境中的各种损伤,细胞在进化过程中逐渐获得了对抗各种毒性作用损伤的防御机制,其中最重要的细胞防御机制就是通过转录因子Nrf2调节的[12]。而运动诱导的氧化应激和抗氧化作用是同时进行的,或者抗氧化作用是在运动过程中对氧化应激产生的反应,目前仍不清楚[13]。可以推测,如果抗氧化系统在机械负荷时受损,氧化应激作用就可能会过度增加,增加的氧化应激作用可能会通过拮抗Wnt信号分子,例如Wnt5,一个非经典的Wnt配体,而对骨形成的合成代谢产生影响,从而进一步破坏负荷诱导的骨形成。本研究结果表明,如果骨细胞内没有Nrf2表达,则负荷诱导的氧化应激作用不能缓解。因此,推测Nrf2对应力负荷后的骨形成的影响是通过抗氧化作用完成的。Nrf2基因敲除小鼠模型的建立有利于系统地研究Nrf2相关的遗传病。为了更好地研究Nrf2基因在破骨细胞、成骨细胞和骨细胞等不同细胞群中的特定作用,Nrf2特定基因缺失小鼠模型的建立十分必要。Nrf2特定基因缺失小鼠模型将更加有利于研究Nrf2在骨的稳态及负荷诱导的骨形成中的作用机制。
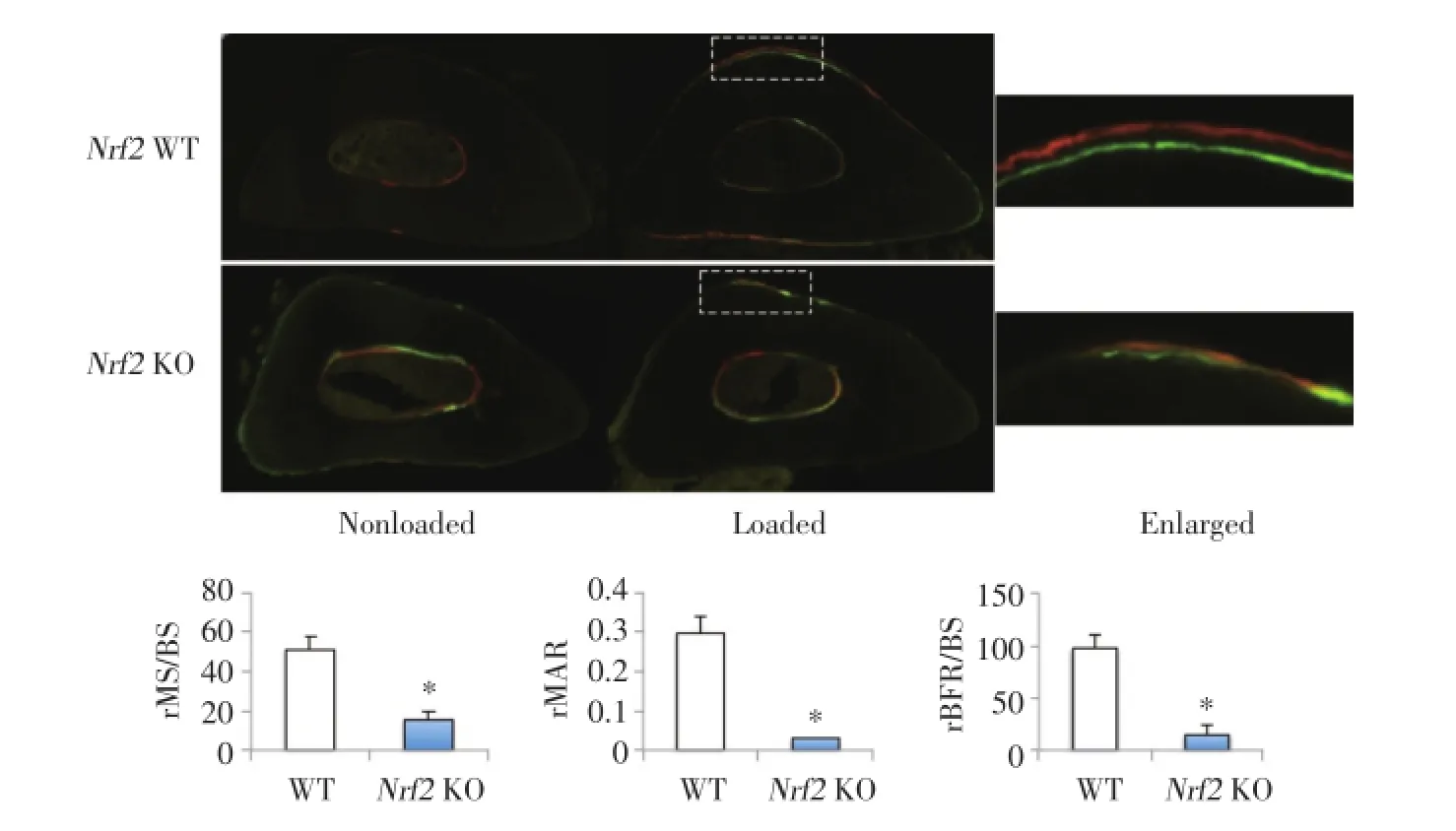
图1 WT组和KO组内负荷及非负荷小鼠尺骨中段形态学检测结果Fig.1 Results of morphologic detection of midshaft ulnar sections from the non-loaded and loaded forearms of the wild type control and the Nrf2KO mice
综上所述,本研究结果表明,Nrf2的功能缺失能够引起负荷诱导的骨形成代谢反应减少,其具体机制还有待于进一步研究。
[1]王力,赵文志,李斌.生长因子参与应力作用下骨重建[J].中国组织工程研究与临床康复,2010,14(33):6198-6201.
[2]Robling AG.The interaction of biological factors with mechanical signals in bone adaptation:recent developments[J].Curr Osteoporos Rep,2012,10(2):126-131.
[3]Zhou H,Newnum AB,Martin JR,et al.Osteoblast/osteocyte-specific inactivation of Stat3 decreases load-driven bone formation and accumulates reactive oxygen species[J].Bone,2011,49(3):404-411.
[4]Gomes EC,Silva AN,de Oliveira MR.Oxidants,antioxidants,and the beneficial roles of exercise-induced production of reactive species[J].Oxid Med Cell Longev,2012,2012:756132.
[5]李雪丽,唐云,许雪珠.核转录因子Nrf2最新研究进展[J].中国组织工程研究,2012,16(24):4530-4534.
[6]Motohashi H,O'Connor T,Katsuoka F,et al.Integration and diversity of the regulatory network composed of Maf and CNC families of transcription factors[J].Gene,2002,294(1-2):1-12.
[7]Chen C,and Kong AN.Dietary cancer-chemopreventive compounds:from signaling and gene expression to pharmacological effects[J]. Trends Pharmacol Sci,2005,26(6):318-326.
[8]Park CK,Lee Y,Kim KH,et al.Nrf2 is a novel regulator of bone acquisition[J].Bone,2014,63:36-46.
[9]Kohler UA,Kurinna S,Schwitter D,et al.Activated Nrf2 impairs liver regeneration in mice by activation of genes involved in cell cycle control and apoptosis[J].Hepatology,2014,60(2):670-678.
[10]Schafer M,Willrodt AH,Kurinna S,et al.Activation of Nrf2 in keratinocytes causes chloracne(MADISH)-like skin disease in mice[J].EMBO Mol Med,2014,6(4):442-457.
[11]Baur A,Henkel J,Bloch W,et al.Effect of exercise on bone and articular cartilage in heterozygous manganese superoxide dismutase(SOD2)deficient mice[J].Free Radic Res,2011,45(5):550-558.
[12]张灵敏,张明鑫,景桂霞.Nrf2在多器官保护中的作用研究进展[J].成都医学院学报,2010,5(1):75-78.
[13]Hyeon S,Lee H,Yang Y,et al.Nrf2 deficiency induces oxidative stress and promotes RANKL-induced osteoclast differentiation[J].Free Radic Biol Med,2013,65:789-799.
(编辑王又冬)
Inactivation of Nrf2 Decreases Load-driven Bone Formation
YANG Yang,XU Ai-hua,DAI Qi,ZHANG Jia-xing,SUN Yong-xin
(Department of Rehabilitation,The First Hospital,China Medical University,Shenyang 110001,China)
Objective To investigate the role of nuclear factor(erythroid-derived 2)-like 2(Nrf2)in load-driven bone metabolism in Nrf2knockout(KO)mice.MethodsThe hybridized mice in the same brood were selected through PCR detection and were divided into two groups,i.e.,the Nrf2 knockout(KO)group and the wild-type(WT)group.Ulna of mice was loaded with 4 000 peak microstrains at 2 Hz for 3 consecutive days(120 cycles/day)as scheduled,the relative mineralizing surface(rMS/BS)and the relative bone formation rate(rBFR/BS)of ulna were measured for the two groups.ResultsLoad-induced bone formation was suppressed in KO mice.Compared to the WT control,the relative bone formation rate was roughly 84% lower in KO mice(P<0.01).ConclusionThe loss-of-function mutation of Nrf2 in bone diminishes load-driven bone formation.
Nrf2;loading-driven;bone formation
R493
A
0258-4646(2015)06-0513-03
沈阳市科技技术计划项目(113882);辽宁省科学技术计划项目社会发展攻关计划项目(2010225034)
杨杨(1987-),女,医师,硕士.
孙永新,E-mail:sunyxjp@hotmail.com
2015-01-26
网络出版时间:

