冬季雪被对青藏高原东缘高海拔森林凋落叶P元素释放的影响
武启骞, 吴福忠, 杨万勤,*, 赵野逸, 何 伟, 何 敏, 朱剑霄,3
1 四川农业大学生态林业研究所, 林业生态工程四川省重点实验室, 成都 611130 2 东北林业大学生态研究中心, 哈尔滨 150040 3 北京大学地表过程分析与模拟教育部重点实验室, 北京 100871
冬季雪被对青藏高原东缘高海拔森林凋落叶P元素释放的影响
武启骞1,2, 吴福忠1, 杨万勤1,*, 赵野逸1, 何 伟1, 何 敏1, 朱剑霄1,3
1 四川农业大学生态林业研究所, 林业生态工程四川省重点实验室, 成都 611130 2 东北林业大学生态研究中心, 哈尔滨 150040 3 北京大学地表过程分析与模拟教育部重点实验室, 北京 100871
雪被是影响高海拔森林凋落物分解的重要生态因子,其是否影响到生长季节与非生长季节凋落物中的P元素释放,尚未量化。为了量化季节性雪被对高海拔森林凋落物分解过程中P元素释放的影响,于2010年10月至2012年10月间,在青藏高原东缘川西高海拔森林不同厚度冬季雪被斑块下,设置凋落物分解袋实验。检测该地区代表性树种岷江冷杉(Abiesfaxoniana)、红桦(Betulaalbo-sinensis)、四川红杉(Larixmastersiana)和方枝柏(Sabinasaltuaria)凋落叶在雪被覆盖不同关键时期(雪被形成前期、完全覆盖期和消融期)以及生长季节的P元素动态。结果表明,凋落物质量与雪被厚度均显著影响了P元素的释放过程。雪被覆盖时期凋落物P元素释放率表现为有雪被覆盖大于无雪被覆盖,而生长季节中除岷江冷杉外的其他3种凋落物P元素释放率均为无雪被覆盖下最大。相对于无雪被覆盖斑块,冬季雪被的存在提供了保护绝缘层,促进凋落物P元素释放,提高了各物种冬季P元素释放贡献率。这些结果表明,全球变化情景下的雪被减少可能减缓高海拔森林凋落物P元素的释放过程,改变森林土壤P元素水平。所以在研究高寒、高海拔地区全球气候变化下生态系统功能的工作中,应注重雪被这一异质性环境因子对生态系统功能的影响。
青藏高原东缘; 凋落叶; 高海拔森林; 磷释放; 雪被梯度
冬季雪被及其相关的过程是影响高纬度和高海拔地区生态系统过程的关键生态因子[1-2]。然而,以暖冬、极端气象事件等为主要特征的全球气候变化正在改变着冬季雪被格局[3]。冬季雪被厚度降低[4-5],促进了土壤表层冻融循环及干湿交替过程,可能作用于凋落物分解过程;同时雪被厚度降低,融雪期的淋溶作用势必减弱,也会减缓凋落物分解过程。总之,雪被厚度的这些变化必将影响高海拔森林凋落物的分解,进而影响森林生态系统整个碳循环过程[6- 8]。森林凋落物分解过程中P元素释放是生态系统P循环的关键过程,其循环过程也是生态系统生产力的直接限制因素[9- 11]。P是植物生长不可或缺的营养元素之一,在植物生理过程中,由P组成的高能磷酸键通过ATP(Adenosine Triphosphate)与ADP(Adenosine Diphosphate Glucose Pyrophospheralase)之间的转化作用进行能量储备和释放,提供给植物生长。并且光合作用的产物必须经过磷酸化过程,进行碳固定。所以,P元素是制约植物生长的重要因子之一。然而,由于P元素移动性强且不易被生物吸收利用,凋落物P元素释放过程主要受到淋溶等非生物因素以及土壤微生物活动等生物因素的深刻影响[12]。高海拔森林树冠的遮挡与集流以及风等作用常常导致冬季地表具有显著不同厚度的雪被斑块[13]。这些雪被斑块不仅在冬季通过不同的冻融格局和土壤生物特性作用于凋落物P释放过程,而且可以通过改变凋落物质量影响下一阶段凋落物的P释放。更为重要的是,当前以寒冷区域冬季温度升高为主要特征的气候变化正在改变高海拔森林冬季水热环境[14- 17],必然进一步改变凋落物P释放等关键生态系统过程,但在该方面的研究还相对较少。
不同厚度冬季雪被斑块在形成、覆盖和消融等不同关键时期往往具有不同的冻融特征[18],可以在以下几个方面影响凋落物P释放。首先,凋落物往往形成于秋末冬初雪被形成前,新鲜凋落物相对丰富的P含量极易受到降水淋溶损失和微生物等的固定利用。很多研究发现,相当部分凋落物失重和P等元素损失发生在秋末冬初[19- 20]。其次,由于一定厚度的雪被可以维持相对稳定的地表环境,雪被覆盖期厚型雪被下温度与外界环境不同,更适合生物生存具有相对活跃的生物活动[18],且在雪被消融期具有更为强烈的淋溶作用,进而贡献于凋落物P释放过程;但冬季薄型雪被甚至无雪被覆盖下可能具有更加强烈的冻结作用,冬春季节变化期间具有更为频繁的冻融循环,也必将作用于凋落物P释放过程[21- 22]。尽管已有的部分研究结果坚持认为冬季凋落物分解可以忽略[23- 24],但越来越多的结果表明冬季冻结-融化及其与微生物的综合作用对凋落物分解具有显著的影响[19- 20],对于易于淋溶流失和微生物固定利用的P等元素可能具有更加明显的作用[22]。此外,易流失的P经过一个冬季的大量损失以及冻融-淋溶等物理作用对凋落物质量的影响,不同厚度冬季雪被斑块下凋落物在生长季节的P释放等过程也可能存在明显的差异。可见,冬季不同厚度雪被斑块对凋落物P释放等分解特征的影响仍然还不清晰,亟待深入研究。
川西高海拔森林位于青藏高原东缘,是典型具有明显季节性雪被的高寒森林生态系统。该区域高海拔森林具有3个显著特点:(1) 土层浅薄,森林地表普遍具有较厚的土壤有机层[7],凋落物分解中N、P元素等养分的释放尤为重要;(2) 森林地表和土壤普遍具有长达5—6个月的季节性雪被和冻融循环期[25];(3) 林冠对冬季降雪和光照的分配使林隙内外形成了不同厚度的雪被[13]。这意味着,林隙内外形成的雪被可能对凋落物分解过程中P等元素释放产生不同程度的影响,但缺乏必要的数据证明。前期对亚高山森林凋落物分解的研究表明,该区季节性雪被覆盖期间P元素的释放主要集中在第一年的分解过程中[25,26],由于冻结-融化和生物活动的差异,P元素在冬季凋落物分解不同阶段具有不同的分解特征[7,8,26]。因此,我们假设“厚型雪被斑块下相对稳定的环境条件、活跃的生物活性和融化期强烈的淋溶作用将改变凋落物冬季P释放情况,使得冬季具有更高的凋落物P释放率,而薄型和无雪被斑块下冬季强烈的冻融循环、物理破碎,会贡献于生长季节时期凋落物P释放率”。
为验证这个假设,在前期研究成果的基础上,以该区4种优势树种岷江冷杉(Abiesfaxoniana)、红桦(Betulaalbo-sinensi)、四川红杉(Larixmastersiana)和方枝柏(Sabinasaltuaria)凋落物为研究对象,采用凋落物分解袋法,模拟凋落物自然分解过程,沿高海拔森林天然形成的不同厚度冬季雪被梯度,在凋落物分解的前2年雪被覆盖不同时期(雪被形成前期、雪被覆盖期和雪被消融期)和生长季节(气温持续升高的生长季节前期和气温持续下降的生长季节后期),研究凋落物P释放过程。研究目的为:(1)认识高海拔森林冬季雪被对凋落物P释放的影响过程;(2)了解高海拔森林凋落物不同分解阶段P释放的影响因素。研究结果还可为分析气候变化背景下高海拔森林雪被减少对森林生态系统P等元素循环过程的影响提供一定的理论依据。
1 研究方法
1.1 研究地区自然概况
四川省阿坝州理县毕棚沟自然保护区位于四川盆地与青藏高原的过渡地带,主要森林植被为岷江冷杉原始林。年平均温度2—4 ℃,年降雨量850 mm。雪被覆盖时期为每年11月至次年4月。基于前期的调查结果,于2010年10月26日,在人为干扰少的岷江冷杉原始林内设置3个标准样地(25 m×25 m)。样地位于大雪塘(E102°53′, N31°15′),海拔3582 m。年均降水量801 mm,年均气温2.9 ℃。乔木层主要有岷江冷杉、红桦、方枝柏和四川红杉,郁闭度约0.7,树龄约130a。样地内扩展林隙及林冠林隙分别占森林景观面积12.60%和23.05%,林隙周转率为260.30a,从林隙到林下具有明显不同厚度的冬季雪被斑块。林下植物主要为羊茅(Festucaovina)、高山杜鹃(Rhododendrondelavayi)、苔草(Carexspp.)、冷蕨(Cystopterismontan)、三颗针(Berberissargentiana)等。土壤为发育于坡积物上的雏形,土层浅薄,有机层厚度10—15 cm,pH值6.2[25]。
1.2 凋落物分解实验
于2010年9月在实验样地中采集岷江冷杉、红桦、四川红杉和方枝柏新鲜凋落物带回实验室,各种凋落物分解前基本特征见表1。将采集到的凋落物自然风干,每物种分别称取5份凋落物,每份10 g于65 ℃烘箱烘干至恒重,以确定凋落物样品的初始干重。称取相当于烘干重10 g的凋落物装入凋落物袋中,凋落物袋大小为20 cm×20 cm,孔径0.055 mm(贴地面层)和1 mm(表面层)[27-28],每物种750袋,共3000袋(3个样地×5个样方×4个物种×10次采样×5个重复)备用。在每块样地的林隙内,沿顺风方向从林隙中心至林下,分别设置5个4 m×4 m的样方,每个样方间距为3—4 m,以保证冬季形成不同厚度雪被梯度,分别记为G1(厚雪被)、G2(较厚雪被)、G3(中雪被)、G4(薄雪被)和G5(无雪被)。然后将备好的四种凋落物袋平铺于样方中(每个样方四种凋落物分解袋各30袋),每个凋落物分解袋间保持至少2 cm间距以免相互影响。

表1 凋落物分解前基本特征Table 1 The initial litter chemistry of each species expressed as potential litter quality variables (mean±SD, n=5)
为了解雪被形成、覆盖、融化以及生长季节凋落物P释放特征,在前期的观测基础上在2010年12月23日(第1年雪被形成前期,OF1)、2011年3月3日(第1年雪被覆盖期,DF1)、4月19日(第1年雪被消融期,TS1)、8月19日(第1年生长季节初期,EGS1)、11月8日(第1年生长季节末期,LGS1)、12月27日(OF2)、2012年3月7日(DF2)、4月28日(TS2)、8月25日(EGS2)和10月29日(LGS2),每次采样随机从每个样方内采集4种凋落物分解袋各5袋。
采样时测量林隙不同位置中雪被厚度,受实验条件及冬季观测的限制,雪被厚度用直尺直接多点测量取平均值。不同采样时间雪被覆盖厚度的变化情况如图1。同时,在不同雪被斑块下一个凋落物袋内放置一个纽扣式温度监测器(iButton DS1923-F5,Maxim Com. USA),每隔2 h记录实验样地中温度动态。在前期的实验中,发现白天和夜间温度存在较大的波动,且正积温和负积温的表相对于其它温度指标表现出对土壤生态过程具有更加显著的影响[29],表明正积温和负积温可能与融化和冻结程度相关。因此,根据日均温、白天均温和夜间均温计算了全天正积温和负积温以及日积温[30],并分析凋落物质量及这些温度指标与凋落物P元素释放的关系。实验期内不同雪被下土壤温度和大气温度的动态如图2。

图1 不同采样时间雪被覆盖厚度的变化(平均值±标准偏差, n = 5)
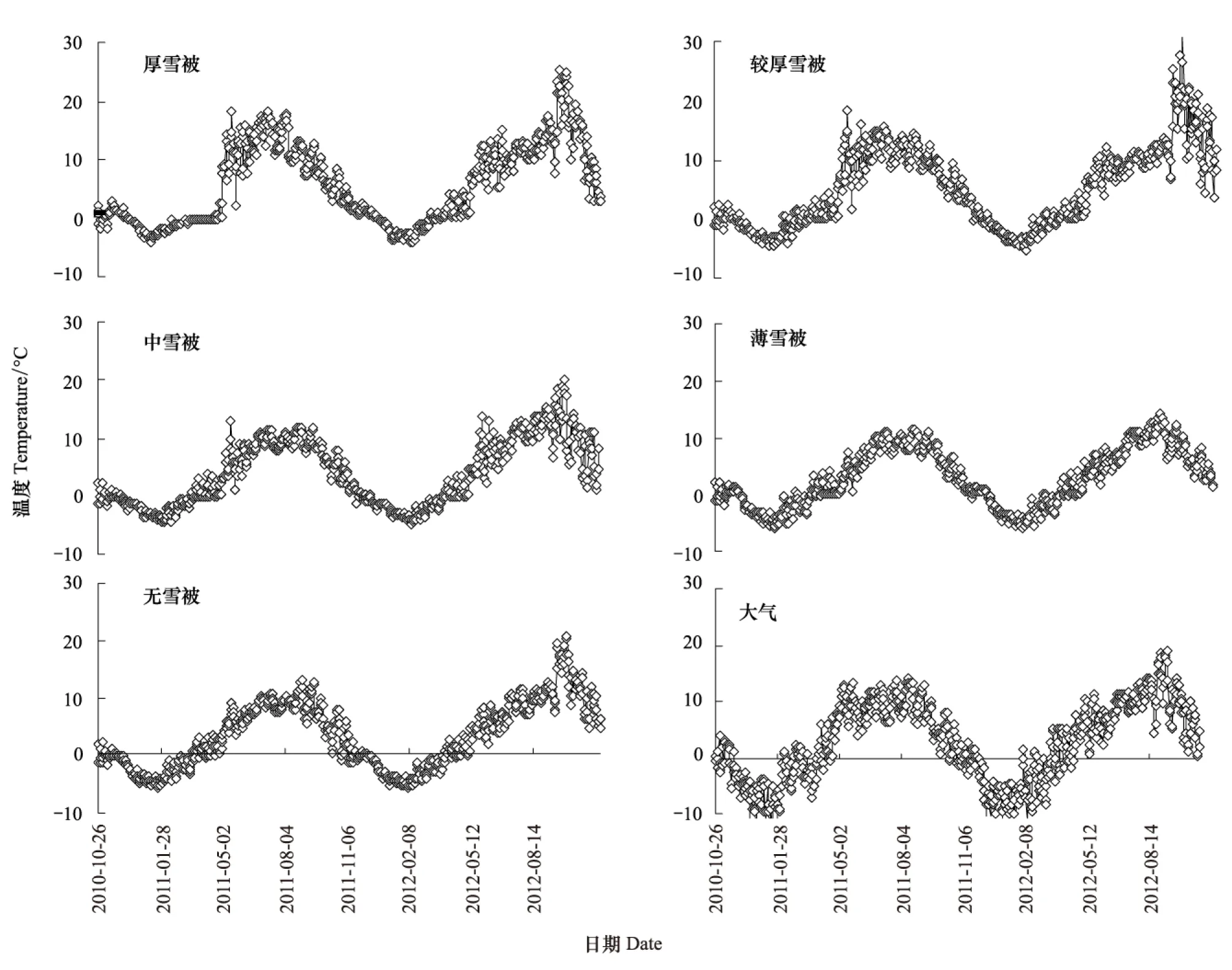
图2 川西高海拔森林不同雪被下土壤温度和大气温度的动态(2010年10月26日至2012年10月29日)
1.3 化学分析
将采集到的凋落物袋装入干净的聚乙烯袋中密封,放入4 ℃的冰盒中带至实验室。小心去除凋落物袋中泥土杂物及新生根系,于65 ℃烘干至恒重后,将凋落物粉碎过1 mm筛,采用钼锑抗比色法,每次采样的化学分析内容控制在两周时间内完成。
1.4 计算与统计分析
元素净释放率:
E=[(C0×M0-Ct×M) /C0×M0]×100%
式中,E为元素的净释放率(%),Ct为t时刻中元素含量(mg/g),Mt为t时刻中凋落物干重(g),C0为凋落物初始元素含量(mg/g),M0为埋设样品时凋落物分解袋内样品的初始干重(g)。元素表现为净释放时E为正值,元素为净富集E为负值。
凋落物P元素两年时间各时期释放所占比重(贡献率):
P(%)= (Mt-1-Mt) /(M0-MT)×100%
式中,M0凋落袋埋置前的烘干凋落物中所含元素质量(g);(Mt-1-Mt) 为相邻两时期凋落物分解袋中凋落物所含元素质量(g);MT为最后一次采样凋落物袋内凋落物所含元素质量(g)[7]。
采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较同时期4种凋落物不同雪被情况下的P元素释放率。双因素方差分析(Two-way ANOVA)和最小显著差异法(LSD)比较雪被与物种两因素对凋落物P元素释放率之间的交互影响。多因素方差分析(Multivariate ANOVA)和最小显著差异法(LSD)比较雪被、物种与时间三因素对凋落物P元素释放率之间的交互影响。P元素释放率与凋落物初始质量、环境温度的相关性采用Pearson相关系数检验法判定。
2 结果
2.1 凋落物分解过程中P元素含量动态
不同冬季雪被下4个物种凋落物P含量在凋落物分解各个关键时期均表现出一致的动态规律(图3)。均在OF1开始表现出短时间升高;进入DF1后,不同雪被斑块下4种凋落物P含量开始稳定下降;从EGS2开始,P含量又表现出小幅升高,升高趋势持续到实验结束。
同种凋落物分解过程中P含量在不同雪被斑块下并不表现出一致的规律。G1、G4和G5下岷江冷杉凋落物P含量在第1个冻结初期明显增加而后持续下降。G2下岷江冷杉凋落物P含量在第1个生长季节前期后持续下降。G3在第1个融化期后持续下降。除G5在第2年各个关键时期岷江冷杉凋落物P含量无明显差异外,其它4个雪被斑块下在第2个生长季节表现出略微上升的趋势。同时雪被覆盖显著影响了DF1、LGS1、OF2和EGS2的P含量;G1、G2和G3下四川红杉凋落物P含量在第1个冻结期下降,第1个融化期增加,然后下降;G4和G5下四川红杉凋落物P含量在第1个冻结期明显下降。雪被斑块显著影响了OF1、EGS1和EGS2的P含量;相对于其它冬季雪被斑块,G1和G3下方枝柏凋落物P含量在第1个冻结初期略微下降而后增加,5个斑块下方枝柏凋落物P含量均在第2个生长季节前期表现出增加的趋势,但G1、G2和G3下更为明显。雪被斑块显著影响了OF1、DF1、EGS1和OF2的P含量;5个雪被斑块下红桦凋落物P含量表现出一致的规律,均表现为在第1个冻结初期略微增加随后下降,此后各关键时期并无显著变化,直至第2个融化期略有增加的过程。不同雪被覆盖对红桦凋落物P含量的影响不显著。
不同时期内不同雪被情况下凋落物P含量,均在不同程度中表现出了“无雪被显著小于有雪被”的现象,但不同种类凋落物中这种显著差异持续时间不同(图3)。如岷江冷杉凋落物P含量在无雪被条件下显著小于有雪被的现象只在DF1和TS1中体现,持续时间较短;相反,四川红杉凋落物P含量在整个实验期中均表现出无雪被显著小于有雪被;方枝柏的这种差异自EGS1开始出现,一直持续到实验结束;而红桦凋落物仅在OF1至OF2的一整年时间内存在此种差异。
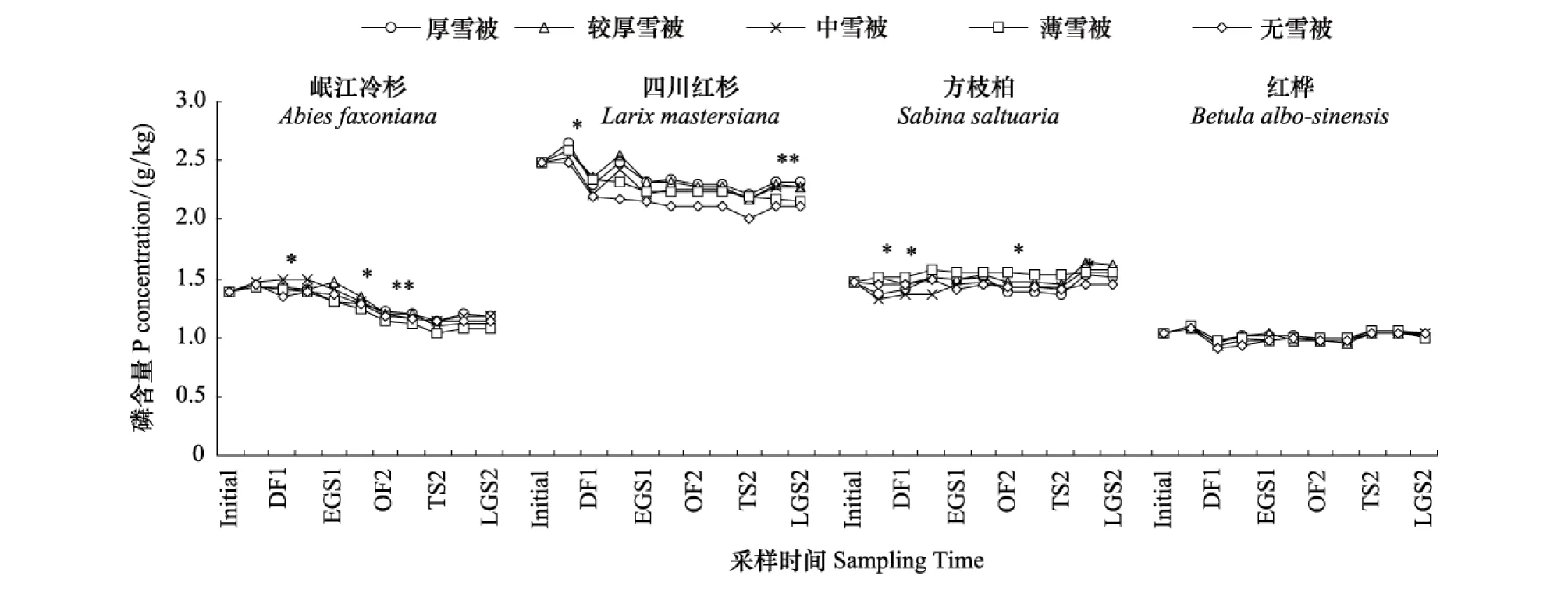
图3 不同冬季雪被条件下凋落物分解过程中磷含量变化动态
2.2 凋落物分解过程中P元素释放动态
如图4,经过近两年的分解,不同厚度冬季雪被下四川红杉凋落物P元素释放率为48.95%—51.32%,岷江冷杉为45.48%—51.32%,方枝柏为36.96%—41.58%,红桦为47.33%—49.79%。3种针叶物种凋落物P元素释放率在所调查的大部分关键时期均受到冬季雪被的显著影响(P﹤0.05),但雪被对红桦凋落物P元素释放率的影响一直不显著(P﹤0.05)。并且,岷江冷杉、四川红杉和方枝柏凋落物在EGS2,红桦凋落物在TS2中表现出明显的P富集现象。雪被覆盖明显的第1年冬季时期是4种凋落物P释放的主要时期,该时期内4种凋落物P释放率均以中雪被覆盖下最高。冷杉、红杉该时期内P释放占当年释放总量的40%左右,而方枝柏和红桦却达到了70%以上。说明凋落物中P元素在雪被覆盖作用明显的第1年冬季时期开始大规模地直接释放,没有经历富集阶段。相对于其它雪被斑块,四川红杉和方枝柏凋落物P释放率均以无雪被覆盖下最高,而中雪被覆盖下最低;岷江冷杉和红桦凋落物磷释放率以较厚雪被覆盖下最高,而无雪被覆盖下最低。而进入分解第2年中,开始有富集现象发生,可能是冬季雪被覆盖改变了P元素释放的动态。

图4 不同雪被条件下4种凋落物两年分解过程中磷释放率
统计结果还表明,物种因素显著影响整个两年10个关键时期的凋落物P元素释放率,但雪被仅显著影响两年OF、两年DF和TS1的凋落物P元素释放率,二者交互作用对OF1、TS1、EGS1、LGS1、OF2及TS2在内的6个关键时期P元素释放率产生显著影响(表2)。而物种、雪被及时间三因素交互作用,对研究中凋落物P释放率产生了显著影响(表3)。
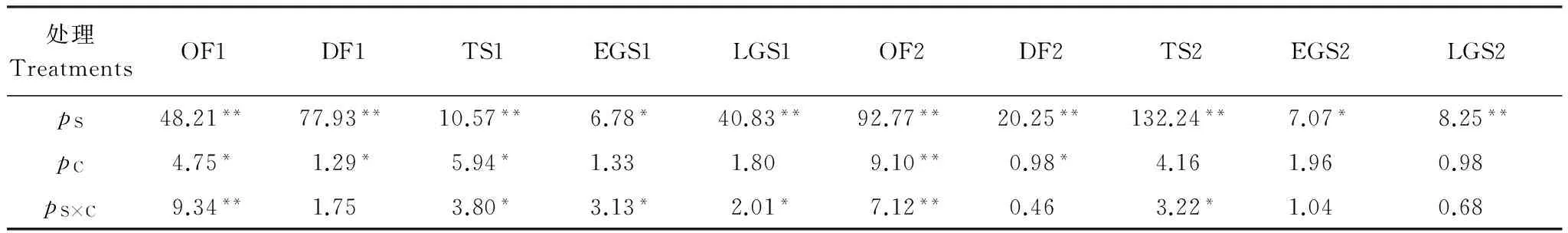
表2 物种(S)与雪被(C)对高海拔森林凋落物磷释放率的影响Table 2 Effects of species (S) and snow cover (C) on P release rate in the alpine forest

表3 物种(S)、雪被(C)与时间(T)对高海拔森林凋落物磷释放率的影响Table 3 Effects of species (S) and snow cover on P release rate in the alpine forest
不同雪被下4种凋落物P元素释放情况表明,除岷江冷杉外第1年非生长季节是凋落物P释放的主要时期。四川红杉、方枝柏及红桦3种凋落物在该时期P元素释放量占释放总量的30.07%以上。第1年生长季节开始,虽然后续的分解过程中仍然有P元素释放发生,但释放率一直低于第1年非生长季节。而岷江冷杉凋落物P元素释放量则表现为第1年生长季节最大,占释放总量的38.63%以上,其它阶段的P元素释放量也远低于第1年生长季节。
如图5,不同雪被下4种凋落物的P元素释放主要发生在第1年(达60%以上)。但不同雪被下的凋落物P释放贡献情况不尽相同。第1年冬季时期是分解过程中P释放的主要时期,第1年初冻期与深冻期中,不同雪被下的4种凋落物P释放贡献率均表现为有雪被覆盖大于无雪被覆盖,即冬季时期无雪被覆盖下凋落物P释放量占释放总量的比重最小。进入生长季节后,不同雪被下各物种凋落物P释放贡献率表现为无雪被下最大,向厚雪被方向依次递减,厚雪被覆盖下P释放贡献率最低,特别以第1年生长季节明显。说明冬季雪被覆盖不仅影响了P元素在冬季释放过程,同时也会对生长季节中的释放情况造成影响。与无雪被覆盖情况相比较,雪被覆盖下的岷江冷杉两年冬季P元素释放贡献率升高了21.22%,四川红杉升高了11.81%,方枝柏升高了49.57%,红桦升高了6.03%。
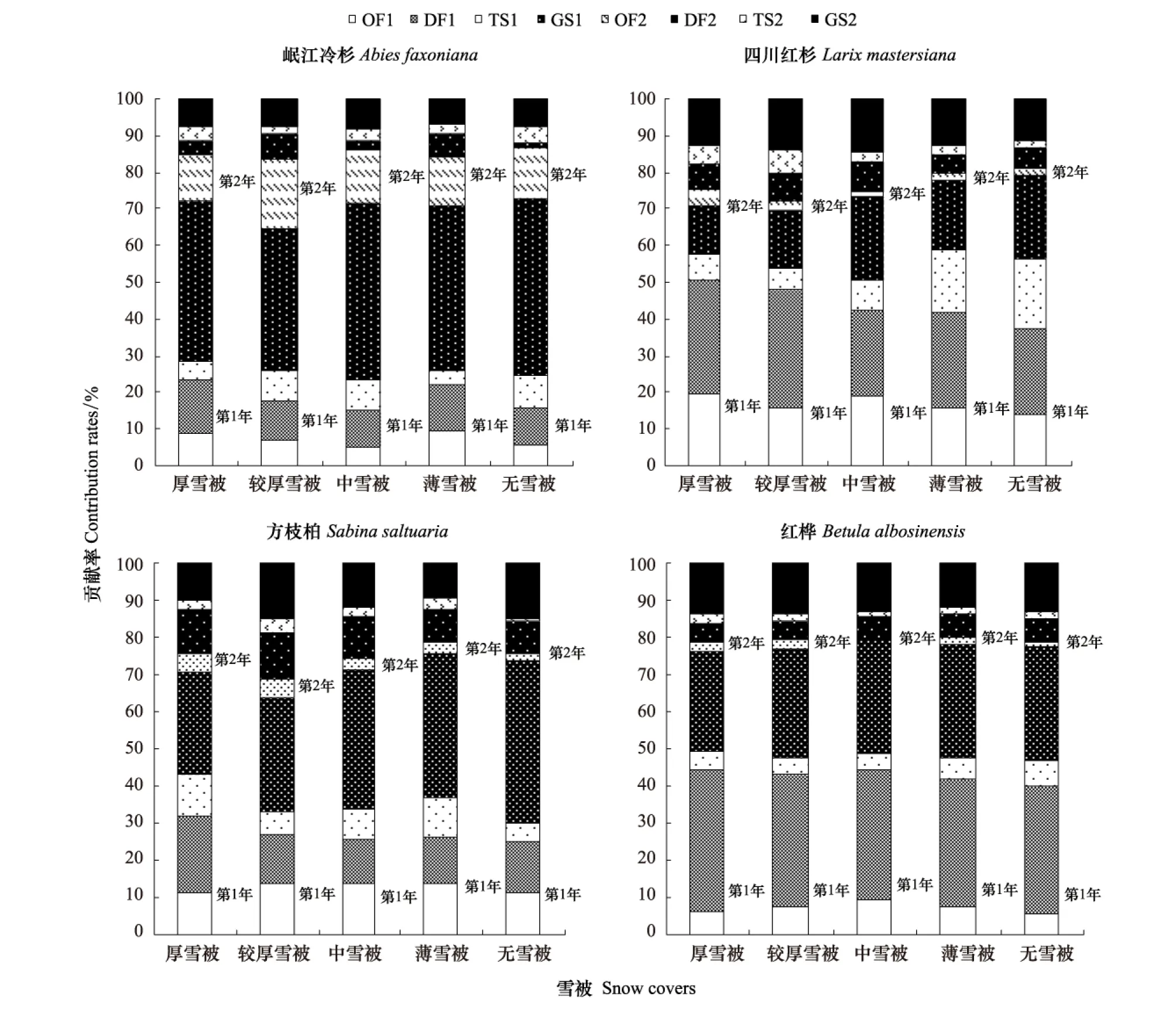
图5 不同雪被条件下凋落物于各分解阶段中磷释放贡献率
2.3 P元素释放率与凋落物质量及温度的相关关系
相对于影响凋落物质量的其它因子,土壤积温、土壤平均温度和土壤正积温与EGS2中P元素释放率密切相关,土壤负积温则是影响TS1中P元素释放率的重要因子(表4)。两年OF中,碳含量、木质素含量和L/N与P释放率密切相关;两年DF中,碳含量、氮含量、木质素含量和L/N对P释放率有显著影响;两年TS中,影响P释放率的主要因素则是,碳含量、氮含量、磷含量、纤维素含量、C/N、C/P、N/P和L/N;两年生长季节中影响P释放率的因为较为复杂,但C/N、C/P和N/P的作用较为显著。
3 讨论
在全球气候变化背景下,高海拔森林地区雪被产生的时间与留存周期的变化可能改变凋落物冬季元素释放过程,进而对生态系统物质循环产生重大影响[18]。P与N一起被认为是陆地生态系统限制植物生长过程的关键养分元素,其循环过程直接影响生态系统的生产力[10-11]。本项研究结果有力地验证了“厚型雪被斑块下相对稳定的环境条件、活跃的生物活性和融化期强烈的淋溶作用将使得冬季具有更高的凋落物P释放率,而薄型和无雪被斑块下冬季强烈的冻融循环、物理破碎,会贡献于生长季节时期凋落物P释放率”的假说。
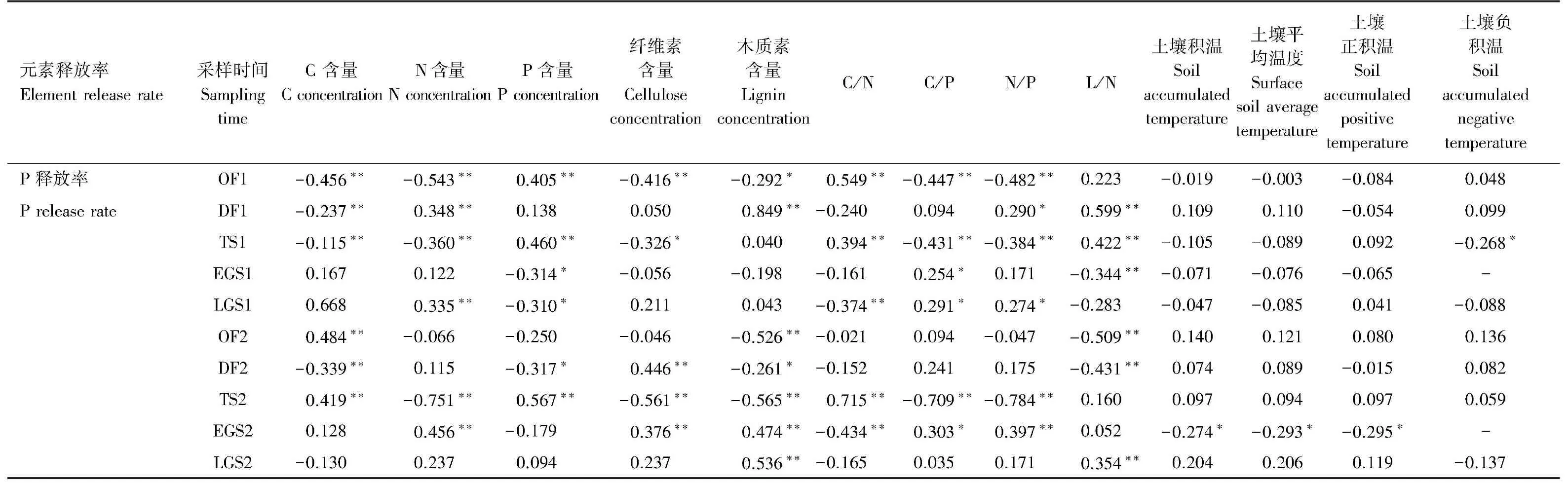
表4 磷元素释放率与分解中凋落物质量、环境温度的相关系数 (r)Table 4 Correlation coefficient (r) between decomposing litter qualities and environment temperature with P release rate
在本项研究中,冬季时期一定厚度的雪被显著提高了冬季P元素的释放,对该时期凋落物分解有促进作用,与现有在该地区的相关研究结果一致[31]。P释放情况与雪被之间的这种长效关系表明,因全球气候变化影响的积雪融化会减缓该地区内森林凋落物P元素的释放速率,影响生态系统的功能和主要过程。这些结果不仅表明不同冬季雪被斑块下温度导致的冻结作用、融化作用以及冻融循环对凋落物P的释放具有显著影响,而且分解后期明显的富集作用也表明了分解者对P的竞争,进一步证明P在高海拔森林生态过程中的限制作用。
第1年P元素含量升高的现象,可能是由于凋落物中P元素含量过低,微生物很难加以利用,只有先通过富集作用,才能顺利进入分解阶段[32];而后P元素含量降低说明雪被覆盖下的凋落物在内部结构上发生了改变,并在微生物作用下,凋落物内部有机磷迅速矿化释放[33];而第2年中P元素含量转而升高可能与两方面因素有关:一方面可能是经过雪被覆盖影响后,后期大量微生物进入凋落物内部参与分解过程[34],使凋落物P元素含量升高。另一方面可能是由于分解末期,凋落物内部P元素含量不足以支持下一阶段的分解,只得从土壤中富集一定的P元素[35]。这表明高海拔森林地区雪被覆盖下的凋落物在内部结构上出现了变化,这种变化不会通过凋落物元素含量等简单层面反应出,而是可能通过改变分解中凋落物部分组分的微形态、结构组成从而对整个分解过程产生深远影响。在两年的分解过程中,不同厚度雪被下凋落物P元素释放率分别为45.48%—51.32% (岷江冷杉)、48.95%—51.32% (四川红杉)、36.96%—41.58% (方枝柏)、47.33%—49.79% (红桦)。不同雪被下4种凋落物第1年P元素释放量占两年释放总量的60%以上,两年时间的分解过程可以明显地分为分解较快阶段和分解较慢阶段[36],同时分解贡献率情况还表明第1年分解时期是P元素释放的主要时期。因为在这一时期,凋落物中碳水化合物和易分解的N元素、P元素等均经历了快速的淋洗和降解过程,使该阶段成为凋落物失重[13]及元素释放[37]的主要阶段。而随着分解的进行,进入第2年分解后,凋落物中难分解物质聚集,使分解和元素释放速率放缓[38- 40],本项研究的结果均证明了以上结论。但P元素释放过程中富集-释放-富集的模式与已有的研究结果不一致[32,41- 44],说明高海拔森林地区所特有的季节性雪被会通过改变雪被下环境条件、分解者条件以及凋落物结构,进而对凋落物中P元素的释放模式产生影响。
凋落物的初始质量以及环境温度,是影响凋落物分解速率的重要因素。在已有的凋落物分解研究中N元素、P元素和木质素浓度、C/N、C/P、L/N比值是常见的凋落物质量指标,其中C/N和L/N最能反映凋落物分解速率[41,45]。Hornsby等[46]在不同温度下测定枯枝落叶的分解,发现分解速度随温度的升高而加快。Singh等[47]的研究结果进一步证明了温度对分解有明显作用。在本研究中,碳含量、磷含量、C/N、C/P等4种初始质量指标与P元素释放率均保持了较高的相关性,这与Gosz等[48]研究结果一致,说明凋落物的C/N、C/P比值是决定P元素释放与富集的一个重要因子。实验期内冻融作用频繁时期(2010- 10- 26至2011-04- 19;2011- 11- 27至2012-04- 28),土壤温度按厚型雪被-较厚型雪被-中型雪被-薄型雪被-无雪被顺序,波动幅度逐渐增大,不同雪被处理下白天温度较气温波动迟缓,夜间温度明显高于气温。进入生长季节(2011- 4- 19至2011- 11- 8;2012- 4- 28至2012- 10- 29),由于地形地貌、林隙大小、林隙位置等异质性因素致使阳光对实验样地地表的直射程度不同,不同雪被处理条件下的土壤温度都表现出了较大的波动趋势,且幅度随林隙到林下递减,昼夜温差明显(图2)。在雪被覆盖时期,元素的释放率与土壤负积温、正积温、平均温度积温的相关关系证明了“雪被通过改变凋落物分解环境温度对分解情况产生影响”的假设,与谭波等[26]及胡霞等[31]研究结果一致。同时,统计分析结果还表明,物种因素始终影响着凋落物P元素释放率,虽然3种针叶物种凋落物P元素释放率在所调查的大部分关键时期均受到冬季雪被的显著影响(P﹤0.05),而雪被对红桦凋落物P元素释放率的影响一直不显著,这说明由于凋落物初始质量不同,其分解过程也将产生差异。在研究雪被下针、阔叶凋落物P释放动态中,两种凋落物P释放动态产生差异则可以证明,凋落物质量是影响凋落物分解的一个重要因子[49]。
由于雪被覆盖不同时期对凋落物分解具有不同的作用机制,不同的凋落物分解阶段的P元素释放对雪被表现出不同的响应特征。有雪被与无雪被情况之间,元素释放情况差异显著,说明不同厚度雪被显著影响了P元素的释放过程。这可能是因为雪被覆盖条件下与无雪被覆盖下相比,环境温度较为稳定,为分解者的活动提供了相对适宜的环境,进而影响P元素释放情况[28,50-51];同时进入融化期后,覆盖在凋落物表面的雪被融化随之而来的强烈淋洗作用也极大的促进了元素的释放过程[52-53],使雪被覆盖下凋落物P元素释放情况产生差异。
4 结论
本项研究表明,冬季不同厚度的雪被覆盖显著影响了高海拔森林凋落物分解,受冬季雪被减少的影响,凋落物P元素释放率产生不同程度的变化。两年的分解实验证明,雪被厚度的降低将可能减缓高海拔森林凋落物中P元素的释放。影响该地区物质循环等关键过程,同时也将改变该地区森林土壤养分含量,对森林生态系统的演替造成不同程度影响。这些结果为深入认识气候变化背景下冬季环境条件的改变对物质循环等关键生态过程的影响提供了一定的基础数据。
致谢:感谢四川农业大学生态林业研究所朱鹏博士、谭波博士和四川农业大学林学院张海涛博士在论文写作中给予的帮助。
[1] Henry H A L. Climate change and soil freezing dynamics: historical trends and projected changes. Climatic Change, 2008, 87(3/4): 421- 434.
[2] Matzner E, Borken W. Do freeze-thaw events enhance C and N losses from soils of different ecosystems? A review. European Journal of Soil Science, 2008, 59(2): 274- 284.
[3] Steinweg J M, Fisk M C, McAlexander B, Groffman P M, Hardy J P. Experimental snowpack reduction alters organic matter and net N mineralization potential of soil macroaggregates in a northern hardwood forest. Biology and fertility of soils, 2008, 45(1): 1- 10.
[4] Whetton P H, Haylock M R, Galloway R. Climate change and snow-cover duration in the Australian Alps. Climatic Change, 1996, 32(4): 447- 479.
[5] Stone R S, Dutton E G, Harris J M, Longenecker D. Earlier spring snowmelt in northern Alaska as an indicator of climate change. Journal of Geophysical Research, 2002, 107(D10): ACL 10- 1-ACL 10- 13.
[6] 邓仁菊, 杨万勤, 冯瑞芳, 胡建利, 秦嘉励, 熊雪晶. 季节性冻融期间亚高山森林凋落物的质量损失及元素释放. 生态学报, 2009, 29(10): 5731- 5735.
[7] Zhu J X, He X H, Wu F Z, Yang W Q, Tan B. Decomposition ofAbiesfaxonianalitter varies with freeze-thaw stages and altitudes in subalpine/alpine forests of southwest China. Scandinavian Journal of Forest Research, 2012, 27(6): 586- 596.
[8] Zhu J X, Yang W Q, He X H. Temporal dynamics of abiotic and biotic factors on leaf litter of three plant species in relation to decomposition rate along a subalpine elevation gradient. PLoS One, 2013, 8(4): e62073.
[9] Marichal R, Mathieu J, Couteaux M M, Morad P, Royc J, Lavellea P. Earthworm and microbe response to litter and soils of tropical forest plantations with contrasting C∶N∶P stoichiometric ratios. Soil Biology and Biochemistry, 2011, 43(7): 1528- 1535.
[10] Aber J D, Melillo J M. Terrestrial Ecosystems. 2nd ed. San Diego: Academic Press, 2001.
[11] Chapin F S III, Matson P A, Vitousek P M. Principles of Terrestrial Ecosystem Ecology. New York: Springer, 2011.
[12] Berg B, McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. 2nd ed. Berlin: Springer, 2008.
[13] 武启骞, 吴福忠, 杨万勤, 徐振锋, 何伟, 何敏, 赵野逸, 朱剑霄. 季节性雪被对高山森林凋落物分解的影响. 植物生态学报, 2013, 37(4): 296- 305.
[14] Aerts R. The freezer defrosting: global warming and litter decomposition rates in cold biomes. Journal of Ecology, 2006, 94(4): 713- 724.
[15] Edwards A C, Scalenghe R, Freppaz M. Changes in the seasonal snow cover of alpine regions and its effect on soil processes: a review. Quaternary International, 2007, 162- 163: 172- 181.
[16] 徐振锋, 尹华军, 赵春章, 曹刚, 万名利, 刘庆. 陆地生态系统凋落物分解对全球气候变暖的响应. 植物生态学报, 2009, 33(6): 1208- 1219.
[17] Aaltonen H, Pumpanen J, Hakola H, Vesala T, Rasmus S, Bäck J. Snowpack concentrations and estimated fluxes of volatile organic compounds in a boreal forest. Biogeosciences, 2012, 9(6): 2033- 2044.
[18] Saccone P, Morin S, Baptist F, Bonneville J M, Colace M P, Domine F, Faure M, Geremia R, Lochet J, Poly F, Lavorel S, Clément J C. The effects of snowpack properties and plant strategies on litter decomposition during winter in subalpine meadows. Plant & Soil, 2013, 363(1/2): 215- 229.
[19] Baptist F, Yoccoz NG, Choler P. Direct and indirect control by snow cover over decomposition in alpine tundra along a snowmelt gradient. Plant & Soil, 2010, 328(1/2): 397- 410.
[20] Hobbie S E, Chapin F S III. Winter regulation of tundra litter carbon and nitrogen dynamics. Biogeochemistry, 1996, 35(2): 327- 338.
[21] Clein J S, Schimel J P. Microbial activity of tundra and taiga soils at sub-zero temperatures. Soil Biology & Biochemistry, 1995, 27(9): 1231- 1234.
[22] Christenson L M, Mitchell M J, Groffman P M. Winter climate change implications for decomposition in northeastern forests: comparisons of sugar maple litter with herbivore fecal inputs. Global Change Biology, 2010, 16(9): 2589- 2601.
[23] 杨继松, 刘景双, 于君宝, 王金达, 李新华, 孙志高. 三江平原沼泽湿地枯落物分解及其营养动态. 生态学报, 2006, 26(5): 1297- 1302.
[24] Fekete I, Varga C, Kotroczó Z, Krakomperger Z, Tóth J. The effect of temperature and moisture on enzyme activity in Síkfökút Site. Cereal Research Communications, 2007, 35(2): 381- 384.
[25] Wu F Z, Yang W Q, Zhang J, Deng R J. Litter decomposition in two subalpine forests during the freeze-thaw season. Acta Oecologica, 2010, 36(1): 135- 140.
[26] 谭波, 吴福忠, 杨万勤, 杨玉莲, 王奥, 康丽娜. 雪被去除对川西高山森林冬季土壤温度及碳、氮、磷动态的影响. 应用生态学报, 2011, 22(10): 2553- 2559.
[27] Keane R E. Biophysical controls on surface fuel litterfall and decomposition in the northern Rocky Mountains, USA. Canadian Journal of Forest Research, 2008, 38(6): 1431- 1445.
[28] 夏磊, 吴福忠, 杨万勤. 季节性冻融期间土壤动物对岷江冷杉凋落叶质量损失的贡献. 植物生态学报, 2011, 35(11): 1127- 1135.
[29] Wang A, Wu F Z, Yang W Q, Wu Z C, Wang X X, Tan B. Abundance and composition dynamics of soil ammonia-oxidizing archaea in an alpine fir forest on the eastern Tibetan Plateau of China. Canadian Journal of Microbiology, 2012, 58(5): 572- 580.
[30] Kayastha R B, Ageta Y, Nakawo M, Fujita K, Sakai A, Matsuda Y. Positive degree-day factors for ice ablation on four glaciers in the Nepalese Himalayas and Qinghai-Tibetan Plateau. Bulletin of Glaciological Research, 2003, 20: 7- 14.
[31] 胡霞, 吴宁, 吴彦, 左万庆, 郭海霞, 王金牛. 川西高原季节性雪被覆盖对窄叶鲜卑花凋落物分解和养分动态的影响. 应用生态学报, 2012, 23(5): 1226- 1232.
[32] 郭剑芬, 杨玉盛, 陈光水, 林鹏, 谢锦升. 森林凋落物分解研究进展. 林业科学, 2006, 42(4): 93- 100.
[33] 张林, 吴彦, 吴宁, 孔璐, 刘琳, 胡红宇. 林线附近主要植被类型下土壤非生长季磷素形态. 生态学报, 2010, 30(13): 3457- 3464.
[34] 周晓庆, 吴福忠, 杨万勤, 朱剑霄. 高山森林凋落物分解过程中的微生物生物量动态. 生态学报, 2011, 31(14): 4144- 4152.
[35] Hobbie S E, Eddy W C, Buyarski C R, Adair E C, Ogdah M L, Weisenhorn P. Response of decomposing litter and its microbial community to multiple forms of nitrogen enrichment. Ecological Monographs, 2012, 82(3): 389- 405.
[36] Edmonds R L, Thomas T B. Decomposition and nutrient release from green needles of western hemlock and Pacific silver fir in an old-growth temperate rain forests, Olympic National Park Washington. Canadian Journal of Botany, 1995, 25(7): 1049- 1057.
[37] Garcia-Pausas J, Casals P, RomanyàJ. Litter decomposition and faunal activity in Mediterranean forest soils: effects of N content and the moss layer. Soil Biology and Biochemistry, 2004, 36(6): 989- 997.
[38] 代静玉, 秦淑平, 周江敏. 水杉凋落物分解过程中溶解性有机质的分组组成变化. 生态环境, 2004, 13(2): 207- 210.
[39] Taylor B R, Parkinson D, Parsons W F J. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test. Ecology, 1989, 70(1): 97- 104.
[40] Aerts R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 1997, 79(3): 439- 449.
[41] Berg B. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management, 2000, 133(1/2): 13- 22.
[42] Lisanework N, Michelsen A. Litterfall and nutrient release by decomposition in three plantations compared with a natural forest in the Ethiopian highland. Forest Ecology and Management, 2004, 65(2/3): 149- 164.
[43] Xuluc-Tolosa F J, Vester H F M, Ramírez-Marcial N, Castellanos-Alboresb J, Lawrencec D. Leaf litter decomposition of tree species in three successional phases of tropical dry secondary forest in Campeche, Mexico. Forest Ecology and Management, 2003, 174(1/3): 401- 412.
[44] 沈海龙, 丁宝永, 沈国舫, 陈爱民. 樟子松人工林下针阔叶凋落物分解动态. 林业科学, 1996, 32(5): 393- 402.
[45] Sariyildiz T, Anderson J M. Interactions between litter quality, decomposition and soil fertility: a laboratory study. Soil Biology and Biochemistry, 2003, 35(3): 391- 399.
[46] Hornsby D C, Lockaby B G, Chappelka A H. Influence of microclimate on decomposition in loblolly pine stands: a field microcosm approach. Canadian Journal of Forest Research, 1995, 25(10): 1570- 1577.
[47] Singh K P, Singh P K, Tripathi S K. Litterfall, litter decomposition and nutrient release patterns in four native tree species raised on coal mine spoil at Singrauli, India. Biology and Fertility of Soils, 1999, 29(4): 371- 378.
[48] Gosz J R, Likens G E, Bormann F H. Nutrient release from decomposing leaf and branch litter in the Hubbard Brook Forest, New Hampshire. Ecological Monographs, 1973, 43(2): 173- 191.
[49] Swift M J, Heal O W, Anderson J M. Decomposition in Terrestrial Ecosystems. Berkeley: University of California Press, 1979.
[50] Stieglitz M, Déry S J, Romanovsky V E, Osterkamp T E. The role of snow cover in the warming of arctic permafrost. Geophysical Research Letters, 2003, 30(13): 54- 1- 54- 4.
[51] 刘利, 吴福忠, 杨万勤, 王奥, 谭波, 余胜. 季节性冻结初期川西亚高山/高山森林土壤细菌多样性. 生态学报, 2010, 30(20): 5687- 5694.
[52] Tomaselli M. The snow-bed vegetation in the Northern Apennines. Vegetatio, 1991, 94(2): 177- 189.
[53] Stanton M L, Rejmánek M, Galen C. Changes in vegetation and soil fertility along a predictable snowmelt gradient in the Mosquito Range, Colorado, U.S.A. Arctic and Alpine Research, 1994, 26(4): 364- 374.
Effect of snow cover on phosphorus release from leaf litter in the alpine forest in eastern Qinghai-Tibet plateau
WU Qiqian1,2, WU Fuzhong1, YANG Wanqin1,*, ZHAO Yeyi1, HE Wei1, HE Min1, ZHU Jianxiao1,3
1KeyLaboratoryofEcologicalForestryEngineeringinSichuan,InstituteofEcology&Forestry,SichuanAgriculturalUniversity,Chengdu611130,China2CenterforEcologicalResearch,NortheastForestryUniversity,Harbin150040,China3KeyLaboratoryforEarthSurfaceProcessesoftheMinistryofEducation,PekingUniversity,Beijing100871,China
Phosphorus (P) released from foliar litter plays crucial roles in maintaining soil fertility and ecosystem productivity in the P-limited forest ecosystem. The present consensus is that litter quality manipulates the rate of P release during decomposition at the local scale, and climate runs the global-scale patterns in N release during decomposition. Recently, increasing evidences have been demonstrated that the process of litter decomposition is greatly affected by winter snow cover in cold biomes. As yet, the response of foliar litter P dynamics to snow cover gradient created by forest gap and crown canopy in the high-altitude forest remains unknown. In order to understand the effect of snowpacks on winter foliar litter P dynamics and the following process in cold biomes, therefore, the litterbags with fir (Abiesfaxoniana), birch (Betulaalbo-sinensis), larch (Larixmastersiana) and cypress (Sabinasaltuaria) foliar litters were placed on the forest floor beneath different snowpacks created by forest gap and crown canopy in three alpine forest plots of eastern Qinghai-Tibet Plateau on October 26, 2010. The litterbags were taken back at the periods of onset freezing, deeply freezing and thawing in the non-growing season and in the growing season from December 2010 to December 2012, and the mass loss and P concentration in foliar litters were measured. P concentrations in foliar litters under the snow cover gradient enriched at onset period of freezing, thereafter released at deeply freezing period, and then enriched at the thawing period regardless of tree species. 30.04% to 42.59% and 8.00% to 18.04% of P were released from foliar litters in the first- and second-year of decomposition, respectively, and varied with tree species and snowpack depth. 10.15% to 30.01%, and 2.28% to 16.54% of P in foliar litters were released in first and second winter, respectively. Snowpack created by forest gap accelerated the P release of foliar litter, and higher rate of P release from foliar litters was observed under thicker snowpack. The effects of snow cover on P release from needle litters were more significant than that from broadleaved litter. Snow cover reduction slowed down the process of P release from foliar litters, which led to the difference of litter P release dynamics between in the growing season and in the non-growing season. These results imply that snow cover reduction caused by climate change and forest management might slow down the process of P release from foliar litters in high-altitude forest, and alter the P level in forest soil. More attentions should be given to the effects of heterogeneous environment factors on ecosystem process in the high-frigid forest ecosystem.
eastern Qinghai-Tibet Plateau; foliar litter; high-altitude forest; phosphorus release; snowpack gradient
国家自然科学基金(31170423, 31000213, 31270498); 国家“十二五”科技支撑计划(2011BAC09B05); 四川省杰出青年学术与技术带头人培育项目(2012JQ0008; 2012JQ0059); 中国博士后科学基金特别资助(2012T50782)
2013- 09- 06;
2014- 07- 02
10.5846/stxb201309062219
*通讯作者Corresponding author.E-mail: scyangwq@163.com
武启骞, 吴福忠, 杨万勤, 赵野逸, 何伟, 何敏, 朱剑霄.冬季雪被对青藏高原东缘高海拔森林凋落叶P元素释放的影响.生态学报,2015,35(12):4115- 4127.
Wu Q Q, Wu F Z, Yang W Q, Zhao Y Y, He W, He M, Zhu J X.Effect of snow cover on phosphorus release from leaf litter in the alpine forest in eastern Qinghai-Tibet plateau.Acta Ecologica Sinica,2015,35(12):4115- 4127.

