川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征
李志萍, 吴福忠, 杨万勤, 徐振锋, 苟小林, 熊 莉, 殷 睿, 黄 莉
四川农业大学生态林业研究所/林业生态工程省级重点实验室, 成都 611130
川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征
李志萍, 吴福忠, 杨万勤*, 徐振锋, 苟小林, 熊 莉, 殷 睿, 黄 莉
四川农业大学生态林业研究所/林业生态工程省级重点实验室, 成都 611130
为了解川西亚高山森林林窗对不同时期土壤生态过程的影响,于2012年6月—2013年5月期间,根据温度动态过程,对比研究了生长季节(土壤完全融化期、生长季节前期和生长季节后期)与非生长季节(冻结初期、深冻期和融化期)川西亚高山粗枝云杉(Piceaasperata)人工林林窗中心、林缘和林下土壤有机层和矿质土壤层转化酶和脲酶活性变化过程。结果表明:林窗不同区域中,土壤有机层转化酶活性均高于矿质土壤层;在生长季节,土壤有机层和矿质土转化酶活性表现为:林窗中心>林下>林缘,而脲酶活性表现为:林窗中心>林缘>林下。冻结初期和深冻期林窗中心土壤转化酶活性均高于林缘和林下,而在融化期林下转化酶活性高于林窗中心和林缘;冻结初期和融化期林下土壤脲酶活性显著高于林窗中心和林缘,而在深冻期林窗不同区域土壤脲酶活性没有显著差异。林窗不同区域在不同时期对土壤转化酶和脲酶活性的响应有着深刻影响。
林窗中心; 林缘; 土壤转化酶; 土壤脲酶; 亚高山森林; 林下
土壤酶主要源于土壤微生物代谢过程,以及土壤动物、植物根系分泌及残体分解[1],其活性与土壤水分、土壤温度、土壤团聚体和土壤微生物等关系密切[2]。林窗作为自然状况下森林生态系统维持的重要机制[3],其形成后由于所受太阳辐射的不同,加之林缘热力效应和林冠密度的影响,造成林窗不同区域的气温之间存在差异,并由此构成了林窗区域立体空间的环境异质性[4],必将影响林窗不同区域内土壤酶活性。在具有明显冻融季节的亚高山,林窗内部由于雪被的绝热作用而维持相对较高的土壤生物活性,以及雪被融化过程中具有强烈的淋溶作用[5- 6];而林下无雪被覆盖地区必须面对冬季严酷的环境,强烈的冻结作用和频繁的冻融循环[6]。由此可见,林窗不同区域在生长季节与冻融季节可能会对土壤酶具有一定的影响。土壤转化酶和脲酶分别是参与土壤有机碳循环和氮转化的关键酶[7],其活性的动态变化与全球气候变化相联系[8],因此研究亚高山林窗不同区域不同时期土壤转化酶与脲酶的活性动态变化对于了解林窗在全球气候变化中的作用具有一定的理论意义。但相关方面的研究国内外尚未报道。
川西亚高山森林生态系统主要分布在长江上游,是长江上游森林的主体和长江流域的重要生态屏障,对于维持区域小气候、涵养水源和水土保持等具有十分重要的意义[9]。该区亚高山森林更新以林窗为主[10],土层浅薄[11],具有长达5—6个月的季节性雪被和冻融循环,生长季节较短[12],由于风的作用、树冠的遮挡与集流、地形地貌的异质性等因素往往导致冬季林窗内外具有明显不同厚度的雪被斑块[5]。这意味着,该区不同时期林窗不同区域的环境异质性较大,且可能不同程度地影响不同土壤层次的土壤转化酶和脲酶活性。但迄今为止,有关该区林窗不同区域土壤转化酶与脲酶的研究尚未见报道。因此,本文拟通过对林窗不同区域土壤有机层和矿质层土壤转化酶与脲酶在生长季节和冻融季节的比较分析,以期为林窗在该区森林有效管理中提供一定的科学依据。
1 研究区域与研究方法
1.1 研究区域概况
研究区位于四川省理县毕棚沟(102°53′—102°57′ E,31°14′—31°19′ N),地处青藏高原东缘与四川盆地的过渡带。该区域年均气温3 ℃,最高气温23 ℃,最低气温-18 ℃,年均降水量850 mm,降雨主要分布在6—9 月。受低温限制以及山地灾害的频繁影响,研究区域土壤发育缓慢,且经常受阻,致使研究区域土体结构简单,以雏形土、冲积土和初育土为主,受地质灾害影响较小的平缓区域则以淋溶土为主。研究区域的森林植被以原始冷杉林、天然次生林、红桦纯林以及大面积的粗枝云杉人工林为主。其中,粗枝云杉人工林是20世纪50年代以来天然林采伐后人工栽植的人工林,也是整个川西亚高山地区普遍存在的低效人工林,其树种单一、病虫害严重、森林更新困难和生产力较低等人工林生态问题突出。因此,本研究以粗枝云杉人工林(El02° 56′,N31° 19′,3035 m)为研究对象,树龄约70 a,林窗边界木主要为粗枝云杉,林下灌木主要有悬钩子(Rubuscorchorifolius)、高山柳(Salixcupularis)、三颗针(Berberissargentiana)、红毛花楸(Sorbusrufopilosa)、箭竹(Fargesiaspathacea),草本主要有东方草莓(Fragariaorientalis)、接骨木(Sambucuswillamsii)、铁线莲(Clematisflorida)、羊茅(Festucaovina)、毛茛(Ranunculusjaponicus)等。
1.2 样地设置与样品采集
于2012年6月17日,在选定的粗枝云杉人工林样地中,选取了地形、坡向、海拔等立地条件基本一致3个林窗,扩展林窗面积为150 m2的人工林窗。根据土壤温度动态、冬季土壤冻结-融化过程以及前期的实验观察结果[13],于2012年6月17日生长季节前期(EGS)、生长季节后期8月26日(LGS)、冻结初期11月16日(OF)、12月26日深冻期(DF)、2013年3月12日融化期(ETS)和5月3日完全融化期(TPL),在林窗中心(GC)、林缘(GE)和林下(UC)沿顺风方向相距8—10 m各选择1个2 m×2 m的小样方,用土钻在样地内随机采集3—5点土壤有机层(OL)和矿质土壤层(MS)样品,分别按土壤层次和林窗不同区域混合后装入聚乙烯塑料封口袋中,低温保存,立即运回实验室。随后将每个样品过2 mm筛,去掉石块、动植物残体和根系后,混匀装入保鲜袋,贮于4 ℃的冰箱中备用,用于土壤转化酶和脲酶活性测定。
1.3 测定方法
在林窗中心、林缘和林下土壤5 cm处分别放置一个纽扣式温度记录器(iButton DS1923-F5, Maxim Com. USA),监测土壤温度,设定每2 h记录1次数据,试验期间土壤温度动态如图1所示。土壤酶活性测定依照《土壤酶及其研究法》进行[2]。土壤转化酶采用3,5-二硝基水杨酸比色法测定;土壤脲酶采用尿素比色法测定。1个酶活性单位(EU)以1 g土壤在37 ℃、24 h 内各自水解产生的葡萄糖和减少的尿素毫克数表示。
1.4 统计分析
采用Excel 2007和SPSS 17.0对实验数据进行统计与分析。采用重复测量方差分析(repeated measures ANOVA)检验采样时间、林窗不同区域和土壤层次对土壤转化酶和脲酶活性等测定指标的影响,采用单因素方差(One-way ANOVA)和最小显著差异法(LSD)检验林窗不同区域对土壤转化酶和脲酶活性的影响,以P< 0.05为显著水平。

图1 2012年的6月18日—2013年5月3日川西亚高山粗枝云杉人工林林窗中心、林缘和林下土壤5 cm 日均温度
2 结果与分析
2.1 林窗内外土壤有机层和矿质土壤层转化酶活性动态
整个研究期间,川西亚高山粗枝云杉人工林林窗中心、林缘和林下的土壤有机层和矿质土壤层土壤转化酶活性出现类似变化规律(图2),均表现为从EGS到OF期增加,随后在DF期降至全年最低,到ETS期升高,TPL期降低的过程。除ETS林下转化酶活性最高外,其他时期均以林窗中心最高,在生长季节,土壤有机层和矿质土壤层转化酶活性表现为:林窗中心>林下>林缘;在OF期,土壤有机层林窗和林下转化酶活性显著高于林缘,而在DF期,土壤有机层林窗中心和林缘转化酶活性显著高于林下,并且在OF和DF期,矿质土壤层林窗中心转化酶显著性高于林缘和林下;在ETS期,林下转化酶活性显著高于林窗中心和林下。同时,土壤转化酶活性对林窗中心、林缘和林下的响应与采样时间和土壤层次密切相关(表1)。
表1 采样时间、林窗区域和土层对土壤转化酶和脲酶活性的重复方差分析结果
Table 1 Results of repeated measures ANOVA for the effects of gap location, sampling date and soil layer on soil invertase and urease activities

T: 采样时间 sampling time; GL: 林窗区域 different location of the gap; L: 土层 layer
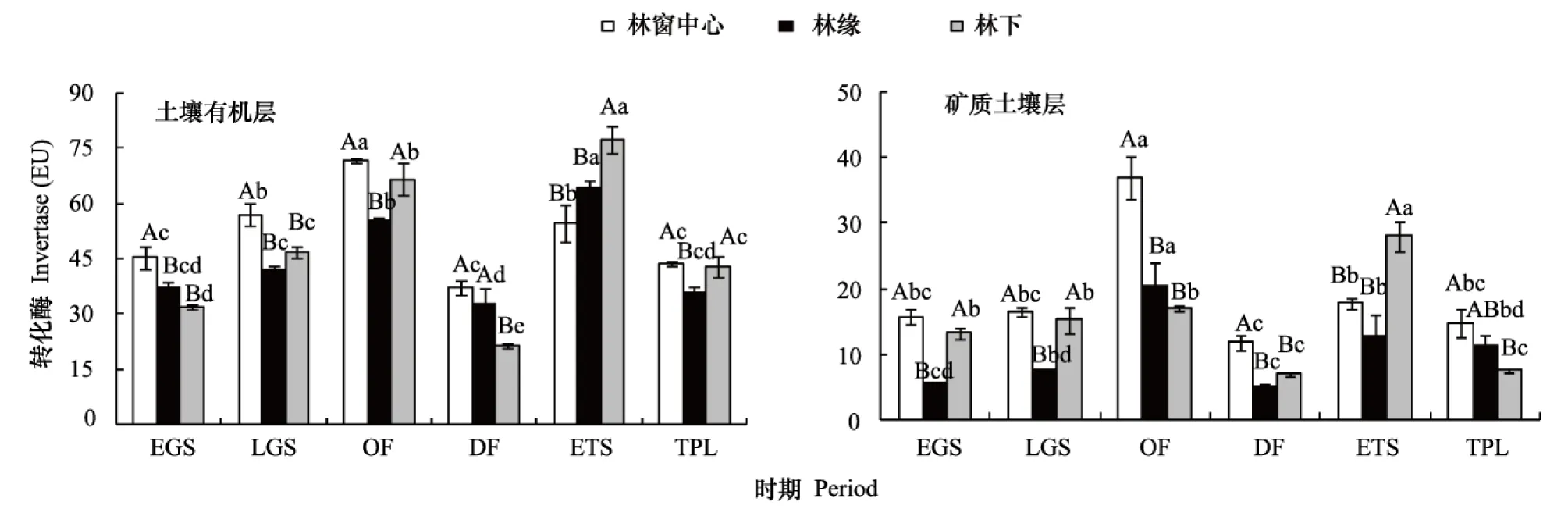
图2 林窗中心、林缘和林下土壤有机层和矿质土壤层转化酶活性的动态变化
2.2 林窗内外土壤有机层和矿质土壤层脲酶活性动态
林窗中心、林缘和林下土壤有机层和矿质土壤层土壤脲酶活性均呈现显著性季节变化(图3)。林窗中心表现为先下降,再升高再下降的变化趋势,林缘和林下均表现为先降低再升高,在DF期降低至全年最低,然后再升高再降低的变化趋势。整个研究期间,土壤有机层和矿质土壤层脲酶活性在生长季节基本表现为:林窗中心>林缘>林下;而在冻融季节基本表现为:林下>林缘>林窗中心,且在DF期,林窗不同区域对脲酶活性无显著性影响。同时,土壤脲酶活性对林窗中心、林缘和林下的响应与采样时间和土壤层次密切相关(表1)。

图3 林窗中心、林缘和林下土壤有机层和矿质土壤层脲酶活性的动态变化
3 讨论与结论
由于林冠环境差异导致降雪、降水和光照在林窗不同区域重新分配,使得林窗内水热动态在生长季节和冻融季节表现出一定的差异[5- 6],进而可能影响土壤酶活性。本研究表明,随着温度及其驱动的冻融格局变化,林窗不同区域土壤转化酶和脲酶活性在不同时期具有明显的动态规律。土壤有机层转化酶和脲酶活性均比矿质层更为敏感。尽管林窗中心、林缘和林下均在DF期出现相对较低的土壤转化酶和脲酶活性,但是除ETS期林下具有较高的转化酶活性外,林窗中心在其他时期均具有相对较高的土壤转化酶活性,在生长季节土壤转化酶活性表现为:林窗中心>林下>林缘;整个研究期间,在生长季节脲酶活性表现为:林窗中心>林缘>林下;在冻融季节脲酶活性表现为:林下>林缘>林窗中心。同时,土壤转化酶和脲酶活性对林窗区域的响应均与采样时间和土壤层次密切相关(表1)。
土壤酶活性是土壤生物和非生物环境变化的“感应器”[7]。林窗环境异质性导致冬季雪被的厚度和生长季节环境的差异可能会对土壤酶活性产生了一定的影响。川西亚高山粗枝云杉人工林林窗不同区域在生长季节土壤有机层转化酶活性虽然表现出不同程度的升高,但是林窗中心和林缘变化幅度较小,而林下变化幅度较大,并且林窗中心活性均相对较高,这可能是因为生长季时期,植物生长影响植物根系活性,导致植物输入地下的有机物及根系分泌物减少,影响土壤转化酶活性[14]。从生长季节后期到冻结初期,土壤转化酶活性显著升高,这是由于冻结作用导致动植物和微生物死亡,死亡生物细胞破裂释放出的胞内酶在短期内提高土壤酶的活性[15]。但是在冻结期林窗中心和林下土壤转化酶显著高于林缘,这可能是因为林窗中心温度相对较高增强了微生物的活性,而林下环境更为恶劣,导致更多的动植物和微生物的死亡。从冻结期到深冻期,土壤转化酶活性显著下降,同时在深冻期林窗中心转化酶活性显著高于林缘和林下,这可能是林窗中心温度较高的缘故。从深冻期到融化期土壤转化酶活性显著升高,且在融化期林下转化酶活性显著高于林窗中心和林下,这是因为随着土壤融化和温度升高,转化酶活性出现了一个爆发性增高点,林下土壤和凋落物的解冻释放了可直接利用的可溶性碳,积雪融化输入了大量有效资源,增加了转化酶底物的有效性[16- 19];同时,反复的冻融交替可杀死部分土壤生物,破坏死亡土壤生物残体细胞[12,20- 21],促进细胞内酶向土壤中释放。从融化期到完全融化期,土壤转化酶活性显著性降低,且在完全融化期林窗中心和林下显著高于林缘,这可能是因为随着土壤融化的持续进行,强烈的淋溶作用和植物竞争使土壤中有效底物含量下降[22- 24]。同时,碳源的大量耗散和死亡生物残体的迅速降解也限制了土壤生物的生长[18],使转化酶活性迅速降低。
土壤脲酶是有机氮向有效态氮转化的重要水解性生物酶,可将土壤中的有机氮水解为氨态氮,使植物所需的养分转化为有效态,对提高氮素的利用率和促进土壤氮素循环具有重要意义[25- 26]。本研究中,生长季节内,土壤有机层和矿质土壤层脲酶活性略微降低,且林窗中心脲酶活性均较高于林缘和林下,这可能是因为适宜的小气候促进微生物的生长[27],这一研究结果与Muscolo A[28]等人的研究相似。在冻融季节,土壤脲酶先略微降低,然后再显著性升高,且林下脲酶活性相对较高,原因可能是冻结期养分无机氮的释放、冻融和冻结过程中,植物根系和部分土壤生物死亡、解冻凋落物和死亡动植物残体的降解等过程导致土壤脲酶活性迅速提高[29],而林下由于无雪被覆盖而具有强烈的冻结和冻融循环[6],因而导致林下土壤脲酶活性相对较高。从融化期到完全融化期,土壤脲酶活性下降,是因为随着温度的升高,融化过程中的淋溶作用也导致部分氮素养分和含氮基质的损失,从而降低了土壤脲酶活性[29- 30]。
综上所述,川西亚高山粗枝云杉人工林林窗不同区域影响土壤转化酶和脲酶活性,但不同时期表现出不一致的变化规律。生长季节土壤转化酶和脲酶活性均相对较高,而在冻融季节林窗不同区域对土壤转化酶和脲酶活性的影响各异。这些结果为深入认识气候变化情景下林窗不同区域环境条件的异质性对物质循环等关键生态过程的影响提供了基础数据。
[1] 杨万勤, 王开运. 森林土壤酶的研究进展. 林业科学, 2004, 40(2): 152- 159.
[2] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[3] 刘庆, 吴彦. 滇西北亚高山针叶林林窗大小与更新的初步分析. 应用与环境生物学报, 2002, 8(5): 453- 459.
[4] 张一平, 刘玉洪, 马友鑫, 王进欣. 西双版纳干季晴天次生林林窗气温时空分布特征. 生态学报, 2001, 21(2): 211- 215.
[5] 何伟, 吴福忠, 杨万勤, 武启骞, 何敏, 赵野逸. 雪被斑块对高山森林两种灌木凋落叶质量损失的影响. 植物生态学报, 2013, 37(4): 306- 316.
[6] 武启骞, 吴福忠, 杨万勤, 徐振锋, 何伟, 何敏, 赵野逸, 朱剑霄. 季节性雪被对高山森林凋落物分解的影响. 植物生态学报, 2013, 37(4): 296- 305.
[7] 杨玉莲, 吴福忠, 杨万勤, 谭波, 徐振锋, 刘洋, 康丽娜. 雪被去除对川西高山冷杉林冬季土壤水解酶活性的影响. 生态学报, 2012, 32(22): 7045- 7052.
[8] 杨万勤, 王开运. 土壤酶研究动态与展望. 应用与环境生物学报, 2002, 8(5): 564- 570.
[9] 熊浩仲, 王开运, 杨万勤. 川西亚高山冷杉林和白桦林土壤酶活性季节动态. 应用与环境生物学报, 2004, 10(4): 416- 420.
[10] 刘庆. 林窗对长苞冷杉自然更新幼苗存活和生长的影响. 植物生态学报, 2004, 10(3): 281- 285.
[11] 邓仁菊, 杨万勤, 张健, 胡建利, 冯瑞芳, 简易, 林静. 川西亚高山森林土壤有机层碳、氮、磷储量特征. 应用与环境生物学报, 2007, 13(4): 492- 496.
[12] Wu F Z, Yang W Q, Zhang J, Deng R J. Litter decomposition in two subalpine forests during the freeze-thaw season. Acta Oecologica, 2010, 36(1): 135- 140.
[13] 刘金玲, 吴福忠, 杨万勤, 石培礼, 王奥, 杨玉莲, 武志超. 季节性冻融期间川西亚高山-高山森林土壤净氮矿化特征. 应用生态学报, 2012, 23(3): 610- 616.
[14] 吴秀臣, 孙辉, 杨万勤, 王开运. 川西亚高山红桦幼苗土壤蔗糖酶活性对温度和大气二氧化碳浓度升高的响应. 应用生态学报, 2007, 18(6): 1225- 1230.
[15] Decker K L M, Wang D, Waite C, Scherbatskoy T. Snow removal and ambient air temperature effects on forest soil temperatures in northern Vermont. Soil Science Society of America Journal, 2003, 67(4): 1234- 1242.
[16] Edwards K A, McCulloch J, Kershaw G P, Jefferies R L. Soil microbial and nutrient dynamics in a wet Arctic sedge meadow in late winter and early spring. Soil Biology and Biochemistry, 2006, 38(9): 2843- 2851.
[17] Freppaz M, Williams B L, Edwards A C, Scalenghe R, Zanini E. Simulating soil freeze-thaw cycles typical of winter alpine conditions: Implications for N and P availability. Applied Soil Ecology, 2007, 35(1): 247- 255.
[18] Brooks P D, Williams M W, Schmidt S K. Inorganic nitrogen and microbial biomass dynamics before and during spring snowmelt. Biogeochemistry, 1998, 43(1): 1- 15.
[19] Vavrus S. The role of terrestrial snow cover in the climate system. Climate Dynamics, 2007, 29(1): 73- 88.
[20] Jefferies R L, Alan W N, Edwards K A, Dainty J. Is the decline of soil microbial biomass in late winter coupled to changes in the physical state of cold soils?. Soil Biology and Biochemistry, 2010, 42(2): 129- 135.
[21] Larsen K S, Jonasson S, Michelsen A. Repeated freeze-thaw cycles and their effects on biological processes in two arctic ecosystem types. Applied Soil Ecology, 2002, 21(3): 187- 195.
[22] Campbell J L, Mitchell M J, Groffman P M, Christenson L M, Hardy J P. Winter in northeastern North America: A critical period for ecological processes. Frontiers in Ecology and the Environment, 2005, 3(6): 314- 322.
[23] Matzner E, Borken W. Do freeze-thaw events enhance C and N loss from soils of different ecosystems? A review. European Journal of Soil Science, 2008, 59(2): 274- 284.
[24] Hentschel K, Borken W, Matzner E. Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil. Journal of Plant Nutrition and Soil Science, 2008, 171(5): 699- 706.
[25] 周礼恺, 张志明, 曹承绵. 土壤酶活性的总体在评价土壤肥力水平中的作用. 土壤学报, 1983, 20(4): 413- 417.
[26] Zantua M I, Bremner J M. Preservation of soil samples for assay of urease activity. Soil Biology and Biochemistry, 1975, 7(4/5): 297- 299.
[27] Schmidt I K, Jonasson S, Shaver G R, Michelsen A, Nordin A. Mineralization and distribution of nutrients in plants and microbes in four arctic ecosystems: responses to warming. Plant and Soil, 2002, 242(1): 93- 106.
[28] Muscolo A, Sidari M, Mercurio R. Influence of gap size on organic matter decomposition, microbial biomass and nutrient cycle in Calabrian pine (Pinuslaricio, Poiret) stands. Forest Ecology and Management, 2007, 242(2/3): 412- 418.
[29] 谭波, 吴福忠, 杨万勤, 余胜, 杨玉莲, 王奥. 冻融末期川西亚高山-高山森林土壤水解酶活性特征. 应用生态学报, 2011, 22(5): 1162- 1168.
[30] Tan B, Wu F Z, Yang W Q, Yu S, Liu L, Wang A. The dynamics pattern of soil carbon and nutrients as soil thawing proceeded in the alpine/subalpine forest. Acta Agriculturae Scandinavica, Section B- Soil and Plant Science, 2011, 61(7): 670- 679.
[14] 吴秀臣, 孙辉, 杨万勤, 王开运. 川西亚高山红桦幼苗土壤蔗糖酶活性对温度和大气二氧化碳浓度升高的响应. 应用生态学报, 2007, 18(6): 1225- 1230.
[25] 周礼恺, 张志明, 曹承绵. 土壤酶活性的总体在评价土壤肥力水平中的作用. 土壤学报, 1983, 20(4): 413- 417.
[29] 谭波, 吴福忠, 杨万勤, 余胜, 杨玉莲, 王奥. 冻融末期川西亚高山-高山森林土壤水解酶活性特征. 应用生态学报, 2011, 22(5): 1162- 1168.
Soil invertase and urease activities at different periods in subalpine forest gap in western Sichuan
LI Zhiping, WU Fuzhong, YANG Wanqin*, XU Zhenfeng, GOU Xiaolin, XIONG Li, YIN Rui, HUANG Li
KeyLaboratoryofEcologicalForestryEngineering,InstituteofEcology&Forestry,SichuanAgriculturalUniversity,Chengdu611130,China
As an important small scale disturbance, forest gaps are often considered to be major drivers in the natural forest regeneration. Moreover, forest gaps can play essential roles in soil processes including the dynamics of soil enzyme activity, since the snow, precipitation and sunshine duration could be redistributed in different gap location due to the effects of forest canopy. Subalpine forest in western Sichuan is a typical cold biome, which often displays sensitive responses to environment disturbance because of its fragile characters. As yet, more and more recent studies have concentrated on gap characteristics and seedling regeneration processes in this area, but little attention has been given to the effects of forest gap on soil enzyme activity. As we know, soil invertase and urease are the key enzymes involved in the soil organic carbon and nitrogen transformation, respectively, and the changes of their activities are closely associated with the carbon and nitrogen cycling. Therefore, to understand the effects of forest gap on soil invertase and urease activities at different seasons in alpine forest, a field experiment was conducted in aPiceaasperataplantation forest in western Sichuan. The dynamics of soil invertase and urease activity under gap center, gap edge and under-canopy were investigated from June 2012 to May 2013. Soil samples in soil organic layer and mineral soil layer were collected in growing season (completely soil thawing stage, early stage and later stage of growing season) and freeze-thaw season (onset stage of freezing, deeply soil freezing stage and soil thawing stage). The results showed that soil invertase activity in soil organic layer was higher than that in mineral soil layer regardless of forest gap location. Soil invertase activity during the growing season in both soil organic layer and mineral soil layer showed the order: gap center > under-canopy > gap edge, but soil urease activity showed the order: gap center > gap edge > under-canopy. In comparison with gap edge and under-canopy, gap center exhibited higher soil invertase activity at onset stage of freezing and deeply soil freezing stage, while soil invertase activity in under-canopy was higher than that of gap center and gap edge at soil thawing stage. In addition, soil urease activity at onset stage of freezing and soil thawing stage was significantly higher in under-canopy than that in gap center and gap edge, although which at deeply soil freezing stage showed few differences in different gap locations. The results here imply that gap location has a profound impact on soil invertase and urease activities at different seasons in subalpine forest.
gap center; gap edge; soil invertase; soil urease; subalpine forest; under-canopy
国家自然科学基金项目(31170423, 31200474, 31270498); 国家“十二五”科技支撑计划(2011BAC09B05); 四川省杰出青年学术与技术带头人培育项目(2012JQ0008, 012JQ0059); 中国博士后科学基金(2012T50782)
2013- 08- 30;
2014- 07- 02
10.5846/stxb201308302177
*通讯作者Corresponding author.E-mail: scyangwq@163.com
李志萍, 吴福忠, 杨万勤, 徐振锋, 苟小林, 熊莉, 殷睿, 黄莉.川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征.生态学报,2015,35(12):3919- 3925.
Li Z P, Wu F Z, Yang W Q, Xu Z F, Gou X L, Xiong L, Yin R, Huang L.Soil invertase and urease activities at different periods in subalpine forest gap in western Sichuan.Acta Ecologica Sinica,2015,35(12):3919- 3925.

