苝酰亚胺衍生物的合成及光谱性能研究
胡晓霞,刘东志,李 巍,周雪琴
(天津大学化工学院,天津 300072)
苝四羧酸二酰亚胺简称苝酰亚胺 (PDI),有大的共轭体系和平面结构,具有良好的光、热和化学稳定性,吸收光谱范围较宽,是一种性能优异的光电功能材料,在有机发光二极管[1]、有机场效应晶体管[2]、分子开关和分子电线[3-4]、光收集体系[5]以及有机太阳能电池[6]等方面有着广泛的应用。
苝酰亚胺溶解性较差,在许多领域的应用受到限制,因此需要对其进行化学修饰以改善其溶解性。目前,针对苝酰亚胺的修饰主要集中在两个位置:一是在酰亚胺的 N原子上引入增溶性的取代基[7];二是在苝环海湾区引入含碳、氧、氮、硫等基团的取代基[8]。杜斌等[9-12]通过脂肪胺与苝四酸二酐的缩合反应,在酰亚胺位置引入含有长碳链的取代基,大大改善了苝酰亚胺的溶解性,研究结果表明酰亚胺位置取代基的改变不会影响化合物的光学性质;他们还通过酚类化合物与溴代(或氯代)苝四酸二酐的亲核取代反应,在苝核湾位引入苯氧基,不仅提高了苝酰亚胺的溶解度,还较大程度地改变了化合物的光学性质。
酰亚胺N原子的修饰可以形成对称苝酰亚胺和不对称苝酰亚胺,不对称苝酰亚胺可通过伯胺与N-取代的苝四羧酸二酐单酰胺单酐缩合得到。通过一端引入增溶性基团另一端引入活性位点构建的不对称苝酰亚胺衍生物可以与功能性结构单元进一步作用,形成具有良好溶解性和特殊光电性能的新型苝酰亚胺功能材料,对于拓展苝酰亚胺在有机光电功能器件等方面的应用具有重要的意义[13]。本研究以3,4∶9,10-苝四酸二酐为原料,合成了两种未见文献报道的可用于有机电致发光的不对称苝酰亚胺衍生物:N-(1-己基庚基)-N′-苯基-3,4∶9,10-苝四酸二酰亚胺 (3)和 N-(1-己基庚基)-N′-苯基-1,7-二(4-叔丁基苯氧基)-3,4∶9,10-苝四酸二酰亚胺 (7),其结构经1H NMR和 MS进行了表征,并通过紫外可见吸收光谱和荧光光谱研究了其光学性质。合成路线如图1所示。
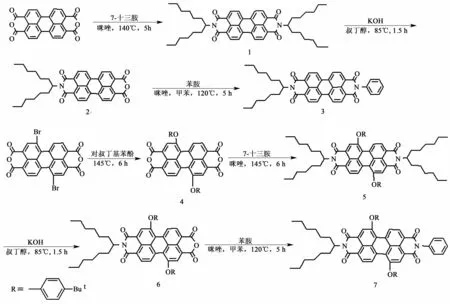
图1 合成路线图Fig.1 Schematic scheme of synthesis
1 实验部分
1.1 仪器与试剂
1H NMR由美国Burker AV500型核磁共振仪测定 (TMS内标,CDCl3为溶剂);质谱由布鲁克道尔顿公司Aotoflex tof/toff型基质辅助激光解析-串联飞行时间质谱仪测定;紫外-可见吸收光谱由Thermo公司EVOLUTION 300BB型紫外可见分光光度计测定 (CH2Cl2为溶剂);荧光光谱由美国 VARIAN公司Varian ECLIPSE型荧光分光光度计测定(CH2Cl2为溶剂)。
7-十三 胺[14]、1,7-二 溴-3,4 ∶9,10-苝 四 酸 二酐[15]及化合物 1[9]与 5[11]的合成参考文献,3,4∶9,10-苝四酸二酐为工业品,其余均为分析纯。
1.2 合成
1.2.1 N,N′-二(1-己基庚基)-3,4∶9,10-苝四酸二酰亚胺 (1)的合成
0.50 g(1.27 mmol) 3,4∶9,10-苝四甲酸二酐、0.61 g(3.1 mmol)7-十三胺和2.0 g咪唑依次加入至50 mL的三口烧瓶中,氮气保护下140℃搅拌反应5 h。反应结束后冷却至室温,加入100 mL乙醇和40 mL 2 mol/L HCl搅拌过夜。产物过滤,用水洗涤滤饼至中性,80℃真空干燥得红色固体。固体溶于适量的二氯甲烷,以n(石油醚)∶n(二氯甲烷)=1∶1为淋洗剂,经硅胶柱层析,得红色固体0.84 g,收率87.5%。 MALDI-TOF-MS (m/z):755.701[M+H]+。1H NMR(500 MHz,CDCl3, δ): 8.66 ~8.57(m,8H,perylene),5.21 [m,2H,NCH(CH2)2],2.21[m,4H, NCH(CH2)],1.84 [m,4H,NCH(CH2)],1.37 ~1.21 (m,32H,16CH2),0.82 (t,12H, 4CH3)。
1.2.2 N-(1-己 基 庚 基)-苝-3,4-酸 酐-9,10-亚 胺(2)的合成
在100 mL的单口烧瓶中依次加入0.5 g(0.65 mmol) 1,固体 KOH(127.4 mg,2.275mmol)和30 mL叔丁醇,加热至回流反应1.5 h。混合物冷却至室温,加入15 mL乙酸搅拌2 h,再加入10 mL 2 mol/L HCl搅拌30 min。过滤,水洗滤饼至中性,80℃真空干燥得红色固体。固体溶于适量的二氯甲烷中,以 n(二氯甲烷)∶n(石油醚) =2∶1为淋洗剂柱色谱提纯,收集主色带,得到红色固体175.8 mg,收率 47.2%。 MALDI-TOF-MS (m/z):574.023[M+H]+。
1.2.3 N-(1-己基庚基)-N′-苯基-3,4∶9,10-苝四酸二酰亚胺(3)的合成
158.1 mg(1.7 mmol)苯胺、2 g咪唑和 15 mL甲苯依次加入至100 mL的三口瓶中,100 mg(0.17 mmol)2溶于3 mL甲苯中1 h内滴加完毕,氮气保护下加热至回流反应5 h。冷却到室温后,减压除去甲苯,依次加入25 mL二氯甲烷、6滴浓盐酸和10 mL水,水层用二氯甲烷分两次萃取,收集有机层,旋蒸除去溶剂得到红色固体。二氯甲烷为淋洗剂硅胶柱层析提纯,得到红色固体83.1 mg,收率75.4%。 MALDI-TOF-MS (m/z): 649.682 [M+H]+。1H NMR(500 MHz, CDCl3, δ): 8.73 ~8.62(m, 8H, perylene), 7.60 (t, J=7.5 Hz, 2H;H3,5-phenyl), 7.52 (t, J=7.5 Hz, 1H; H4-phenyl), 7.37 (d, J=7.5 Hz, 2H; H2,6-phenyl), 5.21(m, 1H, NCH(CH2)2), 2.21 [m, 2H, NCH(CH2)],1.84 [m,2H, NCH(CH2)],1.37~1.21(m,16H,8CH2),0.82 (t,6H,2C H3)。
1.2.4 1,7-二(4-叔丁基苯氧基)-3,4∶9,10-苝四酸二酐(4)的合成
在 100 mL三口烧瓶中,加入 1,7-二溴-3,4∶9,10-苝四羧酸二酐1.00 g(1.82 mmol)、对叔丁基苯酚 0.89 g(5.96 mmol)、碳酸钾 0.47 g(3.37 mmol)和DMF 50 mL,氮气保护下加热至回流反应6 h。冷却至室温,加入至质量分数为25%的60 mL醋酸溶液中,搅拌30 min,过滤,洗涤至滤饼呈中性,80℃真空干燥 12 h,得到紫红色固体 1.09 g,收率87.1%。 MALDI-TOF-MS(m/z):688.204 [M]+。
1.2.5 N,N′-二(1-己基庚基)-1,7-二(4-叔丁基苯氧基)-3,4∶9,10-苝四酸二酰亚胺(5)的合成
在50 mL三口烧瓶中,加入7-十三胺 0.17 g(0.85 mmol)、0.23 g(0.33 mmol) 的 4 和 咪 唑1.10 g,氮气保护下140℃反应5 h。冷却至室温,加入30 mL二氯甲烷、50 mL水,水层用二氯甲烷萃取两次,收集有机层,旋蒸除去溶剂得到红色固体。以二氯甲烷为溶剂,n(石油醚)∶n(二氯甲烷)=1∶1为淋洗剂柱层析提纯,得到红色固体0.22 g,收率为63.3%。 MALDI-TOF MS(m/z):1 050.614 [M]+。1H NMR(500 MHz, CDCl3) δ: 9.61 (d, J=8.5 Hz, 2H, H5,11-perylene), 8.61 (d, J=8.5 Hz, 2H,H6,12-perylene), 8.37 (s, 2H, H2,8-perylene), 7.48(d, J=8.6Hz, 4H, H3,5-phenoxyl), 7.12 (d, J=8.5 Hz, 4H, H2,6-phenoxyl), 5.13 (m, 2H,-NCH(CH2)2), 2.18 [m, 4H,-NCH(CH2)], 1.83[m, 4H,-NCH(CH2)], 1.38 (s, 18H, 2 t-Bu),1.35-1.10 (m,32H,16CH2),0.82 (t,12H,4CH3)。
1.2.6 N-(1-己 基 庚 基 )-1,7-二 (4-叔 丁 基 苯 氧基)-苝-3,4-酸酐-9,10-亚胺(6)的合成
在50 mL单口烧瓶中加入117.4 mg(0.11 mmol)的 5、固体 KOH 25.8 mg(0.39 mmol)和叔丁醇10 mL,85℃回流1.5 h。冷却至室温,加入2.0 mL乙酸、1 mL 2 mol/L稀盐酸搅拌2.5 h,过滤,滤饼用水洗涤至中性。用二氯甲烷溶解固体,n(二氯甲烷)∶n(石油醚)=1∶1为淋洗剂柱层析提纯,收集红色主色带,得到红色固体 29.6 mg,收率 31.8%。MALDI-TOF MS(m/z):869.709 [M]+。
1.2.7 N-(1-己基庚基)-N′-苯基-1,7-二(4-叔丁基苯氧基)-3,4∶9,10-苝四酸二酰亚胺(7)的合成
在100 mL三口烧瓶中,加入苯胺53.8 mg(0.575 mmol)、咪唑1.0 g和甲苯8.5 mL加热至回流,50 mg(0.0575 mmol)的6 溶于 1.5 mL甲苯 1 h内滴加完毕,反应5 h。冷却至室温,减压除去甲苯,加入10 mL二氯甲烷、4滴浓盐酸和8.5 mL水,水层用二氯甲烷分两次萃取,收集有机层,旋蒸除去溶剂得到红色固体。二氯甲烷溶解产品,二氯甲烷为淋洗剂硅胶柱层析提纯,得到红色固体46.8 mg,收率 78.4%。 MALDI-TOF-MS(m/z):945.026 [M+H]+。1H NMR(500 MHz, CDCl3) δ: 9.62 ~9.59(m, 2H, H5,11-perylene), 8.59 ~8.56 (m, 2H,H6,12-perylene), 8.36(s, 2H, H2,8-perylene), 7.60(t, J=7.5 Hz, 2H; H3,5-phenyl), 7.52 (t, J=7.5 Hz, 1H; H4-phenyl), 7.48 ~7.45 (m, 4H, H3,5-phenoxyl), 7.37 (d, J=7.5 Hz, 2H; H2,6-phenyl),7.13 ~-7.06 (m, 4H, H2,6-phenoxyl), 5.13 [m,1H,-NCH(CH2)2], 2.19 [m, 2H,-NCH(CH2)],1.79 [m, 2H,-NCH(CH2)], 1.35 (s, 9H,t-Bu),1.33 (s,9H, t-Bu),1.30-1.13 (m, 16H,8CH2), 0.82 (t, 6H, 2CH3)。
2 结果与讨论
2.1 苝酰亚胺化合物的合成
不对称的苝酰亚胺可通过伯胺与N-取代的苝四羧酸二酐单酰胺单酐缩合得到,文献报道苝酰亚胺单酐的合成有3种不同的方法[16-17]。1)苝酐与脂肪胺直接反应,控制反应时间、投料比和温度得到苝酰亚胺单酐,收率一般为20% ~60%;2)对称苝酰亚胺的水解,水解可以在氢氧化钾和叔丁醇或异丙醇中进行,收率一般为 40% ~60%;3)3,4,9,10-3,4-酸酐-9-羧酸-10-羧酸钾与脂肪胺水溶液反应制备单酐,收率可以达到60%~90%。由于7-十三胺的原料7-十三酮价格比较昂贵,为了减少原料用量,缩短合成路线,开始选择了第一种合成路线,以吡啶为溶剂,4与7-十三胺1∶1(物质的量之比)加热回流反应,但是多次的尝试没有得到目标产物,分析原因可能是7-十三胺的碳链较长,空间位阻较大,直接合成单酐比较困难,需要高沸点的溶剂。最后选择了第2种合成路线,先合成对称苝酰亚胺5,再在氢氧化钾的叔丁醇溶液中水解得到目标产物。
2.2 紫外-可见吸收光谱分析
图2为1、3、5和7的紫外-可见吸收光谱,谱图的数据进行了归一化处理,即将每个谱图的数据除以各自的最高峰值。苝的分子轨道由3个最高占有轨道(HOMO)和3个最低空轨道(LUMO)组成,其中3个LUMO处于简并态。

图2 化合物1、3、5和7在二氯甲烷中的紫外-可见吸收光谱图(归一化)Fig.2 Normalized absorp tion spectra of compound 1, 3,5 and 7 in dich loromethane
由图2可见,化合物3峰型较尖,有3个特征吸收峰 分 别 为 Q(2,0)(460 nm)、 Q(1,0)(491 nm) 和Q(0,0)(529 nm)。 与化合物 3 相比,在苝核湾位引入2个叔丁基苯氧基后,化合物7的最大吸收波长红移至546 nm,吸收峰变宽,精细结构明显减弱。这是因为在苝核海湾区引入了2个供电性基团,分子内形成了给体-受体结构,当受激发光照射时,分子内部发生了激发态电子转移,克服了母体结构扭曲所带来的不利影响,降低了基态与激发态之间的能量差,使得化合物7的吸收光谱发生红移;另外,海湾区引入的基团造成苝核分子构象的扭曲,使得吸收峰变宽,精细结构减弱[18]。将对称型苝酰亚胺1和5与不对称苝酰亚胺3和7的吸收光谱比较,无明显的变化,说明酰亚胺N上的取代基对苝酰亚胺的光谱影响很小。
2.3 荧光光谱分析
图3为1、3、5和7的荧光光谱图,谱图的数据进行了归一化处理,即将每个谱图的数据除以各自的最高峰值。

图3 1、3、5和7在二氯甲烷中的荧光光谱图(归一化)Fig.3 Normalized fluorescence spectra of compound 1, 3,5 and 7 in dich loromethane
由图3可见,化合物3有3个荧光发射峰,分别位于536、575和622 nm,与吸收光谱的3个特征吸收峰相对应。与化合物3相比,化合物7的最大发射波长(λem)红移至575 nm,这是由于供电子基团的引入,发生了分子内激发态电子转移,降低了激发态与基态之间的能级差。
化合物1、3、5、7的吸收光谱和荧光光谱数据见表1(Δλ为Stokes位移值)。由表1可见,7在3的苝核湾位引入2个叔丁基苯氧基之后其λmax和λem均发生了红移,且Δλ明显增大;5与7相比,仅是酰亚胺N原子上的取代基不同,吸收与发射光谱相似,Stokes位移几乎不变。这是因为苝核海湾区的取代基对化合物的荧光性质有较大的影响,而酰亚胺中N原子处于苝酰亚胺分子的最高占有轨道(HOMO)和最低空轨道 (LUMO)的节点处,N原子上取代基的改变对于苝酰亚胺的吸收和发射光谱影响很小。Stokes位移的增大是由于取代基的引入导致苝分子结构中相邻的2个萘分子发生了扭曲,破坏了苝环的分子平面结构,降低了大π电子体系的共轭度。
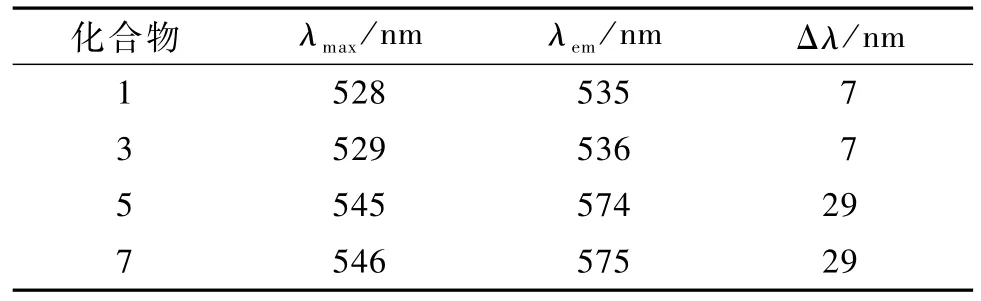
表1 1、3、5、7在二氯甲烷中的吸收和荧光光谱数据Table 1 Absorp tion and fluorescence spectra data of compound 1, 3,5 and 7 in dich loromethane
3 结论
设计合成了2种新型的不对称苝酰亚胺化合物:N-(1-己基庚基)-N′-苯基-3,4∶9,10-苝四酸二酰亚胺 (3)和 N-(1-己基庚基)-N′-苯基-1,7-二(4-叔丁基苯氧基)-3,4∶9,10-苝四酸二酰亚胺 (7)。 较长的N取代烷基和苝核海湾区取代基的引入使得溶解度大大增加,吸收光谱和荧光光谱表明与3相比,7的λmax和λem均发生了红移,Stokes位移达到了29 nm。
研究结果表明,在苝核的海湾区引入叔丁基苯氧基,破坏了分子的共平面性和π电子共轭体系,使得Stokes位移增大;同时叔丁基苯氧基具有供电性使得分子内能够形成电子给体-受体结构,克服了母体结构扭曲所带来的不利影响,导致吸收光谱和荧光光谱的红移。这种具有良好给体-受体分子结构的不对称苝酰亚胺可以与功能性结构单元进一步作用形成具有优异性能的新型苝酰亚胺功能材料,对于不对称苝酰亚胺的改性正在研究中,待以后的文章中报道。
[1]Liao S, Shui J, Wu C.Hydroxynaphthyridine-Derived group IIImetal chelates:Wide band gap and deep blue analogues of green Alq(3) (tris(8-hydroxyquinolate) aluminum)and their versatile applications for organic light-emitting diodes[J].J AmChemSoc, 2009, 131(2):763-777
[2]Effertz C,Lahme S,Schulz P,et al.Design of novel dielectric surface modifications for perylene thin-filmtransistors[J].Adv Funct Mater, 2012, 22(2): 415-420
[3]Miura T,Wasielewski MR.Manipulating photogenerated radical ion pair lifetimes in wirelike molecules using microwave pulses: Molecular spintronic gates[J].JAmChemSoc, 2011, 133(9):2 844-2 847
[4]A lamiry MA H,Hagon JP,Harriman A,et al.Resolving the contribution due to Forster-type intramolecular electronic energy transfer in closely coupled molecular dyads[J].Chemical Science, 2012, 3(4):1 041-1 048
[5]Wang F, Tang J, Liu J, et al.Synthesis and photoinduced electron transfer characteristic of a bis(zincporphyrin)-perylene bisimide array[J].JPhys Org Chem,2011, 24(11): 1 101-1 109
[6]Li C,Wonneberger H.Perylene imides for organic photovoltaics: Yesterday, today, and tomorrow[J].Adv Mater, 2012, 24(5): 613-636
[7]Langhal H.Cyclic carboxylic imide structures as structure elements of high stability.Novel developments in perylene dye chemistry[J].Heterocycles, 1995, 40:477-499
[8]Würthner F,Stepanenko V,Chen Z,et al.Preparation and characterization of regioisomerically pure 1,7-disubstituted perylene[J].JOrg Chem, 2004, 69:7 933-7 939
[9]杜斌,余建华,李志军,等.新型苝酰亚胺衍生物的合成及 其 光 学 性 能 [J].合 成 化 学,2012,20(4):421-424 Du Bing, Yu Jianhua,Li Zhijun, et al.Synthesis and optical properties of novel perylene diimide derivatives[J].Chinese Journal of Synthetic Chemistry, 2012, 20(4):421-424 (in Chinese)
[10]杜斌,余建华,王普红,等.苝酰亚胺衍生物的合成及其荧光性能研究[J].材料导报,2012,26 (19):243-246 Du Bing, Yu Jianhua, Wang Puhong,et al.Synthesis of perylene diimide derivatives and its fluorescent ability study[J].Material Review, 2012,26(19):243-246(in Chinese)
[11]徐业伟,朱方华,张海连,等.苝四羧酸二酰亚胺衍生物的合成及其性能研究[J].合成化学,2009,17(4):456-458 Xu Yewei, Zhu Fanghua, Zhang Hailian,et al.Synthesis of perylene diimide derivatives and their performance study[J].Chinese Journal of Synthetic Chemistry,2009,17(4):456-458 (in Chinese)
[12]王鹏,张海连,张林.新型红光材料-苝四羧酸二酰亚胺类化合物的合成及表征[J].化工进展,2008,27(3): 460-462 Wang Peng, Zhang Hailian, Zhang Lin.Synthesis andcharacterization of perylene diimides newstyle red lightemittingmaterial[J].Chemical Industry and Engineering Progress, 2008, 27(3): 460-462 (in Chinese)
[13]Ma L, Wang Q, Lu G, et al.Photochromic nanostructures based on diarylethenes with perylene diimide[J].Langmuir, 2010, 26(9):6 702-6 707
[14]Richard F B, Mark D B, Dupont D.The cyanohydridoborate anion as a selective reducing agent[J].J AmChemSoc, 1971, 93(12):2 897-2 904
[15]Tsutomu I, Kohichi M, Yusuke I, et al.Light-Harvesting and energy-transfer systembased on self-assembling perylene diimide-appended hexaazatriphenylene[J].Organic Letters, 2005, 7(15): 3 175-3 178
[16]Langhals H, Jona W.The synthesis of perylene bisimide monoearboxylic acids[J].Eur JOrg Chem, 1998, 847-551
[17]Helmut T.Untersuchungen zur protonierung von perylene-3,4 ∶9,10-tetracarbonsäurealkalisalzen[J].Dye and Pigments, 1983, 4: 171-174
[18]Zhao C, Zhang Y, Li R, et al.Di(alkoxy)-and Di(alkylthio)-substituted perylene-3,4:9,10-tetracarboxy diimides with tunable electrochemical and photophysical properties[J].JOrg Chem, 2007, 72: 2 402-2 410

