水下制氢反应室动态过程数值分析*
张方方,张振山,王晋忠
(1.海军工程大学 兵器工程系, 湖北 武汉 430033; 2. 海军驻874厂军事代表室, 山西 侯马 043000)
水下制氢反应室动态过程数值分析*
张方方1,张振山1,王晋忠2
(1.海军工程大学 兵器工程系, 湖北 武汉430033; 2. 海军驻874厂军事代表室, 山西 侯马043000)
摘要:为研究水下制氢反应室的动态过程规律,基于化学反应动力学和单液滴运动学得到合金/水反应转化率,并在最小自由能法计算得到生成物各组分摩尔数的基础上利用质量守恒方程得到室内各物质质量变化规律。在建立非线性移动边界螺旋管动态模型的前提下,利用能量守恒方程得到室内热力参数变化规律,进而完成制氢反应室动态过程详尽模型的建立。利用该模型编写计算程序,完成某水下制氢反应室动态过程仿真。结果表明,各仿真曲线较好地反映了对应参数的动态变化规律,验证了模型建立与仿真的正确性;合金/水反应转化率决定了反应室的物质质量变化规律及其能量释放特性。该模型可以作为制氢反应室动态特性分析及其过程控制研究的基础模型。
关键词:热力学;水下航行器;富铝合金;制氢反应室;动态过程;数值分析
富铝合金/水反应具有能量密度高、氢气产量和纯度高等优点[1],这使其成为水下氢氧热动力系统较为理想的储氢制氢方式。
铝/水反应在原理上的可行性受到铝表面氧化层的阻止,破坏铝表面固有和抑制原位再生致密氧化膜的主要方法有在水中加入腐蚀性溶质法[2]、物理破除氧化膜法[3]、机械球磨法[4]以及铝合金化法[5]。水下制氢对快速性和可控性要求较高,上述方法中,制氢速率较快的是NaOH溶液法[6],且不论该方法水下应用对设备的严格要求,即使是最大析氢速率也不能满足动力系统的需要。从储能密度和实现简易性方面考虑,水下制氢可采用铝合金化法。
Kravchenko等[7]指出铝与多个低熔点金属形成合金后,可在82℃的中性水中水解产生可观流量的氢气;孙立贤等[8]制备了Al-Bi和Al-Sn体系在NaCl溶液中反应,指出该合金室温下反应转化率可达到92%;Woodall等[9]在铝镓合金的基础上利用加热熔炼法制备Al,Ga,In,Sn四元合金,In和Sn的加入使得合金活性大大增强,进而使合金水解制氢在更低的温度下即可进行。上述文献中添加的活性金属组分均不与水反应析出氢气,其势必降低水下储氢、储能密度。浙江大学杨卫娟等[10]利用最小自由能法对熔融态铝锂、铝镁合金/水反应制氢进行了热力学分析,并指出Li,Mg含量的增加有效抑制了Al2O3的生成。高温熔融态合金保证了制氢的快速性,且金属Li,Mg均与水反应析出氢气,进而保证水下储氢和储能密度。
1工作机理及基本假设
1.1 制氢反应室工作机理
水下制氢反应室的工作过程可简单表述为,反应水采用浸没喷射的方式与高温熔融态富铝合金反应放出大量热量,其经过外围螺旋管冷却和部分反应水蒸发冷却后,生成水下氢氧燃烧室所需要的氢气和过热蒸汽。制氢反应室工作机理如图1所示。

图1 制氢反应室工作机理图Fig.1 Working mechanism of hydrogen generation reactor
结合图1分析水下熔融态富铝合金/水反应的复杂过程,将室内空间划分为三部分:反应区、环流区和蒸发区。燃烧区在喷嘴周围,该区域的大小由喷嘴出口反应水的水滴初速和雾化锥角决定,该区域内反应水处于加热、蒸发和反应消耗状态;环流区位于反应区上方,是反应水入口动量和气相生成物搅拌共同作用的结果,环流作用将加速反应水的蒸发和反应消耗;蒸发区位于熔池最上层,该层的环流和搅拌作用较弱,反应产物在该层集聚致使合金浓度较低,从而可认为该区域内反应水只蒸发而不参与反应,且反应室上方的过热蒸汽也不与该区熔液反应,而反应区和环流区内的蒸汽可认为与合金溶液瞬间完成反应。由此可见,反应室内的过热蒸汽几乎全部来自反应水蒸发,而只有极少量是由合金/水反应产生的。
螺旋管是反应室的主要冷却环节,其主要作用是防止室内反应热集聚而烧毁反应室;另一作用是,螺旋管出口相对低温过热蒸汽通入氢氧燃烧室起到冷却作用的同时,实现系统热量的综合利用。
1.2 基本假设
本文试图对具有复杂化学反应过程的水下制氢反应室动态过程建立数学模型,需要考虑的因素较多,为简化模型推导,做以下合理假设:
1)制氢反应室内部系统在剧烈反应和气相生成物强烈搅拌作用下处于均匀状态,各组分在凝聚相和气相内均匀分布且温度、压力相同,内部系统热力参数可由平均压力pH和平均温度TH予以描述;
2)微小时间步长Δt内,pH和TH的变化量十分有限,内部系统工作于恒温等压状态,各组分生成物满足吉布斯自由能之和最小;
3)制氢动态过程由无数个Δt时间段内达到平衡的化学反应组成,但其不满足热力学平衡,随着动态过程的结束其达到化学和热力学平衡状态;
4)反应水滴在合金熔液内运动时只受浮力、重力和黏性阻力的作用;
5)模型适用于正常运行工况,暂不考虑反应室的启动过程,即不考虑合金的吸热熔化过程和螺旋管的起始通水过程。
2数学模型
2.1 反应转化率模型
所研究的富铝合金/水反应制氢动力学隶属非均相反应动力学,反应速率常数可采用Arrhenius方程描述,其非恒温条件下的反应动力学方程为:

(1)
式中,α为反应转化率,A为频率因子,E为反应活化能,R为气体常数,n为反应级数。
在时间tr内对式(1)积分,可得积分形式的制氢反应动力学机理函数;同时考虑富铝合金浓度变化对反应的影响,可得合金/水反应转化率α为:

(2)
式中:na,n0a分别为t时刻和0时刻的富铝合金的摩尔总数;tr为反应水滴的总反应时间,其求解需要建立反应水滴在合金溶液中的运动模型。
合金熔液中反应水滴的运动受诸多因素影响。环流作用使部分反应水滴的tr增加而使另一部分反应水滴的tr减小,故环流的综合作用结果可认为相互抵消;气相反应生成物的上升运动使tr减小,而固相生成物的阻尼作用使tr增加,故生成物的综合作用仍可认为相互抵消。根据基本假设5,反应水滴的受力如图2所示。

图2 反应水滴受力图Fig.2 Force diagram of reaction drip
图2中,Fb,G,Fd分别为控制体受到的浮力、重力和黏性阻力;on,oτ分别为制氢反应室的轴向和径向;坐标原点o位于反应水喷嘴出口点;喷嘴的雾化锥角为2θ;液滴的初速为v0;dm表示液滴运动过程中的平均直径。
Fb和G的计算不予赘述, Fd可表示为:
Fd=0.5CρaSv2
(3)


(4)
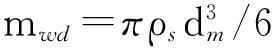
结合制氢反应室的组织方式,可将合金/水反应转化率α定义为:
α=(m0H2O-msH2O)/m0H2O
(5)
式中,m0H2O,msH2O分别表示反应水滴喷入熔池时刻以及运动至熔池液面时刻的质量。
综上所述,由反应水滴的运动学分析及其化学反应动力学分析可得反应总时间tr和转化率α,根据式(5)即可分别求得水滴中参与反应和参与蒸发的水质量mrH2O和meH2O。
2.2 室内物质质量守恒方程
制氢反应室内各元素摩尔原子总数在化学反应前后不发生改变,微小时间步长Δt内对应的方程为:

(6)
式中,Nk表示Δt时间内反应物中含有k元素的摩尔原子总数,M为室内元素总数,Akj为1 mol组分j中含有k元素的摩尔原子数,P为生成物含有的组分总数,nj为Δt时间内生成物组分j的摩尔数。


(7)
式中MH2O为水的摩尔质量。
室内凝聚相生成物主要有Al,Mg,Li,Al2O3,MgO,Li2O,LiOH,LiAlO2,MgAl2O4;气相生成物有H2和H2O,其分别对应j=1,2,…,11。根据基本假设2,利用最小自由能法计算该复杂系统化学反应平衡组成,具体求解过程可参考文献[11]。
由最小吉布斯自由能法求得的各组分摩尔数nj,并结合制氢反应室工作机理可得各组分质量为:

(8)
式中,Mj为组分j的摩尔质量,mirj(j=1,2,…,11)为反应室内组分j的总质量,mrj(j=10,11)为反应生成的组分j的总质量。
凝聚相在过滤装置作用下一直存于反应室内,而气相生成物则需要进入燃烧室参与燃烧和冷却,故室内气相组分质量mirj=mrj-moj(j=10,11),其中,moj为气相组分j流出反应室的总质量,基于喷管原理可推导其随时间的变化率:

(9)
式中:Ae为连接制氢反应室与氢氧燃烧室的管道有效截面积;mig=mirH2+mirH2O,为室内气体总质量;pc为燃烧室的平均压力;κig,κκig,Rgig分别为室内混合气体的绝热指数、临界压力比和气体常数。
2.3 反应室能量守恒方程
螺旋管建模计算是制氢反应室能量释放特性分析的基础,其物理模型示意图如图3所示。

图3 移动边界的螺旋管物理模型示意图Fig.3 Schematic diagram of helical tube physical model with time-varying phase boundaries
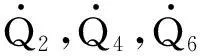
根据室内反应生成物组分计算结果,可将制氢反应方程式表示为:
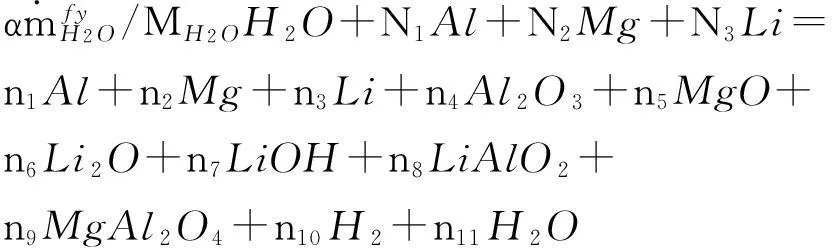
(10)
室内反应水滴的热力状态变化以及合金/水反应满足以下能量方程:
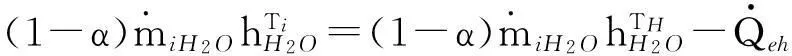
(11)

(12)

对室内系统运用能量守恒定律,单位时间内合金/水反应放热量Qrh除去螺旋管吸热量Qht和蒸发水吸热量Qeh后全部用于室内物质内能的增加,故存在
dQrh=dQht+dQeh+dU
(13)
式中,dQht=dQ2+dQ4+dQ6,为单位时间内螺旋管吸热量;dU=cVmmirdTH+cVmTHdmir,为室内物质内能增量,将其代入式(13)可得反应室温度随时间变化率:
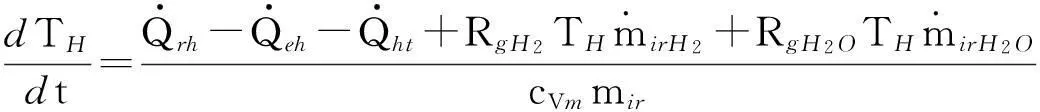
(14)
式中,mir和cVm分别表示室内物质质量之和及其平均定容比热容。
上述方程须联立气体状态方程方可求解,利用SHBWR状态方程描述燃烧室内真实气体状态[14]:

(15)
式中,A0,B0,C0,D0,E0,a0,b0,c0,d0,α,γ为SHBWR状态方程的11个参数值,对于反应室内混合气体11个参数值的求解可参考文献[15];ρig=(mirH2+mirH2O)/(MigVig),为室内气体密度,其中Vig和Mig分别为室内气体的体积和摩尔质量;R为室内气体摩尔气体常数。
3案例仿真及分析

3.1 合金/水反应转化率变化规律及分析
利用液滴运动学模型和化学反应动力学模型对室内合金/水反应转化率进行仿真计算,计算结果如图4和图5所示。
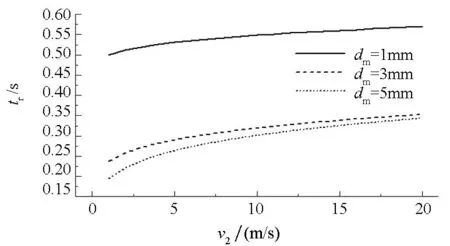
图4 液滴反应总时间变化曲线Fig.4 Reaction time variation of water droplet

图5 合金/水反应转化率变化曲线Fig.5 Conversion rate variation of alloy and water reaction
图4给出了不同直径、不同初速的液滴总反应时间tr随时间的变化曲线。由图4可知,tr随液滴直径dm的减小、初速v0的增加而增大,且液滴直径dm的变化起主要作用。液滴直径dm越小则tr越大,进而使转化率α增大,这表明反应液滴雾化粒子越细小,反应进行得越彻底;反应液滴随着初速的增大向反应室底部运动的距离就越长,进而使其在合金熔池内运动总时间,也即液滴总反应时间tr增长。
图5给出了室内合金/水反应转化率随时间的变化曲线,在液滴直径dm=3 mm及其初速v0=10 m/s的情况下,转化率由室内温度和合金摩尔分数共同决定。由于α由tr代入Arrhenius方程计算得到,故α为某液滴tr时间内的转化率之和,当制氢平稳运行时α可视为该时刻室内所有液滴反应转化率的统计结果。由图5知,温度影响下的转化率αT随室内平均温度的增加而增加,以t=12.4 s为界点分为两阶段,且后一阶段反应室温度较高反应转化率随温度的增长速率相对较大,其变化规律由活化能E和频率因子A决定,而合金摩尔分数xa=na/n0a随反应的进行近似线性减小。两者共同作用致使合金/水反应总转化率呈连续两段近似抛物线变化规律,在t=12.4 s处出现拐点,且50 s内转化率变化幅度只有0.2%。
综上所述,合金/水反应转化率主要受液滴直径dm、初速v0、喷嘴浸没深度h0、室温TH以及合金摩尔分数xa的影响。反应室工作初期,合金摩尔分数变化有限,液滴初始条件和室温是影响转化率的主要因素。
3.2 室内物质质量变化规律及分析
利用最小自由能法和室内物质质量计算模型重点对反应室内气相物质的质量变化规律进行仿真,计算结果如图6~9所示。
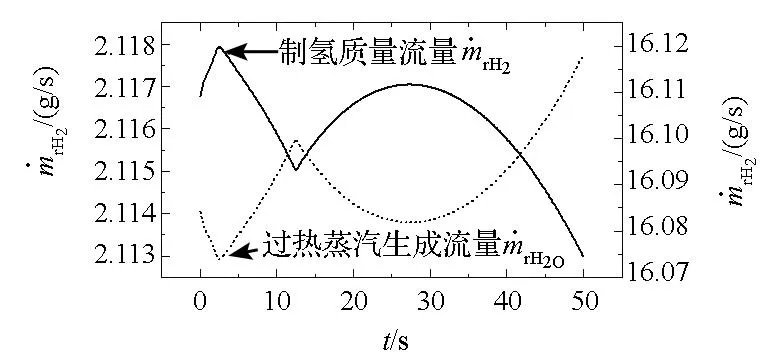
图6 室内气体生成质量流量变化曲线Fig.6 Mass flow variation of gas generation in reactor
图6给出了反应室内气体生成质量流量随时间的变化曲线,其中氢气全部由合金/水反应产生,而过热蒸汽绝大部分来自反应水蒸发。反应产生的过热蒸汽数量级只有10-9,且反应产生的过热蒸汽质量流量变化规律与氢气的相同,可见,反应生成的各物质质量流量变化规律由转化率决定。图6中,生成的氢气和过热蒸汽质量流量变化规律相反,原因在于两者的产生机理不同:同一时刻部分反应水参与反应生成氢气,而另一部分反应水则参与蒸发生成过热蒸汽,当反应水质量流量一定时,生成的氢气和过热蒸汽质量流量变化规律必然相反。
图7给出了反应室内氢气和过热蒸汽摩尔百分比随时间的变化,由图7知,氢气初始摩尔百分比为1,这是由于合金/水反应之前启动剂首先反应产生2.68 g氢气的原因;启动阶段不产生过热蒸汽,其初始摩尔百分比为0。随着合金/水反应的进行,根据反应转化率每时刻生成的氢气和过热蒸汽摩尔百分比近似为0.54 ∶0.46,致使室内氢气摩尔百分比不断减小,而过热蒸汽摩尔百分比不断增加,两者摩尔百分比最终近似稳定在0.54 ∶0.46。

图7 室内气体摩尔百分比变化曲线Fig.7 Molar percentage variation of gas in reactor
图8给出了反应室内氢气质量变化曲线。合金/水反应初始阶段(0~2.3 s),室内压力较低,连接制氢反应室与氢氧燃烧室的管道处于关闭状态,氢气出流质量流量为零,此时室内氢气质量不断积聚,并在t=2.7 s时取得最大值mirH2=7.58g;尔后,管道打开氢气出流质量流量不断增加,室内氢气质量不断减小并最终近似稳定在mirH2=5.67 g。需要说明的是,图8中两曲线出现“尖峰”后回落的原因在于,启动阶段室内已含有的定量氢气使得室内氢气质量随着制氢反应的进行迅速增加出现“尖峰”,而后随着管道打开氢气出流质量流量大于制氢流量使得室内氢气质量不断减小,最终制氢流量与其出流流量达到动态平衡,室内氢气质量趋于稳定。
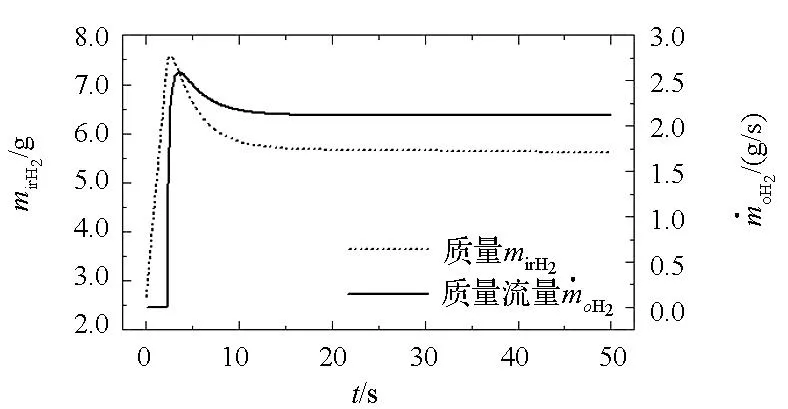
图8 室内氢气质量变化曲线Fig.8 Mass variation of hydrogen in reactor
图9给出了反应室内过热蒸汽质量变化曲线,其与室内氢气质量变化曲线不同的根本原因在于室内过热蒸汽摩尔百分比变化规律与氢气相反,且0~10.1 s时间段内室内过热蒸汽摩尔百分比均小于其稳定值0.46,致使t=2.3 s管道打开时室内过热蒸汽质量并没有达到最大值,而是在t=10.1 s时取得最大值,此时过热蒸汽生成流量与其出流流量达到动态平衡,室内氢气质量趋于稳定。图9中过热蒸汽出流质量流量有相同变化规律,此处不予赘述。
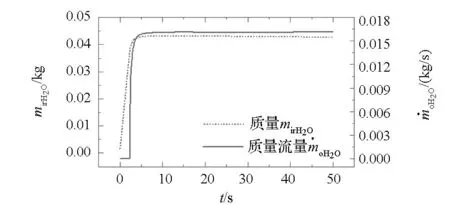
图9 室内过热蒸汽质量变化曲线Fig.9 Mass variation of superheated steam in reactor
由分析知,室内气相质量参数变化曲线反映了对应参数的变化规律,进而验证了室内物质质量计算模型建立和仿真的正确性。
3.3 室内热力参数计算结果及分析
利用螺旋管动态模型和室内能量释放特性模型对反应室各热力参数变化规律进行仿真,计算结果如图10~13所示。
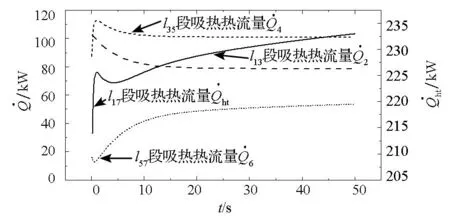
图10 螺旋管吸热热流量变化曲线Fig.10 Endothermic heat flow variation of helical tube
图10给出了螺旋管各段及其总吸热热流量随时间的变化曲线。当制氢反应室采用平均温度模型时,螺旋管各段吸热热流量与其长度密切相关。由图11知,螺旋管稳定工作时,各段吸热热流量从大到小依次是蒸发段、热水段和微过热段。蒸发段为气液两相沸腾换热段,换热系数最大致使其吸热热流量最大,而微过热段管内工质温度最高,其吸热热流量最小。螺旋管总吸热热流量为各段吸热热流量之和,在入口工质流量不变的情况下其随室内温度TH的增大而逐步增加。
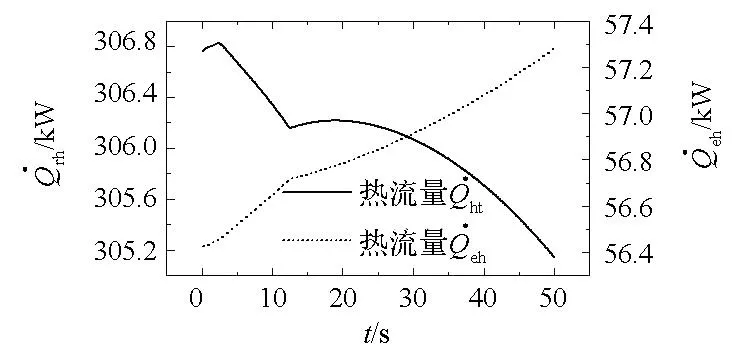
图11 室内反应放热热流量变化曲线Fig.11 Heat flow variation of reaction in reactor
图11给出了室内反应放热热流量以及反应水蒸发吸热热流量变化曲线。由图11知,反应放热热流量曲线与制氢质量流量曲线的变化规律基本一致,反应水蒸发吸热热流量曲线与过热蒸汽生成质量流量曲线的变化规律基本一致,由此可知,合金/水反应转化率决定了反应室的物质质量变化规律及其能量释放特性。需要说明的是,图中热流量变化曲线各段斜率相对质量流量曲线有所变化,其原因在于室内温度的改变:反应放热热流量随室温的升高而减小,而蒸发吸热热流量将随室温的升高而增大。结合图10中螺旋管的总吸热热流量和图9中室内反应水蒸发吸热热流量可知,螺旋管吸热是水下制氢反应室冷却的主要途径。

图12 室内平均温度变化曲线Fig.12 Mean temperature variation of reactor

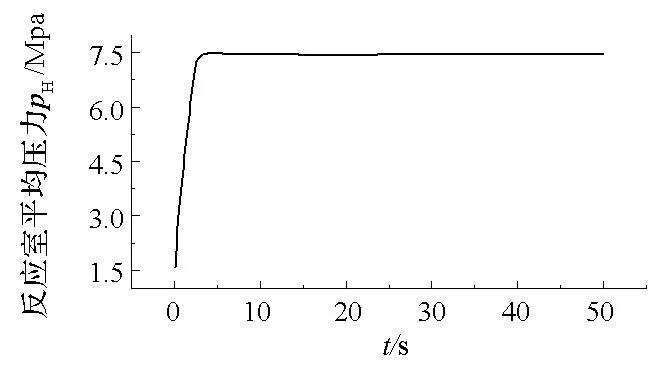
图13 室内平均压力变化曲线Fig.13 Mean pressure variation of reactor
图13给出了反应室压力随时间的变化曲线。文中采用SHBWR状态方程计算室内压力pH的具体值,此处采用理想气体状态方程pH=migRgigTH/Vig分析其变化趋势。Vig为定值,pH主要受mig和TH的影响。初始阶段,mig,TH均迅速增加致使压力pH快速升高,而后pH随着TH的缓慢上升和mig的逐步稳定而极其缓慢地上升。
由分析知,室内热力参数变化曲线反映了对应参数的变化规律,进而验证了室内能量释放特性模型建立和仿真的正确性。
4结论
通过合理假设和严密数学推导建立了富铝合金/水反应制氢反应室动态过程数学模型,从而使得室内制氢动态过程各参数可解。并结合案例进行了仿真与分析,可得如下结论:
1)反应室制氢动态过程中各参数的仿真结果较好地反映了对应参数的变化规律。文中建立的数学模型可作为水下熔融态富铝合金/水反应制氢反应室动态过程数值分析的一种方法;
2)熔融态富铝合金/水反应的转化率决定了反应室的物质质量变化规律及其能量释放特性;
3)相比于反应水蒸发吸热,螺旋管吸热是水下制氢反应室冷却的主要途径。
参考文献(References)
[1]Franzoni F, Milani M, Montorsi L,et al.Combined hydrogen production and power generation from aluminum combustion
with water:analysis of the concept[J]. International Journal of Hydrogen Energy,2010,35(4):1548-1559.
[2]Soler L, Macanas J, Munoz M,et al.Aluminum and aluminum alloys as sources of hydrogen for fuel cell applications[J].Journal of Power Sources,2007,169(1):144-149.
[3]Watanable M,Jiang X M,Saito R.Method for generating hydrogen gas utilizing activated aluminum fine particles: USA[P]. US200501197782, 2005-08-04.
[4]Dupiano P,Stamatis D,Dreizin E L.Hydrogen production by reacting water with mechanically milled composite aluminum-metal oxide powders[J].International Journal of Hydrogen Energy,2011,36(8):4781-4791.
[5]Woodall J M,Allen C R,Ziebarth J T.Power generation from solid aluminum: USA[P]. US20070850457, 2007-09-05.
[6]Dai H B, Ma G L, Xia H J, et al.Reaction of aluminium with alkaline sodium stannate solution as a controlled source of hydrogen[J].Energy and Environment Science,2011,4(6):2206-2212.
[7]Kravchenko O V,Semenenko K N,Bulychev B M,et al.Activation of aluminum metal and its reaction with water[J].Journal of Alloys and Compounds,2005,397(1-2):58-62.
[8]Fan M Q, Xu F, Sun L X.Hydrogen generation by hydrolysis reaction of ball-milled Al-Bi alloys[J].Energy and Fuels,2007,21(4):2294-2298.
[9]Woodall J M, Allen C R, Ziebarth J T.Power generation from solid aluminum: USA[P]. US201113311674, 2011-12-06.
[10]李杨,杨卫娟,周俊虎,等.铝锂/镁合金与H2O反应的热力学分析[J].能源工程,2014,(2):7-11.
LI Yang,YANG Weijuan,ZHOU Junhu,et al. Thermodynamic analysis on the reactions of high aluminum-magnesium/lithium alloy with H2O[J].Energy Engineering,2014,(2):7-11.(in Chinese)
[11]姚汝亮,张炜,周星,等.提高水反应金属燃料能量性能的理论分析[J].推进技术,2012,33(4):645-649.
YAO Ruliang, ZHANG Wei, ZHOU Xing,et al. Theoretical analysis on performance of hydro-reactive metal-based fuel[J].Journal of Propulsion Technology,2012,33(4):645-649.(in Chinese)
[12]李海鹏,黄晓津,张良驹.螺旋管式直流蒸汽发生器的集总参数动态模型[J].原子能科学技术,2008,42(8):729-733.
LI Haipeng,HUANG Xiaojing,ZHANG Liangju. Lumped parameter dynamic model of helical coiled once-through steam generator[J]. Atomic Energy Science and Technology,2008,42(8):729-733.(in Chinese)
[13]邢宝玉,程谋森,黄敏超,等.热推力器层板换热芯流固耦合传热与流动仿真[J].国防科技大学学报,2013,35(4):20-25.
XING Baoyu,CHENG Mousen,HUANG Minchao,et al. Fluid-solid coupled heat transfer and flow simulation of platelet heat exchanger in thermal thruster[J].Journal of National University of Defense Technology,2013,35(4):20-25.(in Chinese)
[14]朱灵峰,杜磊,李新宝,等.生物质合成甲醇的热力学性质研究[J].太阳能学报,2009,30(2):256-260.
ZHU Lingfeng,DU Lei,LI Xinbao,et al. Thermodynamic investigation of methanol synthesis from biomass[J]. Acta Energiae Solaris Sinica,2009,30(2):256-260.(in Chinese)
[15]Zhang F F,Zhang Z S,Liu J.Calculation model and application research of molar formation enthalpy for real gas[J].Advanced Materials Research,2014:850-851,889-892.
http://journal.nudt.edu.cn
Numerical analysis on dynamic process of underwater hydrogen generation reactor
ZHANGFangfang1,ZHANGZhenshan1,WANGJinzhong2
(1.Department of Weaponry Engineering, Naval University of Engineering, Wuhan 430033, China;
2. Office of Navy Representative Stationed in Factory 874, Houma 043000, China)
Abstract:To study the dynamic characteristics of hydrogen generation reactor, the reaction conversion rate of alloy and water was calculated by chemical reaction dynamic and kinematic analysis of reaction drip, and the mass variation of each substance in reactor was described by the law of mass conservation based on whose molar value was got by the minimum Gibbs free energy method. Based on the law of conservation of energy and a nonlinear moving-boundary model of helical tube, the dynamic process model of this reactor was established. The dynamic process simulation of an underwater hydrogen generation reactor was realized by using the calculation program based on the dynamic model. Results show that the simulation curves can reflect the variation law of parameters during the dynamic process, which proves the validation of the modeling and simulation. The reaction conversion rate determines the variation law of mass and the characteristics of releasing energy in reactor. The established model can be used as the basic foundation for performance analysis and control study of underwater hydrogen generation reactor.
Key words:thermodynamics; underwater vehicle; Al-rich alloy; hydrogen generation reactor; dynamic process; numerical analysis
中图分类号:TK16
文献标志码:A
文章编号:1001-2486(2015)06-155-07
作者简介:张方方(1987—),男,河南南阳人,博士研究生,E-mail:fangbrave@163.com;张振山(通信作者),男,教授,硕士,博士生导师,E-mail:hgzzs@sina.com
基金项目:国家安全重大基础研究资助项目(613188030103)
收稿日期:*2015-01-08
doi:10.11887/j.cn.201506028

