以阳性、阴性症状为主的精神分裂症血清蛋白因子差异☆
李明曾勇陈鹏熊鹏黄晓江徐飞王继才李娜
·论 著·
以阳性、阴性症状为主的精神分裂症血清蛋白因子差异☆
李明*曾勇*陈鹏*熊鹏*黄晓江*徐飞*王继才*李娜*
目的探讨以阳性、阴性症状为主的精神分裂症患者血清蛋白因子浓度变化,及其与精神病性症状之间的关系。方法采用酶联免疫吸附技术(enzyme-linked immunosorbent assay,ELISA)测定46例阳性症状为主的精神分裂症患者、37例阴性症状为主的精神分裂患者和60名正常对照者血清中神经生长因子-β(nerve growth factor-β,NGF-β)、白介素-1β(interleukin-1β,IL-1β)和髓鞘碱性蛋白(myelin basic protein,MBP)的水平,使用阳性与阴性症状量表(positive and negative syndrome scale,PANSS)评估患者精神病性症状。结果阳性症状为主的患者组和阴性症状为主的患者组NGF-β浓度低于对照组[(21.25±8.65)ng/L vs.(18.73±5.95)ng/L vs.(44.93±9.77)ng/L],而IL-1β[(61.55±21.08)ng/L vs.(79.33±25.68)ng/L vs.(24.77±8.09)ng/L]和MBP[(45.95±27.99)μg/L vs.(60.37±29.82)μg/L vs.(2.32±0.71)μg/L]浓度高于对照组,差异有统计学意义(P<0.01)。阳性症状为主的患者组IL-1β、MBP浓度低于阴性症状为主的患者组,差异有统计学意义(P<0.05)。阴性症状为主的患者组血清蛋白IL-1β(r=0.769,P<0.001)、MBP(r=0.499,P=0.002)浓度与阴性症状分呈正相关。结论阴性症状为主与阳性症状为主的精神分裂症可能有着不同的病理学机制。
精神分裂症 阳性症状 阴性症状 血清蛋白因子
☆ 国家自然科学基金(编号:81360210)
1 对象与方法
1.1 研究对象为昆明医科大学第一附属医院精神科2013年1月至2014年9月住院及门诊就诊的未经治疗精神分裂症患者。纳入标准:①符合《国际疾病与相关健康问题统计分类》(International Statistical Classification of Diseases and Related Health Problems,ICD-10)精神分裂症的诊断标准;②阳性与阴性症状量表(positive and negative syn⁃drome scale,PANSS)总分≥60分;③首次发病,未经抗精神病药物治疗;④无电休克治疗史。排除标准:①有精神发育迟滞、癫痫、脑炎等脑器质性疾病或其他神经系统疾病史者;②有免疫、内分泌或代谢障碍等系统性疾病的患者;③有药物或精神活性物质滥用史者;④具有明显自杀、危害自身或他人风险者。以阳性症状为主的患者组分组条件:①PANSS总分≥70分;②PANSS量表中P1-妄想、P3-幻觉行为、P6-猜疑/被害、G9-不寻常思维内容等4项条目中至少2项评分>4分(中度)[9]。以阴性症状为主的患者组分组条件:①PANSS量表中与阴性症状和瓦解思维/认知相关的14项条目(P2、N1~6、G5、G7、G10、G11、G13、G15、G16)总分>40分;②与阳性症状相关的8项条目(P1、P3、P5、P6、N7、G1、G9、G12)总分<22分,并且P1、P3、P6、G9这4个条目中评分>4分的条目不超过2项,且4项条目评分均≤5分[10]。按照纳入与排除标准收集120例患者,根据上述分组条件,阳性症状为主的患者组46例,阴性症状为主的患者组37例。
对照组来自本院体检中心的健康体检者。入组标准:无现患精神疾病或病史,且无精神疾病家族史。排除标准同患者组。共招募60名对照。
所有被试者或其监护人(家属)均签署书面知情同意书。
1.2 研究方法
1.2.1 血清蛋白因子浓度检测 患者于入组当日或次日清晨,用非抗凝管取空腹肘静脉血约5 mL,血样静置后以3000 r/min离心10 min,取血清分装,置于-80℃储存待检;对照入组时同法采血、分装、储存。采用酶联免疫吸附技术(enzyme linked immunosorbent assay,ELISA),用美国Merck Milli⁃pore公司生产的试剂盒及其配套试剂检测NGF-β、IL-1β和MBP等3种血清蛋白因子浓度。每份血清都进行双份检测,结果取其平均值。
1.2.2 PANSS量表评估 采用PANSS量表评估精神分裂症患者的精神病性症状,由经过量表培训并达到合格要求的精神科医师对患者进行精神检查,并结合家属提供的有关信息进行评价打分。
1.3 统计学方法采用SPSS 19.0进行统计分析,阳性症状为主的患者组、阴性症状为主的患者组与对照组间性别比较采用χ2检验,年龄、体质指数、血清蛋白因子浓度比较采用方差分析,两两比较采用LSD法。两患者组的病程及PANSS评分比较分别采用秩和检验和独立样本t检验。患者组血清蛋白因子浓度与PANSS评分的关系采用Pearson相关分析。检验水准α为0.05,双侧检验。
2 结果
2.1 患者组与对照组的社会人口学资料阳性症状为主的患者组、阴性症状为主的患者组和对照组三组间性别(χ2=0.795,P=0.672)和体质指数(F= 0.069,P=0.933)均无统计学差异,而年龄的差异具有统计学意义(F=12.971,P<0.001)。见表1。
2.2 患者组病程及PANSS评分两患者组间病程(Z=-3.419,P=0.001)、PANSS总分(t=2.786,P= 0.007)、阳性症状分(t=10.632,P<0.001)、阴性症状分(t=-4.492,P<0.001)的差异均具有统计学意义,而一般症状分无统计学差异(t=1.820,P=0.073)。见表1。
2.3 患者组与对照组血清蛋白NGF-β、IL-1β、MBP水平三组NGF-β水平差异有统计学意义(F=146.529,P<0.001),两两比较,对照组高于阳性症状为主的患者组(P<0.001)和阴性症状为主的患者组(P<0.001),而阳性症状为主与阴性症状为主的患者组间差异无统计学意义(P=0.186);三组IL-1β水平差异有统计学意义(F=111.835,P<0.001),其中,对照组低于阳性症状为主的患者组(P<0.001)和阴性症状为主的患者组(P<0.001),并且阳性症状为主的患者组浓度低于阴性症状为主的患者组(P=0.003);三组MBP水平差异有统计学意义(F=95.198,P<0.001),其中,对照组低于阳性症状为主的患者组(P<0.001)和阴性症状为主的患者组(P<0.001),并且阳性症状为主的患者组MBP浓度低于阴性症状为主的患者组(P= 0.003)。见表2。
2.4 患者血清蛋白因子水平与PANSS评分的相关性 阴性症状为主的患者组血清蛋白IL-1β(r= 0.769,P<0.001)、MBP浓度(r=0.499,P=0.002)与PANSS阴性症状评分呈正相关,但是与阳性症状评分和总分无统计学相关性(P>0.05);阳性症状为主的患者组血清蛋白IL-1β、NGF-β浓度与PANSS阳性症状、阴性症状和总分无统计学相关性(P>0.05),阳性症状为主的患者组血清蛋白MBP浓度与PANSS阳性分呈弱相关(r=-0.340,P=0.032)。见表3。
3 讨论
本研究纳入未经治疗的精神分裂症患者与正常对照,从神经营养、神经免疫和神经损害三方面分别选择具有代表性的3个蛋白因子作为检测对象[3,11-13],结果显示,患者组中血清IL-1β、MBP浓度明显高于对照组,而患者组血清NGF-β浓度低于对照组,与既往的研究结果相一致[4,12]。根据PANSS量表评分将精神分裂症的患者分为以阳性症状为主的患者组和以阴性症状为主的患者组,血清蛋白因子浓度的比较发现,以阳性症状为主的患者组血清IL-1β和MBP浓度低于以阴性症状为主的患者组,而NGF-β在两组间无统计学差异,说明在神经免疫和神经受损方面,阴性症状为主的患者组程度更严重。进一步相关分析表明,阴性症状为主的患者血清蛋白IL-1β、MBP浓度与PANSS阴性症状评分呈正相关,提示阴性症状的病理基础与可能神经细胞炎性反应以及神经细胞损伤有关[14]。
表1 患者组与对照组社会人口学与临床资料(±s)
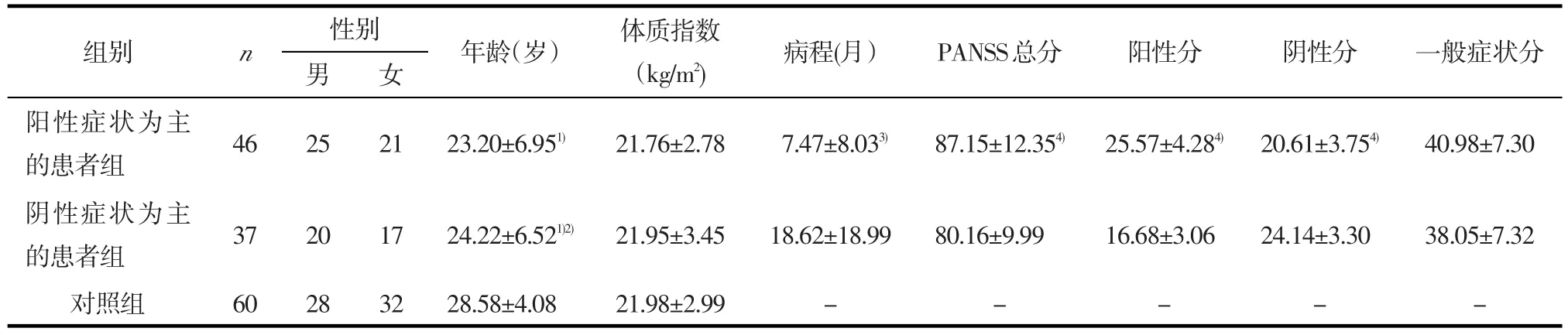
表1 患者组与对照组社会人口学与临床资料(±s)
1)与对照组比较,经LSD-t检验,P>0.05;2)与阴性症状为主的患者组比较,经LSD-t检验,P>0.05;3)与阴性症状为主的患者组比较,经秩和检验,P<0.05;4)与阴性症状为主的患者组比较,经独立样本t检验,P<0.01
组别阳性症状为主的患者组阴性症状为主的患者组对照组n 女 年龄(岁) 体质指数(kg/m2)病程(月)PANSS总分 阳性分 阴性分 一般症状分46性别男252123.20±6.951)21.76±2.787.47±8.033)87.15±12.354)25.57±4.284)20.61±3.754)40.98±7.30 37 60 20 28 17 32 24.22±6.521)2)28.58±4.08 21.95±3.45 21.98±2.99 18.62±18.99 -80.16±9.99 -16.68±3.06 -24.14±3.30 -38.05±7.32 -
表2 患者组与对照组血清蛋白因子水平(±s)

表2 患者组与对照组血清蛋白因子水平(±s)
1)与对照组比较,经LSD-t检验,P<0.05;2)与阴性症状为主的患者组比较,经LSD-t检验,P<0.05
组别阳性症状为主的患者组阴性症状为主的患者组对照组n 46 37 60 NGF-β(ng/L)21.25±8.651)18.73±5.951)44.93±9.77 IL-1β(ng/L)61.55±21.081)2)79.33±25.681)24.77±8.09 MBP(μg/L)45.95±27.991)2)60.37±29.821)2.32±0.71
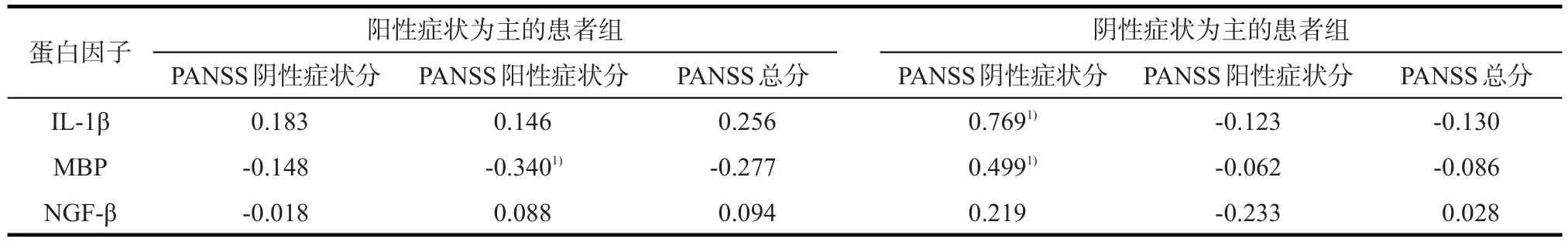
表3 精神分裂症患者血清蛋白因子与PANSS评分的相关性(r)
Liu等[15]发现二甲胺四环素可以改善精神分裂症患者的阴性症状和注意力下降,但对阳性症状没有改善作用,这是因为二甲胺四环素抑制小胶质细胞的活性,从而减少IL-1β的表达,进而改善患者的阴性症状,这提示患者的阴性症状与IL-1β可能存在内在联系。本研究结果也得到阴性症状为主的患者血清IL-1β浓度与PANSS量表的阴性症状评分呈正相关,与Liu等[15]的研究结果相一致。Parikh等[16]发现首发及治疗后的慢性精神分裂症患者血清NGF水平与PANSS阴性症状分呈负相关。但是本研究在两组患者中并没有得到与之相同的结果,这也许是因为本研究的对象为首次发病未经治疗的患者,患病初期神经营养的供给并没有明显不足,另外也可能和本研究样本量较少有关。MBP为神经系统受损的标记蛋白[16],既往研究证实慢性精神分裂症患者血清MBP浓度较高,这也许是慢性患者阴性症状持续存在的原因之一。
本研究提示,未经治疗的精神分裂症患者中,以阴性症状为主的患者相较于以阳性症状为主的患者具有更高的IL-1β、MBP浓度,并且两者浓度均高于对照组,提示精神分裂症的不同临床表现可能有不同的病理学基础。这至少可以部分解释临床上阴性症状为主的患者使用抗精神病药物疗效不佳的原因。以后的研究需要通过增加样本量,对患者进行药物干预,观察药物治疗过程中血清蛋白浓度的变化,以及加入患者影像学资料等,探索与精神分裂症疗效和影像学变化相关的蛋白因子改变,为病理学研究提供易于获取且可靠的研究证据,进而对患者的临床治疗以及预后提供更好的指导。
[1]Martinotti G,Di Iorio G,Marini S.Nerve growth factor and brain-derived neurotrophic factor concentrations in schizophre⁃nia:a review[J].J Biol Regul Homeost Agents,2012,26(3): 347-356.
[2]Arolt V,Rothermundt M,Wandinger KP,et al.Decreased in vi⁃tro production of interferon-gamma and interleukin-2 in whole blood of patients with schizophrenia during treatment[J].Mol Psychiatry,2000,5(2):150-158.
[3]唐济生,杜蘅.精神分裂症细胞因子及细胞因子网络的研究进展[J].中国神经精神疾病杂志,2002,28(5):附2-附4.
[4]Xiong P,Zeng Y,Wan J,et al.The role of NGF and IL-2 serum level in assisting the diagnosis in first episode schizophrenia[J]. Psychiatry Res,2011,189(1):72-76.
[5]Harris LW,Pietsch S,Cheng TM,et al.Comparison of peripher⁃al and central schizophrenia biomarker profiles[J].PLoS One, 2012,7(10):e46368.
[6]Green MJ,Matheson SL,Shepherd A,et al.Brain-derived neu⁃rotrophic factor levels in schizophrenia:a systematic review with meta-analysis[J].Mol Psychiatry,2011,16(9):960-972.
[7]熊鹏,吴秋霞,王继才,等.精神分裂症患者血清GFAP与MBP水平的变化[J].中国神经精神疾病杂志,2013,39(1):44-47.
[8]Fan Y,Abrahamsen G,Mcgrath JJ,et al.Altered cell cycle dy⁃namicsin schizophrenia[J].BiolPsychiatry,2012,71(2): 129-235.
[9]佚名.临床研究方案:方案编号WN25305 RO4917838 EU⁃DRACT NUMBER 2010-020718-26[A].豪夫迈-罗氏有限公司,2012.
[10]佚名.临床研究方案:方案编号WN25308 RO4917838 EU⁃DRACT编号2010-020470-42[A].豪夫迈-罗氏有限公司, 2012.
[11]宋学勤,陈旭梅,张伟,等.脂联素及白细胞介素-1β等细胞因子在首发未用药精神分裂症患者中的作用[J].中华医学杂志,2013,93(41):3256-3260.
[12]Kale A,Joshi S,Pillai A,et al.Reduced cerebrospinal fluid and plasma nerve growth factor in drug-naïve psychotic patients[J]. Schizophr Res,2009,115(2-3):209-214.
[13]Lang UE,Jockers-Scherubl MC,Hellweg R.State of the art of the neurotrophin hypothesis in psychiatric disorders:implica⁃tionsand limitations[J].J.NeuralTransm,2004,111(3): 387-411.
[14]Stojanovic A,Martorell L,Montalvo I,et al.Increased serum in⁃terleukin-6 levels in early stages of psychosis:associations with at-risk mental states and the severity of psychotic symptoms[J]. Psychoneuroendocrinology,2014,41:23-32.
[15]Liu F,Guo X,Wu R,et al.Minocycline supplementation for treatment of negative symptoms in early-phase schizophrenia:A double blind,randomized,controlled trial[J].Schizophrenia Res, 2014,153(1-3):169-176.
[16]Parikh V,Evans DR,Khan MM,et al.Nerve growth factor in never-medicated first-episode psychotic and medicated chronic schizophrenic patients:possible implications for treatment out⁃come[J].Schizophrenia Res,2003,60(2-3):117-123.
[17]彭代辉,江开达.胶质细胞与重性精神疾病相关研究[J].国际精神病学杂,2005,32(3):177-180.
(责任编辑:肖雅妮)
R749.3
A
10.3969/j.issn.1002-0152.2015.07.010
2015-02-27)
精神分裂症症状复杂多样,临床上常见以阳性症状为主和以阴性症状为主两种类型。许多研究表明精神分裂症患者血清蛋白因子的变化与临床症状存在很大关联性[1-3]。我们之前的研究也表明,通过检测外周血蛋白因子的方法来帮助诊断、评估精神分裂症是可行的[4]。既往的研究已经证实精神分裂症患者存在神经营养、免疫和神经损伤等异常,血清蛋白因子与临床症状之间具有相关性[5-6],并且之前我们的研究发现神经生长因子(nerve growth factor,NGF)、白介素(interleukin,IL)和髓鞘碱性蛋白(myelin basic protein,MBP)的浓度在精神分裂症患者外周血中存在异常[4,7],3种蛋白因子分别与神经营养、神经免疫和神经损伤相关。
* 昆明医科大学第一附属医院精神科(昆明 650032)

