火针对急性脊髓损伤24 h后ERK通路基因的影响*
徐家淳,程素利,王剑歌,焦召华,王 凯,蔡志敏,李 岩△,周 震,陆 军,刘保红,周智梁
(1.天津中医药大学,天津300193;2.天津市公安医院,天津300042; 3.天津中医药大学第二附属医院,天津300150)
实验研究
火针对急性脊髓损伤24 h后ERK通路基因的影响*
徐家淳1,程素利1,王剑歌1,焦召华2,王 凯3,蔡志敏1,李 岩2△,周 震3,陆 军2,刘保红2,周智梁3
(1.天津中医药大学,天津300193;2.天津市公安医院,天津300042; 3.天津中医药大学第二附属医院,天津300150)
目的:观察火针对急性脊髓损伤24 h后ERK通路上相关基因的调控作用。方法:将40只SD雌性大鼠随机分为空白组、假手术组、模型组及火针治疗组,采用改良的Allen’s法对模型组和火针组造模,造模前后进行Basso Beattie Bresnahan(BBB)功能评分。造模24 h后取各组大鼠损伤段脊髓,通过RT-PCR技术检测ERK通路上基因表达。结果:模型组和火针组造模后BBB评分皆为0.00± 0.00,造模成功。RT-PCR检测显示脊髓损伤24 h后模型组ERK通路Ras、ERK1和ERK2基因表达较空白组和假手术组明显增多(P<0.05),且火针组ERK通路基因表达较模型组明显减少(P<0.05)。结论:ERK通路参与脊髓损伤,且火针可抑制急性脊髓损伤24 h后ERK通路上相关基因的表达。
火针;脊髓损伤;ERK通路;增殖;基因
脊髓损伤(Spinal cord injury,SCI)是一种神经细胞轴突破坏所致的严重神经损伤疾病,可导致损伤节段以下肢体的功能障碍,分为原发性损伤和继发性损伤。前者由外力产生,损伤不可逆;后者由原发性损伤启动的一系列复杂过程造成脊髓损害进一步加重,其损害有时甚至超过原发性损伤,发病率较高,目前缺乏良好的治疗措施,严重影响患者生活质量[1]。
脊髓损伤后的神经修复治疗近年来主要围绕在神经干细胞的增殖与分化方面[2],神经干细胞的增殖分化受细胞内外信号的调节。丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)是哺乳动物体内重要的信号转导通路之一,参与调控生物体内多种细胞应答和生理、病理过程[3],包括细胞的生长、增殖和分化。
细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)是MAPK家族的一个重要亚族,包括ERK1和ERK2,统称为ERK1/2。研究表明,ERK信号通路活化与大鼠脊髓损伤所致的脊髓神经退行性变和功能障碍相关[4],且ERK1/2抑制剂可明显减轻脊髓继发性损伤,改善大鼠的神经功能[5]。本课题组通过火针干预急性脊髓损伤大鼠,观察火针对脊髓损伤24 h后ERK通路的调控作用,为火针临床治疗急性脊髓损伤提供依据。
1 材料与方法
1.1 动物
雌性SD大鼠40只(2月龄),体重260 g左右,由中国食品药品检定研究所提供,许可证号:SCXK(京) 2009-0017。
1.2 仪器
PCR扩增仪(德国Eppendorf公司),荧光定量PCR仪Rotor Gene 6000(美国Corbett公司),高速离心机(德国Eppendorf公司),冷冻高速离心机(德国Eppendorf公司),BioPhotometer plus(德国Eppendorf公司),超低温冰箱(日本SANYO公司),取液器(德国Eppendorf公司)
1.3 分组
将大鼠随机分为空白组、假手术组、脊髓损伤对照组(模型组)和火针治疗组(火针组),每组各10只大鼠。
1.4 动物模型制备
采用本课题组改良的Allen's法[6]对模型组和火针组大鼠建立急性脊髓损伤模型。
1.5 行为学评分
造模前后对各组大鼠双侧后肢进行Basso Beattie Bresnahan行为功能评分(BBB运动评分)[7]。
1.6 火针干预
评分后对火针治疗组脊髓损伤大鼠进行火针针刺1次。
1.6.1 选穴 参照中国针灸学会实验针灸分会制定的《动物针灸穴位图谱》及《实验针灸学》。在手术部位选取穴位:T7、T8及T11、T12棘突间隙旁的华佗夹脊穴。
1.6.2 操作方法 左手持酒精灯尽量接近针刺的部位;右手持针柄置火针于酒精灯外焰处加热针体至通红,施针于患处,每穴1针,进针约3~5 mm迅速出针,整个过程仅需要1/3 s。
1.7 取材与指标检测
各组大鼠在24 h后取材。
1.7.1 检测指标 ERK信号通路中Ras、ERK1和ERK2基因表达。
1.7.2 检测方法 提取总RNA:按照Trizol试剂盒(Gibco公司)说明提取总RNA,加DEPC水20 ul溶解。紫外分光光度计测量吸光度(A)值,A260/A280大于1.8,然后将在0.1 g琼脂糖凝胶电泳上显示,证实含有18 s和28 s两条带的标本用于反转录步骤。
反转录:校正每组总RNA浓度为1 ug/1 ul,每2 ugRNA加入Oligod(T)181 ul,72℃变性10 min,取出后立即臵于冰上2 min。后加入DEPC水11.5 ul+ 5Xbuffer2.5ul+dNTPMixture0.5ul+RNase0.5ul+MMLV0.5ul,在室温下静置10 min。42℃水浴1 h,冰上放置2 min。
荧光定量PCR:采用25 ul反应体系:分别加入MasterMix 12.5 μl、5μMForwardPrimer0.25 μl、5μMReversePrimer 0.25 μl、Template 2.5 μl和DeionizedWater 9.5 μl混匀(ForwardPrimer与ReversePrimer分别为IRE-1、PERK、ATF6、GADD153/CHOP、JNK、Caspase-12引物序列)。放入荧光定量PCR仪中,条件为95℃、10 min后;执行95℃、15 s,60℃、1 min,40cycles,以观察荧光定量熔解度。
1.8 统计方法
采用SPSS13.0软件进行检验,BBB评分数据以均数±标准差表示,各组RT-PCRΔCT值用单因素方差分析比较组间差异,表达水平比率以2-ΔΔCT表示,P<0.05表示差异具有显著性意义。
2 结果
各组大鼠造模前后BBB运动评分见表1。模型组及火针组大鼠造模后评分为0.00±0.00,造模成功。
表1 各组大鼠14天内BBB评分情况比较 (±s)
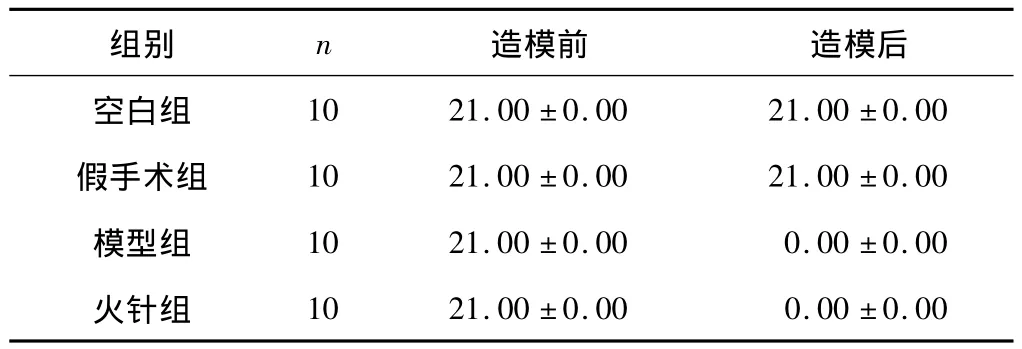
表1 各组大鼠14天内BBB评分情况比较 (±s)
组别 n 造模前 造模后空白组10 21.00±0.00 21.00±0.00假手术组 10 21.00±0.00 21.00±0.00模型组 10 21.00±0.00 0.00±0.00火针组10 21.00±0.00 0.00±0.00
RT-PCR检测结果显示脊髓损伤24 h后模型组ERK通路关键基因Ras、ERK1、ERK2表达量较空白组和假手术组明显增多(P<0.05),且火针组ERK通路基因表达较模型组明显减少(P<0.05)。见表2。
3 讨论
脊髓损伤(SCI)是以神经细胞轴突遭到破坏为主,表现为肢体运动瘫痪和感觉丧失的一种疾病,给患者和家属带来严重的身心伤害。神经干细胞的增殖和分化是近年来对脊髓损伤治疗的热点,是神经再生修复的关键。
神经干细胞增殖和分化受多种信号的调节,MAPK通路是一条重要的信号转导通路,能够将不同的胞外信号传导至细胞核,引起细胞生长、增殖和分化。作为MAPK的重要成员,ERK是膜受体信号向细胞内传递的重要途径,参与细胞生长发育和增殖分化等。信号传递步骤遵循MAPK的三级酶促级联反应: Ras作为上游激活蛋白,Raf作为MAPK,MAPK/ERK激酶(Mek)作为MAPK,ERK即MAPK。国内外研究皆发现,ERK信号通路活化与大鼠脊髓损伤所致的脊髓神经退行性变和功能障碍相关[4],而针灸已被证实可抑制ERK通路,减轻脊髓损伤引起的疼痛[8]。
近年来临床发现针灸对脊髓损伤所引起的疼痛[9]及其他并发症具有很大的改善作用,实验研究也发现了针灸对脊髓损伤的抗炎机制[10],且可促进神经细胞增殖[11],并通过ERK通路促进脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)的表达[12]。火针疗法为传统针灸疗法的一种,针具较一般针灸针稍粗,主要通过将烧红的针体刺入穴位达到治疗疾病的目的。相较于普通毫针,火针刺激量大,且同时具有温热的效果,对痹症、痤疮、妇科疾患都具有很好的疗效。研究表明火针可促进脊髓损伤大鼠神经干细胞增殖[13],减少大鼠白介素1β(IL-1β)、胱氨酸蛋白酶(Caspase-3)表达[14]。
本次研究发现,急性脊髓损伤24 h后,模型组大鼠Ras、ERK1/2表达量较空白组和假手术组明显增多,表明脊髓损伤后ERK通路被激活,ERK通路参与脊髓损伤;火针治疗24 h后Ras、ERK1/2表达量较模型组都有所减少,表明火针可抑制急性脊髓损伤24 h后ERK通路相关基因表达。笔者推测火针可能通过下调脊髓组织中ERK通路相关基因表达,促进神经干细胞增殖分化,修复脊髓神经损伤。本课题组在此仅明确了火针对急性脊髓损伤24 h后ERK通路的调控作用,但无法确定其长期效果,因此需要在后续的实验中加大样本量,设立多个时相以观察火针对脊髓损伤后ERK通路的远期调控作用,同时观察火针对脊髓损伤后肢体功能障碍的改善,为火针应用于临床建立实验基础。
[1]Williams R,Murray A.Prevalence of depression after spinal cord injury:a meta-analysis[J].Arch Phys Med Rehabil,2015,96(1): 133-140
[2]Lee-Kubli CA,Lu P.Induced pluripotent stem cell-derived neural stem cell therapies for spinal cord injury[J].Neural Regen Res,2015,10(1):10-16
[3]Nicaise C,Mitrecic D,Falnikar A,et al.Transplantation of stem cellderived astrocytes for the treatment of amyotrophic lateral sclerosis and spinal cord injury[J].World J Stem Cells,2015,7(2):380-398
[4]Yu CG,Yezierski RP,Joshi A,et al.Involvement of ERK2 in traumatic spinal cord injury[J].Journal of Neurochemistry,2010,113(1): 131-142
[5]Genovese T,Esposito E,Mazzon E,et al.Evidence for the role of mitogen-activated protein kinase signaling pathways in the development of spinal cord injury[J].J Pharmacol Exp Ther,2008,325(1):100-114
[6]孙立明,李岩,周震,等.火针对脊髓损伤模型大鼠凋亡相关蛋白表达的影响[J].针灸临床杂志,2010,26(12):49-53
[7]Scheff SW,Saucier DA,Cain ME.A statistical method for analyzing rating scale data:the BBB locomotor score[J].J neurotrauma,2002,19(10):1251-1260
[8]Choi DC,Lee JY,Lim EJ,et al.Inhibition of ROS-induced p38MAPK and ERK activation in microglia by acupuncture relieves neuropathic pain after spinal cord injury in rats[J].Experimental Neurology,2012,236(2):268-282
[9]Wang Y,Li Y.Acupuncture for 58 cases of central pain after spinal cord injury[J].Zhongguo Zhen Jiu,2014,34(1):88
[10]Lee JY,Choi DC,Oh TH,et al.Analgesic effect of acupuncture is mediated via inhibition of JNK activation in astrocytes after spinal cord injury[J].PLoS One,2013,8(9):e73948
[11]Yan Q,Ruan JW,Ding Y,et al.Electro-acupuncture promotes differentiation of mesenchymal stem cells,regeneration of nerve fibers and partial functional recovery after spinal cord injury[J].Exp Toxicol Pathol,2011,63(1-2):151-156
[12]Wenjin W,Wenchao L,Hao Z,et al.Electrical Stimulation Promotes BDNF Expression in Spinal Cord Neurons Through Ca2+and Erk-Dependent Signaling Pathways[J].Cellular and Molecular Neurobiology,2011,31(3):459-467
[13]李岩,周震,程素利,等.火针干预脊髓损伤大鼠后血清对神经干细胞增殖分化的影响[J].天津中医药,2013,30(1):25-27
[14]周震,李岩,倪虹,等.火针对脊髓损伤模型大鼠IL-1β、Caspase-3蛋白表达的影响[J].上海针灸杂志,2010,29(5):318-321
Influence of Fire Needle on Genes in ERK Signal Pathway 24 h after Acute Spinal Cord Injury
XU Jia-chun1,CHENG Su-li1,WANG Jian-ge1,JIAO Zhao-hua2,WANG Kai3,CAI Zhi-min1,LI Yan2△,ZHOU Zhen3,LU Jun2,LIU Bao-hong2,ZHOU Zhi-liang3
(1.Tianjin University of Traditional Chinese Medicine,Tianjin300193,China; 2.Tianjin Police Hospital,Tianjin300042,China;3.Second Affiliated Hospital of Tianjin University of TCM,Tianjin300150,China)
Objective:To explore the influence of fire needle on genes in ERK signal pathway 24 h after acute spinal cord injury(SCI).Methods:Forty SD female rats were randomized into a blank group,a sham operation group,a model group and a fire needle treatment group.Modified Allen’s method was applied to build acute SCI models,and Basso,Beattie and Bresnahan Scale Locomotor Assessment(BBB assessment)were used to assess the limb movement before and after modeling.Twenty-24 hours after modeling,Reverse Transcription-Polymerase Chain Reaction(RT-PCR)was performed to detect the expression of genes in ERK signal pathway.Results:BBB scores of rats in model and fire needle treatment groups were 0.00±0.00.Results of RTPCR showed a significant increase of Ras and ERK 1 and ERK2 in the model group compared with the blank and sham operation groups(P<0.05),and the expression in fire needle group was significantly less than that in the model group.Conclusion:ERK signal pathway is involved in SCI,and the fire needle could inhibit the expression of genes in ERK signal pathway.
Fire needle;SCI;ERK;Proliferation;Gene
R246.6
A
1005-0779(2015)010-0068-03
国家自然科学基金面上项目,编号:81373839;天津市应用基础及前沿技术研究计划重点项目,编号:13JCZDJC31800。
徐家淳(1989-),男,2015级中医内科学专业博士研究生。
△通讯作者:李岩(1970-),男,主任医师,研究方向:火针、刺络临床及实验研究。
2015-04-13

