幽门螺杆菌重组热休克蛋白60对U937细胞分泌TNF-α和IL-17的影响
张 珍,魏义花,杜镇镇,周秀芝(滨州医学院:.病原生物学实验室;.临床学院,山东 滨州56603)
幽门螺杆菌是引起人类胃炎、消化道溃疡及胃癌的重要病原体,是一种微需氧、弯曲状的革兰阴性杆菌[1]。幽门螺杆菌的致病能力与其菌体表面的热休克蛋白60(hsp60)密切相关[2],不同菌株的 hsp60氨基酸序列即GroEL蛋白相对保守、抗原性较强[3],主要通过刺激单核-巨噬细胞或胃上皮细胞释放 IL-1β、IL-8、TNF-α 等炎症细胞因子加剧病情的发展[4],但不同来源的幽门螺杆菌菌株及其hsp60对细胞因子分泌是否有差异鲜见报道。本实验通过基因定点突变、蛋白表达等技术获得了幽门螺杆菌标准株26695的hsp60(即非胃癌来源株)与胃癌来源株的重组热休克蛋白(rhsp60)[5],将不同浓度的2种蛋白与U937细胞共培养,在前期证实rhsp60可促进IL-6的分泌的基础上[6],观察其对U937细胞分泌TNF-α、IL-17的影响,旨在研究不同来源菌株的菌体成分感染与细胞因子表达水平的关系,进一步明确幽门螺杆菌的致病机制。
1 材料与方法
1.1 材料
1.1.1 菌种与细胞株 大肠杆菌BL21、幽门螺杆菌标准菌株ATCC26695、人髓系白血病细胞系U937细胞为本实验室保存。
1.1.2 试剂 rhsp60与hsp60蛋白(本实验室自制保存),RPMI-1640培养基、胎牛血清(Hyclone生物制品公司),TNF-α、IL-17 试剂盒(美国 RD 公司),佛波酯(PMA)(Sigma公司)。
1.1.3 仪器 生物安全柜(上海博迅实业公司),全自动高压灭菌器(日本三洋电器公司),倒置荧光显微镜IX70-142(日本奥林巴斯),全自动酶标仪、细胞培养箱(赛默飞世尔科技公司)。
1.2 方法
1.2.1 U937细胞的培养与PMA处理 将冻存的U937细胞用含10%胎牛血清的RPMI-1640培养基于37℃、5%CO2培养箱中常规培养传代,对数生长期时用预温的RPMI-1640洗2次,悬于含有10%胎牛血清的RPMI-1640培养基中,调整细胞浓度达每毫升1×109个,取浓度为1 μg/mL的PMA加入培养瓶中,使其终浓度为10 ng/mL,培养14 h以上换液,倒置显微镜下细胞由独立的、悬浮的小圆形变为成团的、贴壁的、形状不规则的细胞[7],继续培养24 h即可分化成巨噬细胞样细胞用于后续实验。
1.2.2 ELISA检测TNF-α和IL-17的分泌 取对数生长期已经分化的U937细胞用RPMI-1640培养12 h弃上清液,用RPMI-1640培养液重悬,调整细胞浓度为每毫升2×106个接种到24孔细胞培养板,分别加hsp60(hsp60 组)、rhsp60(rhsp60 组),最终浓度调整为 50、100、200 μg/mL,12、18、24 h 分别收集上清液保存待测,以加等体积磷酸盐缓冲液(PBS)的细胞培养组作为对照组。TNF-α、IL-17的检测严格按照说明书操作,酶标仪450 nm测定样品光密度(OD)值,ELISA标准品质量浓度为20~320 pg/mL,由绘制的标准曲线计算出样品中TNF-α、IL-17含量。以上实验,不同浓度均采用3个复孔。
1.3 统计学处理 应用SPSS12.0统计软件进行数据处理,计量资料以±s表示,采用 t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 rhsp60与hsp60刺激U937细胞后TNF-α的分泌不同浓度的rhsp60、hsp60与U937细胞共培养,在12、18、24 h测得两组TNF-α分泌量均明显高于对照组,且同时间点、同浓度下rhsp60组明显高于hsp60组,差异均有统计学意义(P<0.05)。见表 1。
表1 各组不同时间点细胞培养上清液中TNF-α水平比较(±s,pg/mL)
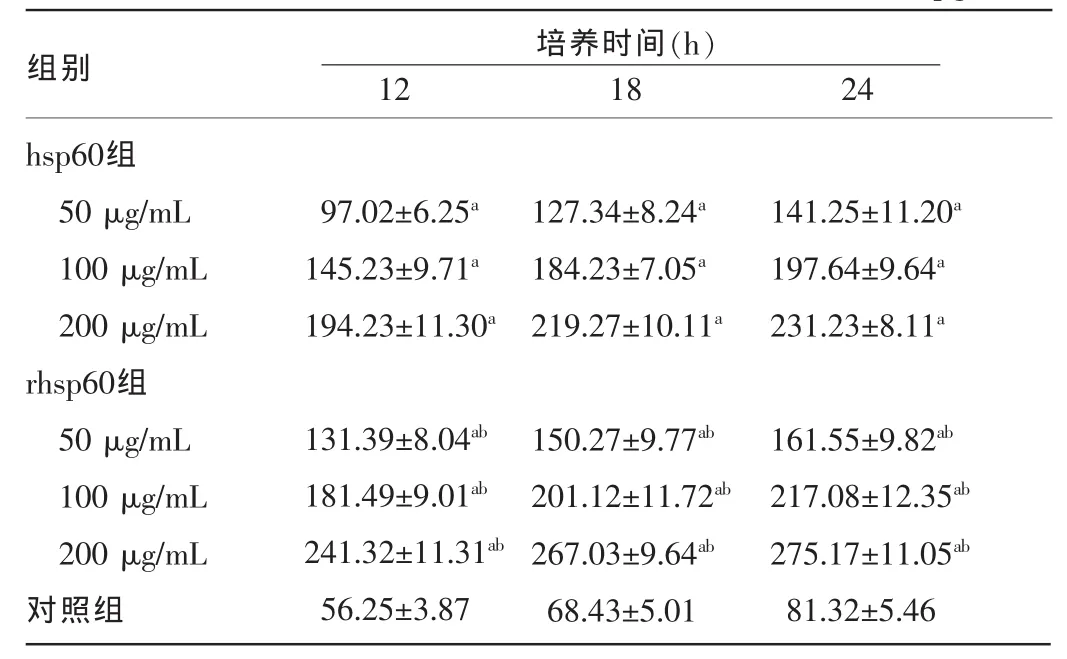
表1 各组不同时间点细胞培养上清液中TNF-α水平比较(±s,pg/mL)
注:与对照组同时间点比较,aP<0.05;与同浓度、同时间点hsp60组比较,bP<0.05。
组别hsp60组50 μg/mL 100 μg/mL 200 μg/mL rhsp60组50 μg/mL 100 μg/mL 200 μg/mL对照组培养时间(h)12 18 24 97.02±6.25a 145.23±9.71a 194.23±11.30a 131.39±8.04ab 181.49±9.01ab 241.32±11.31ab 56.25±3.87 127.34±8.24a 184.23±7.05a 219.27±10.11a 150.27±9.77ab 201.12±11.72ab 267.03±9.64ab 68.43±5.01 141.25±11.20a 197.64±9.64a 231.23±8.11a 161.55±9.82ab 217.08±12.35ab 275.17±11.05ab 81.32±5.46
2.2 rhsp60与hsp60刺激U937细胞后IL-17的分泌不同时间点两组IL-17分泌量均明显高于对照组,且同时间点、同浓度下rhsp60组高于hsp60组,差异均有统计学意义(P<0.05)。见表 2。
表2 各组不同时间点细胞培养上清液中IL-17水平比较(±s,pg/mL)
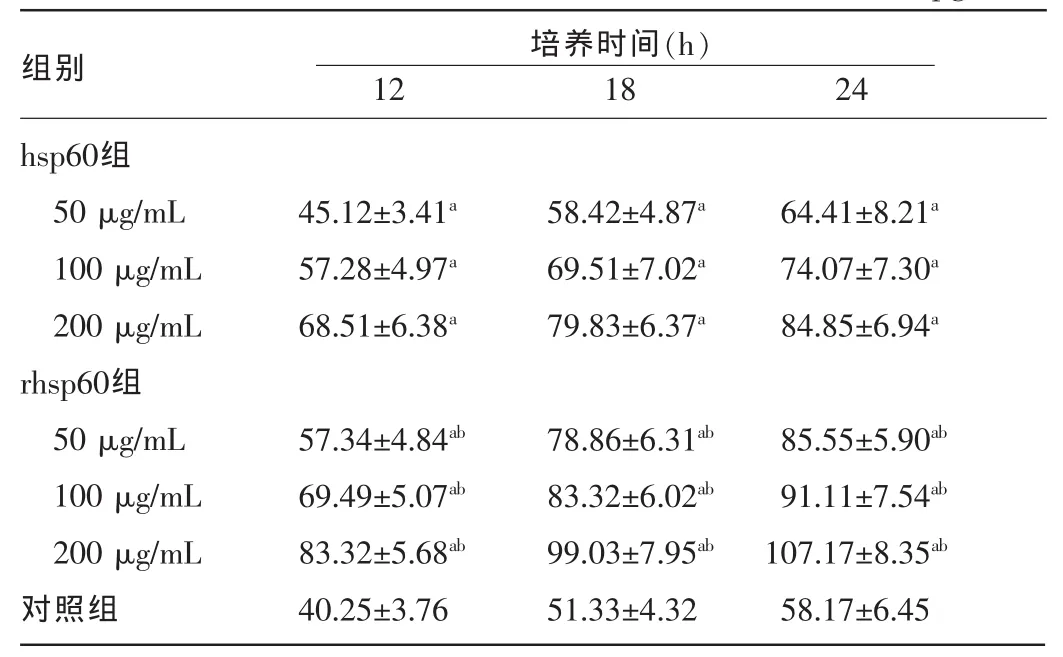
表2 各组不同时间点细胞培养上清液中IL-17水平比较(±s,pg/mL)
注:与对照组同时间点比较,aP<0.05;与同浓度、同时间点hsp60组比较,bP<0.05。
组别hsp60组50 μg/mL 100 μg/mL 200 μg/mL rhsp60组50 μg/mL 100 μg/mL 200 μg/mL对照组培养时间(h)12 18 24 45.12±3.41a 57.28±4.97a 68.51±6.38a 58.42±4.87a 69.51±7.02a 79.83±6.37a 64.41±8.21a 74.07±7.30a 84.85±6.94a 57.34±4.84ab 69.49±5.07ab 83.32±5.68ab 40.25±3.76 78.86±6.31ab 83.32±6.02ab 99.03±7.95ab 51.33±4.32 85.55±5.90ab 91.11±7.54ab 107.17±8.35ab 58.17±6.45
3 讨 论
前期通过对幽门螺杆菌胃癌来源与非胃癌来源菌株的热休克蛋白hsp60全基因序列比对,发现2类菌株的基因序列在1398、1399位点上存在差异[8],胃癌来源菌株为GC;非胃癌来源菌株为AG,与幽门螺杆菌标准株ATCC26695相同[9]。本实验通过定点突变、PCR等技术使基因序列的1398、1399位点由AG突变为GC,成功获得了胃癌来源突变株的重组rhsp60基因片段,其相应表达的编码蛋白467位点也由非胃癌来源株的谷氨酸变为胃癌来源株的谷氨酰胺,氨基酸的变化可能会引起空间结构改变进而影响到热休克蛋白的功能。在前期证实rhsp60可刺激U937分泌IL-6增多的基础上,本实验显示,rhsp60也可促进TNF-α、IL-17的分泌,与标准菌株的hsp60在同时间点、同浓度相比,存在显著差异,提示幽门螺杆菌热休克蛋白在促炎性细胞因子的分泌上可能存在菌株的差异,不同菌株具有不同的毒力及致病性。
病原菌感染机体后,一些炎症因子IL-6、IL-8、TNF-α、IL-1β等作为细胞间的信使分子,受到病原菌刺激后往往分泌增加,以较高的亲和力与相应的靶细胞表面受体结合,以增强抗感染效应促进炎症发展[10]。其中TNF-α主要由活化的单核巨噬细胞产生,具有介导炎性反应、参与免疫及内分泌调节等广泛的生物学作用;IL-17也是一种促进炎症发生的较重要的可溶性因子,能促进机体产生趋化因子使中性粒细胞、单核细胞迅速增多并刺激机体产生IL-1和前列腺素E2等,进一步增强局部炎症[11]。临床资料也证实,幽门螺杆菌是大多数胃炎、胃与十二指肠溃疡的病因,炎症的增强有诱发癌变的可能,进而导致严重后果[12]。因此,研究幽门螺杆菌不同的菌株或菌体成分在炎症发展中的作用,并明确炎症因子分泌的信号通路机制,有助于探讨新的治疗方法阻止炎症的发展与癌变以促进人类的健康。
[1]刘爱群,葛莲英.幽门螺旋杆菌感染与胃癌变相关基因研究进展[J].现代肿瘤医学,2010,18(9): 1860-1862.
[2]Lin CS,He PJ,Tsai NM,et al.A potential role for Helicobacter pylori heat shock protein 60 in gastric tumorigenesis[J].Biochem Biophys Res Commun,2010,392(2):183-189.
[3]王艳芳,张慧,王欢,等.幽门螺杆菌GroEL蛋白重组表达及表达产物小鼠免疫保护作用[J].中华微生物学和免疫学杂志,2012,32(4):340-345.
[4]马健,孟欣颖,王涛,等.慢性活动性胃炎患者血清IL-6、TGF-β1及IL-17的水平与幽门螺杆菌的关系及临床意义[J].中华临床医师杂志:电子版,2012,6(11):50-52.
[5]孙万菊,杜东龙,蒋宏,等.幽门螺杆菌热休克蛋白60基因的定点突变及其原核表达[J].中国病原生物学杂志,2013,8(8):695-697.
[6]孟玮,张珍,魏义花,等.热休克蛋白60及重组热休克蛋白60对U937细胞 IL-6 分泌量的影响[J].山东医药,2014,54(3):14-16.
[7]曹林林,杜珍武,杨麒巍,等.血清对U937细胞分化成熟及细胞周期的影响[J].中国实验诊断学,2014,18(8):1324-1327.
[8]李波清.胃癌相关幽门螺杆菌比较蛋白组学分析[D].北京:中国疾病预防控制中心,2005.
[9]孙万菊,杜东龙,孙辉,等.幽门螺杆菌临床分离株热休克蛋白60基因序列分析[J].中国病原生物学杂志,2014,9(3):230-235.
[10]张晓勇,艾梅芳.细胞免疫调节因子IL-8 IL-18与幽门螺杆菌感染关系的研究进展[J].中国当代医药,2014,21(14):186-188.
[11]李凡,刘晶星.医学微生物学[M].7版.北京:人民卫生出版社,2008:138-139.
[12]Marie MA.Relationship between Helicobacter pylori virulence genes and clinical outcomes in Saudi patients[J].J Korean Med Sci,2012,27(2):190-193.

