皮质下脑梗死所致血管性认知障碍患者认知功能与脑白质病变的相关性研究
周凯歌,吴雄枫,郑惠文,丁素菊,李海龙,黎佳思,毕晓莹(共同第一作者)
皮层下脑梗死所致认知障碍(subcortical vascular cognitive impairment,SVCI)是由皮层下多发性梗死或白质变性导致的认知损害,是血管性认知障碍(vascular cognitive impairment,VCI)最常见类型之一[1],以执行功能受损为其主要认知损害为主要表现,记忆力相对保留,但有学者认为SVCI亦可以出现记忆力损害[2]。
为探究SVCI认知损害的特征及其与白质变性的相关性。本研究采用蒙特利尔认知评估(Montreal Cognitive Assessment,MOCA)量表对皮层下脑梗死患者进行认知评估,筛选出SVCI患者,并利用连续改良版本的Scheltens量表[3]对SVCI患者白质变性程度进行评估,探究SVCI患者的认知功能、白质损害特征及二者的相关性。
1 对象与方法
1.1 研究对象及分组 连续入组2012年12月~2014年2月第二军医大学长海医院神经内科皮层下脑梗死患者。根据中华医学会神经病学分会痴呆与认知障碍学组写作组2011年制定的《血管性认知障碍诊治指南》[4]标准,根据入组标准与排除标准,将患者分为SVCI组(49例)与无认知障碍的皮质下梗死(subcortical infarcts,SI)组(42例)。
SVCI组入组标准:①符合《血管性认知障碍诊治指南》推荐标准;②患者或家属知情同意。
SI组入组标准:①患者无认知障碍主诉或知情者报告无认知损害;②客观检查不存在认知损害的证据;③采用MoCA量表评估为无认知损害;④患者或家属知情同意。
排除标准:①有其他可能影响认知或意识状态的脑部疾病(如出血性脑血管疾病、炎性脑病、脑积水、阿尔茨海默病或其他类型的痴呆、颅脑创伤、神经脱髓鞘疾病等其他神经系统疾病);②有妨碍评估正常进行的严重神经功能障碍(如意识障碍、严重视听障碍、失语、失用、严重肢体功能障碍等);③有可能影响认知的全身性疾病或异常(如恶性肿瘤、精神疾病、自身免疫性疾病、物质依赖或中毒史、长期使用精神活性物质等);④体内有金属、电子或磁性植入物等不能行磁共振成像(magnetic resonance imaging,MRI)检查者。
收集病史,美国国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS),记录患者的高血压病[5]、糖尿病[6]、高脂血症[7]、高同型半胱氨酸血症[8]、吸烟[9]、饮酒[10]、心房颤动[11]、梅毒病史[12]等危险因素情况。神经影像学检查包括头颅计算机断层扫描(computertomography,CT)、头颅MRI平扫+扩散加权成像(diffusion weighted imaging,DWI),脑血管评估包括头颅CT血管成像(CT angiography,CTA)或磁共振血管成像(magnetic resonance angiography,MRA),以及大脑中动脉和基底动脉的高分辨率MRI管壁成像。
1.2 白质变性评估方法 统计患者头颅MRI T2加权像上病灶个数、病灶面积、病灶最大直径、部位、新旧。新发病灶的评估以DWI为准,并分别与T2加权像、T1加权像病灶进行比较。由2名相同资历的放射科医生在不了解临床资料的情况下,采用改良版本的Scheltens量表独立对头颅MRI T2加权像白质病变独立评分,结果由一名主任医师资格的放射科医师进行审阅。
1.3 神经心理学评估 采用蒙特利尔认知评估量表对所有患者进行认知评估。根据郭启浩等对上海市神经内科记忆门诊调查结果划定认知损害的临界值:受教育时间5~8年者,21分;受教育时间9~12年,22分;受教育时间大于12年,23分[13]。根据检测结果判定有无认知损害,筛选出VCI患者。以上量表由2位具有心理测量师资格的神经内科医师以及1名接受过系统神经心理学培训的研究生完成。
1.4 统计学方法 采用SPSS18.0进行处理数据处理。计量资料如符合正态分布,采用表示,两样本比较采用t检验;计数资料采用百分率表示,采用卡方检验。对不符合正态分布的计量资料采用中位数和四分位数表示,相关分析应用Spearman秩和相关分析。P<0.05为差异有显著性。
2 结果
2.1 一般情况 SVCI组和SI组患者在受教育程度、年龄、性别比例等人口学资料方面均无显著差异。而脑血管病危险因素如高血压病、高脂血症、高同型半胱氨酸血症、吸烟、饮酒、心房颤动、梅毒病史等方面无统计学差异。但SVCI组糖尿病发病率高于SI组(38.78% vs 16.67%,P=0.02)(表1)。

表1 两组患者人口学特征
2.2 SVCI与SI组临床特征分析 49例SVCI患者中以记忆力障碍主诉或代主诉患者32例(65.31%),代主诉反应迟钝者12例(24.49%),定向力下降患者10例(20.41%),代主诉理解力下降者9例(18.37%),其他主诉包括吐字不清、计算力下降、回答问题不切题、认知障碍等。SVCI组患者NIHSS≤3分者37例(75.51%)。SI组患者NIHSS评分小于3分者23例,占54.76%。与SI组患者比较,SVCI组患者NIHSS评分小于3分患者数量较少,差异有显著性(P=0.037)。
2.3 SVCI和SI组神经影像学特征 49例SVCI患者中,1例因心脏支架禁忌不能行头颅MRI检查,1例患者因不配合无法完成MRI检查。共47例完成了头颅MRI检查,其中检出不同程度脑白质病变患者37例(75.51%),分别予以改良Scheltens量表评分,最低分数6分,最高分数28分,中位数白质损伤程度15(11,21.5)。SI患者白质变性10例,最低评分4分,最高10分,中位数白质损伤程度7(5,9),SVCI组患者白质评分高于SI患者,两组差异有显著性(P<0.001)。
2.4 认知障碍与脑白质损害程度的相关性
MOCA分值MOCA评分与脑白质变性程度成负相关,相关系数Rs=-0.495,P=0.002,说明随白质变性程度增加,智能损害越严重(图1)。2.5 MoCA分量表评分与脑白质损害程度的相关性 视空间和执行功能与白质变性程度负相关(Rs=-0.415,P=0.028)。瞬时记忆量表评分与脑白质损伤程度负相关(Rs=-0.577,P=0.001)。注意分量表评分与脑白质损伤程度负相关(Rs=-0.382,P=0.001)。延

图1 白质损伤评分与认知评分的相关性
迟记忆分量表评分与脑白质损伤程度负相关(Rs=-0.389,P=0.041<0.05)。命名分量表评分(Rs=-0.028,P=0.885)、语言分量表评分(Rs=-0.065,P=0.738)、抽象分量表评分(Rs=-0.076,P=0.693)及定向力分量表评分(Rs=-0.005,P=0.978)与脑白质损伤程度无相关性(图2~5)。
3 讨论
本研究主要目的是分析SVCI患者的临床、认知和神经影像学特征,以及认知损害和白质变性的相关性。研究发现,SVCI患者中糖尿病患病率较高;SVCI神经影像学多伴有白质变性(75.51%);患者肢体功能损害不显著(NIHSS评分小于3分患者占75.51%);SVCI患者认知损害与白质损害程度相关,尤其是执行功能、注意、瞬时记忆和延迟记忆等认知领域,随着白质损害程度的增加,认知损害的程度也增加。
既往研究认为,VCI是指由高血压病、糖尿病等各种脑血管危险因素或脑血管病本身导致的一组认知损害程度不同的临床综合征[14-15],高血压病、高脂血症、吸烟等是VCI患者认知损害的致病因素之一,在本研究中,虽然上述危险因素是卒中患者常见致病因素,但并非是导致卒中患者出现认知损害的因素。

图2 视空间与执行功能与白质损伤程度的相关性

图3 瞬时记忆与白质损伤评分的相关性
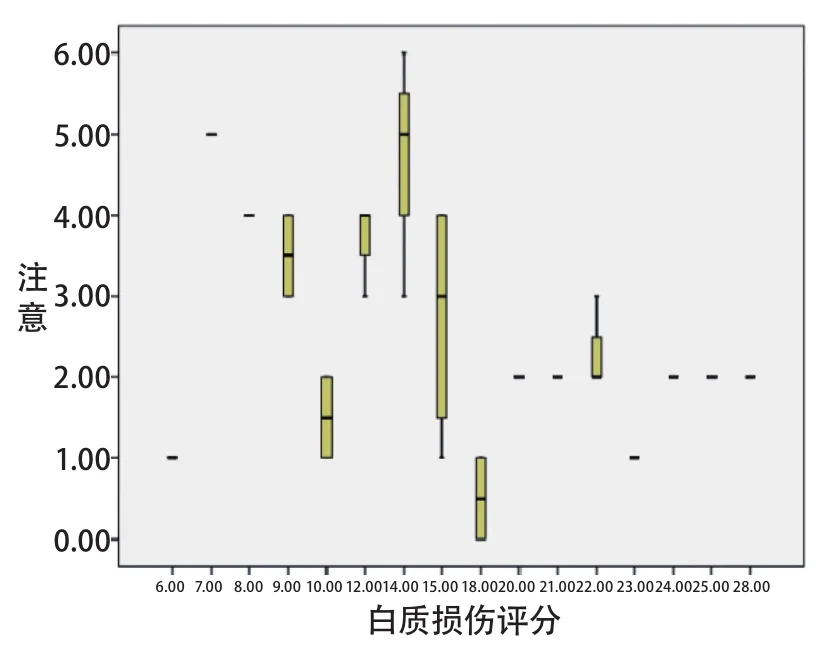
图4 注意分量表评分与白质损伤评分的相关性

图5 延迟记忆与白质变性程度的相关性
在本研究中,SVCI组患者的糖尿病患病率高于SI组,提示糖尿病可能与皮层下梗死患者认知障碍有关。糖尿病患者血糖异常导致VCI具体机制尚不明确,但有研究认为可能高血糖引起的氧化应激、山梨醇旁路代谢途径激活、大量炎症因子产生引起血管内皮功能紊乱、蛋白质C途径激活、胰岛素抵抗等有关[16]。亦有研究证实糖尿病胰岛素代谢紊乱引起的低血糖能导致永久性认知功能障碍[17-18]。
VCI患者认知损害的特征主要为执行功能损害,也可以表现为记忆力损害[19]。执行功能障碍的损伤部位以皮层下连接为主,而记忆力下降主要累及海马[20]。在本研究中,入院认知障碍相关主诉主要以记忆力下降为主,其次是理解力下降、反应迟钝等,神经影像学结果主要是白质变性为主,但梗死灶累及海马者仅有1例。认知评估结果和白质损害评分相关分析提示SVCI患者认知损害尤其是尤其是执行功能、注意、瞬时记忆和延迟记忆等认知领域白质变性程度密切相关,提示记忆力损害可能是SVCI患者认知损害重要特征之一,白质损伤在记忆力损害中起到重要作用。
SVCI患者记忆力损害机制尚不明确。但以下机制可能相关:第一,记忆形成后在海马中保存[20],但其形成和信息检索却需要额叶的参与[21],而皮层下白质纤维为连接额叶的纤维[22],SVCI患者皮层下白质损害阻碍了记忆的形成及存储,故患者瞬时记忆和延迟回忆均产生了障碍。其次,短时记忆理论认为,信息由感觉存储进入短时记忆必须有注意成分的参与,本研究中以记忆障碍患者主诉多为即刻记忆下降,与注意障碍有明显的关系,与短时记忆理论观点吻合。
本研究提示了糖尿病可能是SVCI患者的危险因素,白质变性为影像学特征,除了执行功能损害之外,记忆力损害也是其认知损害重要特征之一,但尚需要进一步研究其具体发生机制。此外,本研究样本量较少,受课题研究周期时间限制,需要进一步跟踪研究其长期认知变化及预后。
1 Román GC, Erkinjuntti T, Wallin A, et al. Subcortical ischaemic vascular dementia[J]. The Lancet Neurology, 2002, 1:426-436.
2 Iadecola C. The Pathobiology of Vascular Dementia[J].Neuron, 2013, 80:844-866.
3 魏娜, 王拥军, 张玉梅. 脑白质病变4个分级量表的信度研究[J]. 中国康复理论与实践, 2012:562-565.
4 中华医学会神经病学分会痴呆与认知障碍学组写作组. 血管性认知障碍诊治指南[J]. 中华神经科杂志,2011, 44:142-147.
5 Towfighi A, Markovic D, Ovbiagele B. Consistency of blood pressure control after ischemic stroke:prevalence and prognosis[J]. Stroke, 2014, 45:1313-1317.
6 Association AD. Standards of Medical Care in Diabetes--2014[J]. Diabetes Care, 2013, 37:S14-S80.
7 吴佳, 沈东超, 石玉芝, 等. 高甘油三酯血症的评估与治疗:内分泌学会临床实践指南(节选第一部分)[J]. 中国卒中杂志, 2013:50-58.
8 李茜, 周云涛, 田卫, 等. 同型半胱氨酸的代谢与缺血性卒中的相互关系[J]. 中国卒中杂志, 2014:797-802.
9 Improgo MR, Scofield MD, Tapper AR, et al. From smoking to lung cancer: the CHRNA5/A3/B4 connection[J]. Oncogene, 2010, 29:4874-4884.
10 Blonski W, Kotlyar DS, Forde KA. Non-viral causes of hepatocellular carcinoma[J]. World J Gastroenterol,2010, 16:3603-3615.
11 January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society[J]. J Am Coll Cardiol, 2014, 64:e1-e76.
12 Clement ME, Okeke NL, Hicks CB. Treatment of syphilis: a systematic review[J]. JAMA, 2014,312:1905-1917.
13 Guo Q, Cao X, Zhou Y, et al. Application study of quick cognitive screening test in identifying mild cognitive impairment[J]. Neuroscience Bulletin, 2010,26:47-54.
14 Jellinger KA. Pathology and pathogenesis of vascular cognitive impairment-a critical update[J]. Front Aging Neurosci, 2013, 5:17.
15 Johnston SC, Mendis S, Mathers CD. Global variation in stroke burden and mortality: estimates from monitoring, surveillance, and modelling[J]. Lancet Neurol, 2009, 8:345-354.
16 Bornstein NM, Brainin M, Guekht A, et al. Diabetes and the brain: issues and unmet needs[J]. Neurol Sci,2014, 35:995-1001.
17 Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia:a statement for healthcare professionals from the american heart association/american stroke association[J]. Stroke, 2011, 42:2672-2713.
18 Whitmer RA, Karter AJ, Yaffe K, et al. Hypoglycemic episodes and risk of dementia in older patients with type 2 diabetes mellitus[J]. JAMA, 2009, 301:1565-1572.
19 Lopez-Valdes HE, Clarkson AN, Ao Y, et al.Memantine enhances recovery from stroke[J]. Stroke,2014, 45:2093-2100.
20 Bird CM, Burgess N. The hippocampus and memory:insights from spatial processing[J]. Nat Rev Neurosci,2008, 9:182-194.
21 Schacter DL. Illusory memories: a cognitive neuroscience analysis[J]. Proc Natl Acad Sci USA,1996, 93:13527-13533.
22 Lamar M, Catani M, Price CC, et al. The impact of region-specific leukoaraiosis on working memory deficits in dementia[J]. Neuropsychologia, 2008,46:2597-2601.
【点睛】
本研究分析了皮层下脑梗死患者的白质损伤特点、认知障碍特征及二者的关系,从认知阈的角度分析皮层下脑梗死出现记忆障碍的可能机制。

