动脉瘤夹闭术可能缩短急性动脉瘤性蛛网膜下腔出血相关脑血管痉挛持续时间
边立衡,赵性泉,王文娟,侯宗刚
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)约占所有卒中的5%,因其患病年龄较低,病情严重,对社会与家庭影响极大[1-2]。脑CV(cerebral vasospasm,CV)是aSAH后最常见的并发症,发生率高达70%,其中高达36%的患者发生症状性脑缺血,使死亡率增加了1.5~3倍[3]。临床症状和经颅多普勒超声(transcranial Doppler,TCD)检查提示可能存在CV者,最终可通过全脑血管造影明确诊断。使用TCD测定脑血流速度(cerebral blood flow velocity,CBFV)可发现SAH后CV[4],且TCD具有与血管造影相同的敏感度及特异度[5]。因此,TCD是评价aSAH不同治疗方法之间血流动力学差异的良好方法。
aSAH患者应接受神经外科夹闭术或血管内填塞术以降低再出血风险[2]。然而,目前关于选择何种方式处理动脉瘤尚无定论[2,6-8],且关于不同方法治疗aSAH后的血流动力学比较的数据较少,尤其是缺少未手术患者的相关数据。为了评价不同治疗方法对aSAH后CV的影响,本研究使用TCD对发病14 d内的aSAH患者的脑血流动力学进行连续监测,分析不同治疗方式对CV的影响。
1 对象与方法
1.1 研究对象 连续选取2008年4月~2009年10月首都医科大学附属北京天坛医院神经病学中心急诊就诊的、发病72 h内的aSAH患者45例。所有患者由平诊颅脑计算机断层扫描(computed tomography,CT)明确诊断的SAH,全脑血管造影术发现责任动脉瘤,并由2名经验丰富的神经介入科医生背对背进行判断。入组后立即采集基线TCD数据。本研究经过医院伦理委员会批准,获得患者或其法定代理人同意。
1.2 入选标准 ①年龄≥18岁;②符合国际疾病分类法(International Classification of Diseases,ICD)第10版,诊断代码为430.0(SAH)[9];③72 h内完成全脑血管造影(digital subtraction angiography,DSA);④手术组的患者在72 h内完成手术治疗;⑤颞窗良好。
1.3 排除标准 ①DSA证实非动脉瘤性SAH;②发病时间不明确或来院超过72 h;③颞窗较差;④TCD和(或)DSA发现颅内外大动脉狭窄;⑤严重的内科并发症。
1.4 临床治疗 根据动脉瘤的处理方法,将符合入组条件45例的aSAH分为3组:保守组14例,动脉瘤填塞组14例,动脉瘤夹闭术17例。所有患者均接受尼莫地平治疗,动脉瘤填塞或夹闭后接受高血压、高血容量及血液稀释治疗。
1.5 临床及影像学评价 通过患者的医疗记录获得人口学信息(年龄、性别)、既往史(高血压、糖尿病、高脂血症、吸烟、酗酒及既往SAH病史)、临床分级[Hunt-Hess分级[10]以及世界神经外科医师联盟[11](World Federation of Neurosurgical Society,WFNS)分级]及影像学严重程度(Fisher分级)[12]的基线信息。患者在发病当天完成颅脑CT检查。神经放射医师对CT的Fisher分级进行盲法评价。神经超声科医师对所有TCD结果进行盲法评价。
1.6 TCD血流动力学评价脑CV TCD血流动力学监测由本研究专业的神经超声医师完成。72 h内完成基线数据的采集,之后每天在同一时间段(下午5∶00~6∶00)进行TCD监测。
血流动力学参数采集使用的TCD型号为Multi-Dop(DWL-Elektronische Systeme GmbH L ngerach4 D-78354,Sipplingen,德国),使用2 MHz探头采集双侧大脑中动脉(middle cerebral artery,MCA)和大脑前动脉(anterior cerebral artery,ACA)血流参数,使用4 MHz探头测定颅外颈内静脉(internal carotid artery,ICA)。通过双侧颞窗监测MCA和ACA,深部分别为36~60 mm和60~70 mm。记录平均血流速度最大值(mean cerebral blood flow velocity,MCBFV)。采集双侧MCA和ACA的血流参数。由于动脉瘤破裂后血液弥散进入蛛网膜下腔,故MCBFV和Lindegaard指数按照以下原则确定比较的侧别:责任动脉瘤同侧与责任动脉瘤对侧;若动脉瘤位于中线位置(如前交通动脉瘤、基底动脉瘤),则责任动脉瘤同侧定义为外科夹闭手术或血管内填塞入路侧。
在测定血流速度的同时计算Lindegaard指数,该方法使TCD诊断CV更加准确[13]。Lindegaard指数的测定方式为MCA/ACA的平均血管速度最大值除以同侧ICA颅外段的平均血流速度最大值。MCA-MCBFV/ACAMCBFV≥120 cm/s和MCA-Lindegaard指数/ACA-Lindegaard指数≥3.0定义为CV[5]。
1.7 随访与结局 90 d时对患者展开随访,通过改良Rankin量表(modified Rankin Scale,mRS)评分评价预后。本研究中mRS<3为预后良好,≥3为预后不良[14]。
1.8 统计分析 采用SAS 9.3统计软件(SAS Institute Inc,Cary,NC,USA)进行数据处理。在数据分析前进行正态性检验及方差齐性分析。计量资料符合正态分布,使用()或()表示;计数资料使用频数或百分位表示,分析3种不同处理方法与CV的关系用卡方检验。使用方差分析比较3组CV发生时点、持续时间及血流速度最高时间。重复测量的方差分析(repeated measures analysis of variance,reANOVA)对3组从基线到发病14 d内的MCBFV和Lindegaard指数进行比较,并使用LSD检验进行post hoc分析,确定两两比较结果。P<0.05为差异具有显著性。
2 结果
2.1 基线资料 入组的45例患者完成全部12次TCD检查及90 d随访。基线信息分析发现3组患者人口学、既往史(高血压、糖尿病、高脂血症、吸烟、酗酒及既往SAH病史)方面比较差异无显著性(P>0.05)。保守组、填塞组及夹闭组的临床及影像学分级差异无显著性(P>0.05)(表1)。
45例患者中有14例经DSA证实有责任动脉瘤,但因为有些责任动脉瘤位于MCA分叉处,上面发出供应脑部功能区的深穿支;患者病情较严重,Hunt-Hess分级超过Ⅲ级;或拒绝手术治疗,从而没有接受动脉瘤闭塞术。其中2例患者死于动脉瘤破裂再出血。
2.2 不同治疗组TCD血流动力学比较 14例患者接受动脉瘤填塞,17例患者接受动脉瘤夹闭术治疗之后接受高血压、高血容量及血液稀释治疗。发病14 d内,ACA的平均血流速度从高到低为内科保守组[(74.60±5.84)cm/s]、夹闭组[(70.00±5.24)cm/s]及填塞组[(65.70±6.03)cm/s]。ACA瘤的Lindegaard指数从大到小依次为内科保守组(3.87±0.32)、夹闭组(3.82±0.31)及填塞组(3.65±0.36)。MCA平均血流速度由高到低分别为保守组[(101.2±9.1)cm/s]、夹闭组[(87.0±6.2)cm/s]及填塞组[(76.2±9.2)cm/s]。MCA Lindegaard指数从大到小依次为保守组(5.50±0.65)、夹闭组(4.15±0.46)及填塞组(3.81±0.55)。
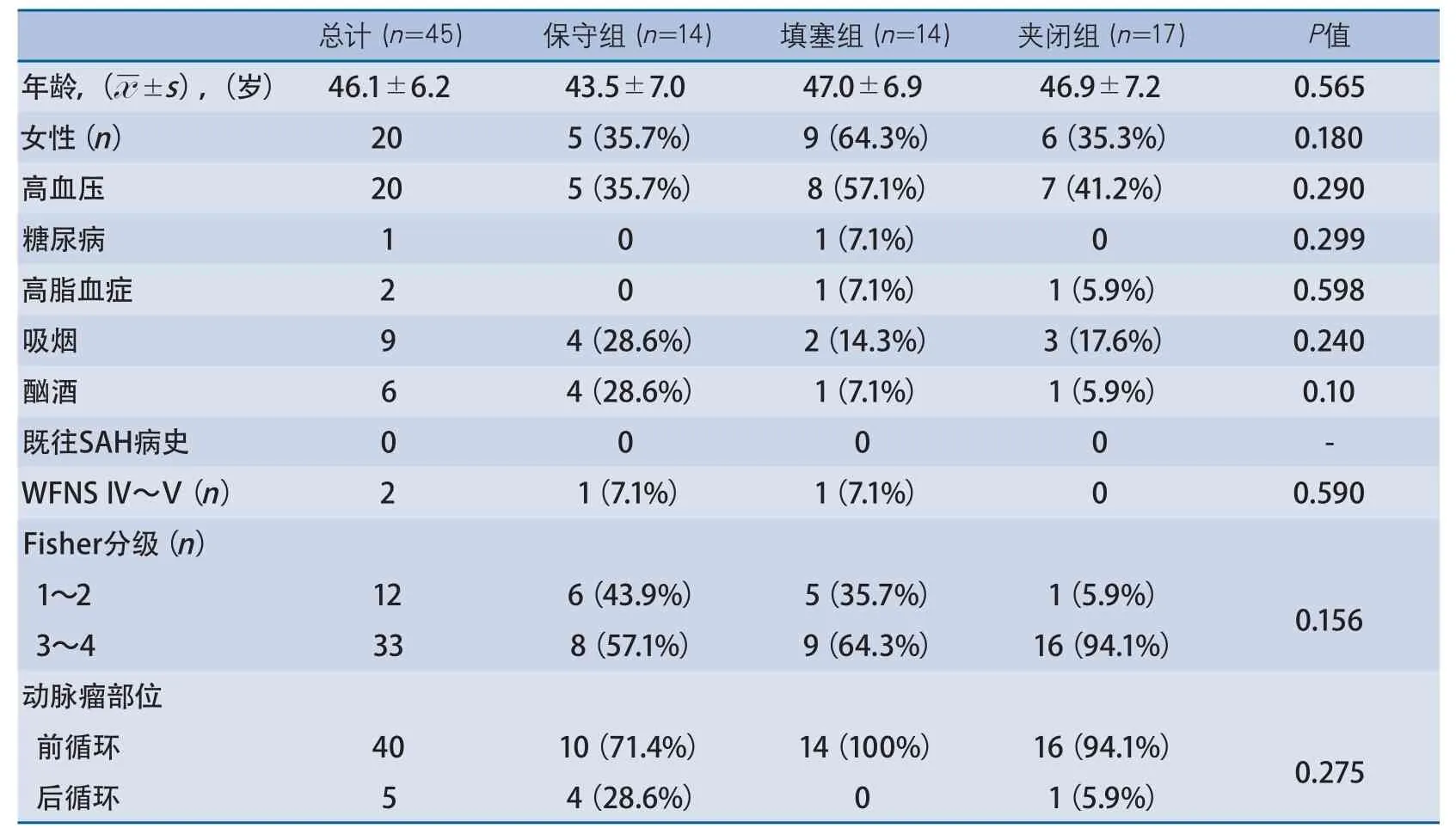
表1 患者基线资料
2.1.1 ACATCD血流动力学比较 重复测量的方差分析显示3种不同治疗方法的ACA平均血流速度比较差异有显著性(P=0.0001),post hoc分析显示每两组之间差异均有显著性(保守组 vs 填塞组,P=0.025;填塞组 vs 夹闭组,P=0.04;保守组 vs 夹闭组,P=0.023)(表2)。3组ACALindegaard指数差异无显著性(P=0.006),但post hoc分析发现保守组与夹闭组之间的差异无显著性(保守组 vs 填塞组,P=0.041;保守组 vs 夹闭组,P=0.5;填塞组vs 夹闭组,P=0.05)(表2)。将填塞组与夹闭组合为动脉瘤闭塞组后,保守组患者的ACA平均血流速度与Lindegaard指数均高于动脉瘤闭塞组(P=0.001,P=0.005)。
2.1.2 MCATCD血流动力学比较 平均血流速度及Lindegaard指数由高到低为保守组、夹闭组及填塞组(表3)。重复测量的方差分析显示3种不同治疗方法的MCA平均血流速度的差异具有显著性(P=0.004),post hoc分析显示每两组之间差异均有显著性(保守组 vs 填塞组,P=0.027;保守组 vs 夹闭组,P=0.037;填塞组 vs 夹闭组,P=0.05)(表3)。3组MCALindegaard指数差异亦有显著性(P=0.005),但post hoc分析发现填塞组与夹闭组之间的差异无显著性(保守组 vs 填塞组,P=0.034;保守组 vs 夹闭组,P=0.044;填塞组 vs 夹闭组,P=0.31)(表3)。将填塞组及夹闭组合为闭塞组,保守组的平均血流速度及Lindegaard指数高于闭塞组(P=0.015,P=0.022)。
2.2 MCACV持续时间 连续监测中没有发现MCA平均血流速度超过120 cm/s,故将CV定义为MCA平均血流速度超过120 cm/s,且Lindegaard指数≥3.00[5]。符合CV诊断标准的患者分别为保守组6例,填塞组4例,夹闭组5例(P>0.05)。 患者平均在(5.48±2.21)d时开始出现CV,在(8.17±2.72)d时CV最严重,3
组差异无显著性(表4)。动脉瘤夹闭组患者CV持续时间较保守组短[(3.30±1.87)d vs(7.29±2.23)d,P=0.035](表4)。

表2 3组患者大脑前动脉血流参数

表3 3组患者大脑中动脉血流参数
2.3 临床结局 动脉瘤闭塞组及保守组的良好预后的比例分别为81.0%(25/31)及42.3%(6/14)(P=0.104)。不良预后的比例分别为保守组57.1%(8/14),填塞组21.4%(3/14),夹闭组5.9%(1/17)(P=0.028)。15例患者发生CV,3组的比例分别为保守组42.9%(6/14),填塞组28.6%(4/14),夹闭组29.4%(5/17)(P>0.05),但仅有1例患者(1/15)预后不良。30例没有发现CV的患者中有6例预后不良(6/30)(P=0.096)。保守组2例患者在90 d随访期间死于动脉瘤再出血。2例前交通动脉瘤破裂的患者虽然分别接受了夹闭术及填塞,但症状恶化,mRS增至4级,TCD发现双侧ACACV,且头CT显示ACA供血区域出现梗死灶。3例老年患者随访时mRS为3级,14 d内TCD没有发现CV的证据,但动脉瘤闭塞后出现神经功能障碍,颅脑CT显示缺血灶。
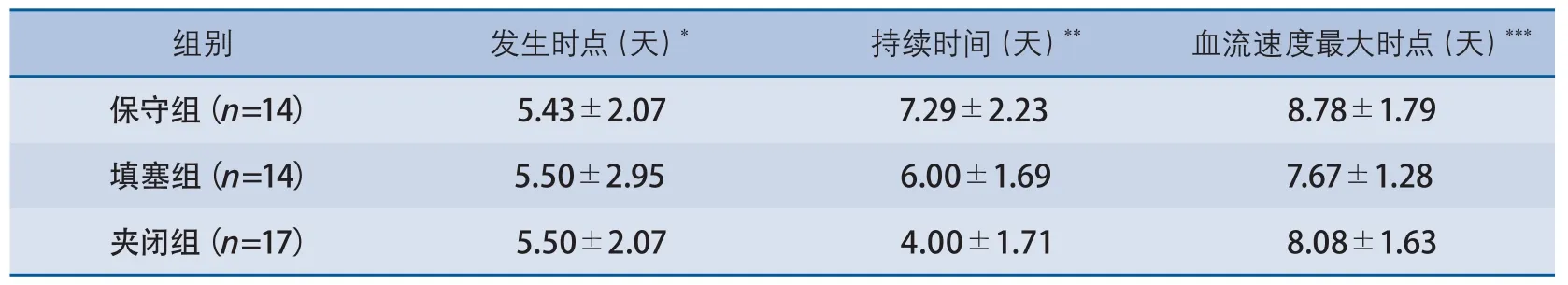
表4 不同处理方式与血管痉挛发生时点、持续时间及血流最大时点的关系
3 讨论
研究表明,在动脉瘤闭塞前,可以轻度容量扩张、血液稀释及升高血压,但要避免血压极度升高,防止再出血[15]。本研究发现保守组与动脉瘤闭塞组相比,脑CV更严重,发生风险更高,考虑原因有:安全闭塞动脉瘤后患者可以接受高血压、高血容量及血液稀释治疗,而保守组患者由于再出血风险较高,未接受该治疗[15-16]。但是目前关于动脉瘤闭塞前血压应控制到何水平,尚未达成一致意见。
临床试验和动物实验都证实出血早期清除蛛网膜下腔内积血可以缓解CV,可能是由于潜在的导致CV的物质已被清除[17-19]。本研究发现同样是发生CV,夹闭组患者的CV持续时间短于保守组,与填塞组比较也有缩短的趋势,可能是填塞组患者都没有接受开颅术,蛛网膜下腔内的积血不能很快得到清除。因此,填塞组脑脊液中的致痉挛物质水平更高,CV的持续时间更长。文献报道,而在开颅夹闭术中,手术医师在处理动脉瘤的同时还会清除蛛网膜下腔和脑表面的积血,特别是在前交通动脉瘤的手术中,医师还会进行胼胝体造瘘,打通脑室系统和蛛网膜下腔[20-21],进一步加快血液里致痉挛物质的清除,以及在开颅手术中常规放置腰穿引流管[22],并在术后适当保留几天,而填塞组和保守组患者没有此项操作。
除此之外,本研究发现高龄患者虽然血流动力学参数并没有满足脑CV的标准,仍然发生脑缺血。之前的几项研究表明,高龄的aSAH患者脑CV的发生率较低[23-24]。这种现象说明随着年龄的增加,患者动脉硬化的程度增加,导致小动脉肌层弹性降低[25]。相反,年轻患者的血管弹性较好,只有当脑血流明显下降时,脑灌注压才达到临界闭合压[26]。因此,高龄患者血管弹性小,在同样小的压力下,仍然能维持小动脉的持续开放[27]。
本研究存在一些研究不足。首先,本研究样本量小。其次,仅使用TCD诊断脑CV,没有联合使用CT灌注,观察脑组织灌注情况,深入探讨CV与迟发性脑缺血的关系。第三,目前DSA仍是脑CV诊断金标准,但本研究没有使用该指标,所有CV的判断都是基于TCD血流参数。第四,由于TCD监测受患者颞窗情况的影响,入组患者年龄偏小。第五,急性期患者头痛明显,配合较差,后循环血流参数不能完整获得,故本研究没能获得椎-基底动脉系统的完整血流数据。
本研究通过TCD检测不同方法治疗aSAH后的血流动力学特点,发现早期闭塞动脉瘤可间接降低脑CV的风险;一旦发生CV,神经开颅术可缩短CV持续时间;TCD仍然是临床上快速判断,且可以连续监测血流动力学的良好方法之一。
1 Bonita R, Thomson S. Subarachnoid hemorrhage:epidemiology, diagnosis, management, and outcome[J]. Stroke, 1985, 16:591-594.
2 Connolly ES Jr, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2012,43:1711-1737.
3 Treggiari-Venzi MM, Suter PM, Romand JA. Review of medical prevention of vasospasm after aneurysmal subarachnoid hemorrhage:a problem of neurointensive care[J]. Neurosurgery, 2001, 48:249-262.
4 Aaslid R, Markwalder TM, Nornes H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries[J]. J Neurosurg,1982, 57:769-774.
5 Suarez JI, Qureshi AI, Yahia AB, et al. Symptomatic vasospasm diagnosis after subarachnoid hemorrhage:evaluation of transcranial Doppler ultrasound and cerebral angiography as related to compromised vascular distribution[J]. Crit Care Med, 2002, 30:1348-1355.
6 Molyneux AJ, Kerr RS, Yu LM, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised comparison of effects on survival, dependency,seizures, rebleeding, subgroups, and aneurysm occlusion[J]. Lancet, 2005, 366:809-817.
7 Molyneux A, Kerr R, Stratton I, et al. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J]. Lancet, 2002, 360:1267-1274.
8 Koivisto T, Vanninen R, Hurskainen H, et al.Outcomes of early endovascular versus surgical treatment of ruptured cerebral aneurysms. A prospective randomized study[J]. Stroke, 2000,31:2369-2377.
9 Kokotailo RA, Hill MD. Coding of stroke and stroke risk factors using International Classification of Diseases, revisions 9 and 10[J]. Stroke, 2005, 36:1776-1781.
10 Hunt WE, Hess RM. Surgical risk as related to time of intervention in the repaire of intracranial aneurysms[J]. J Neurosurg, 1968, 28:14-20.
11 No authors listed. Report of World Federation of Neurological Surgeons Committee on a Universal Subarachnoid Hemorrhage Grading Scale[J]. J Neurosurg, 1988, 68:985-986.
12 Fisher CM, Kistler JP, Davis JM. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning[J]. Neurosurgery,1980, 6:1-9.
13 Lindegaard KF, Nornes H, Bakke SJ, et al. Cerebral vasospasm diagnosis by means of angiography and blood velocity measurements[J]. Acta Neurochir(Wien), 1989, 100:12-24.
14 Huybrechts KF, Caro JJ, Xenakis JJ, et al. The prognostic value of the modified Rankin Scale score for long-term survival after first-ever stroke. Results from the Athens Stroke Registry[J]. Cerebrovasc Dis,2008, 26:381-387.
15 Sen J, Belli A, Albon H, et al. Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage[J]. Lancet Neurol, 2003, 2:614-621.
16 Lee KH, Lukovits T, Friedman JA. "Triple-H" therapy for cerebral vasospasm following subarachnoid hemorrhage[J]. Neurocrit Care, 2006, 4:68-76.
17 Inagawa T, Yamamoto M, Kamiya K. Effect of clot removal on cerebral vasospasm[J]. J Neurosurg, 1990,72:224-230.
18 Weir B. The effect of clot removal on cerebral vasospasm[J]. Neurosurg Clin N Am, 1990, 1:377-385.
19 Hosoda K, Fujita S, Kawaguchi T, et al. Effect of clot removal and surgical manipulation on regional cerebral blood flow and delayed vasospasm in early aneurysm surgery for subarachnoid hemorrhage[J].Surg Neurol, 1999, 51:81-88.
20 Winkler PA, Weis S, Buttner A, et al. The transcallosal interforniceal approach to the third ventricle:anatomic and microsurgical aspects[J]. Neurosurgery, 1997,40:973-982.
21 Tkachev VV, Shagal LV, Muzlaev GG. The use of transcallosal ventriculostomy to treat complicated forms of aneurismal intracranial hemorrhages[J]. Zh Vopr Neirokhir Im N N Burdenko, 2015, 79:48-57.
22 Park S, Yang N, Seo E. The effectiveness of lumbar cerebrospinal fluid drainage to reduce the cerebral vasospasm after surgical clipping for aneurysmal subarachnoid hemorrhage[J]. J Korean Neurosurg Soc,2015, 57:167-173.
23 Charpentier C, Audibert G, Guillemin F, et al.Multivariate analysis of predictors of cerebral vasospasm occurrence after aneurysmal subarachnoid hemorrhage[J]. Stroke, 1999, 30:1402-1408.
24 Torbey MT, Hauser TK, Bhardwaj A, et al. Effect of age on cerebral blood flow velocity and incidence of vasospasm after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2001, 32:2005-2011.
25 Claus JJ, Breteler MM, Hasan D, et al. Regional cerebral blood flow and cerebrovascular risk factors in the elderly population[J]. Neurobiol Aging, 1998,19:57-64.
26 Dewey RC, Pieper HP, Hunt WE. Experimental cerebral hemodynamics. Vasomotor tone, critical closing pressure, and vascular bed resistance[J]. J Neurosurg, 1974, 41:597-606.
27 Harrod CG, Bendok BR, Batjer HH. Prediction of cerebral vasospasm in patients presenting with aneurysmal subarachnoid hemorrhage:a review[J].Neurosurgery, 2005, 56:633-654.
【点睛】通过比较不同治疗方法对aSAH后的血流动力学变化,发现动脉瘤夹闭术可能缩短急性SAH相关血管痉挛时间。

