生长相关蛋白-43影响神经细胞分裂方向作用的研究
黄蕊,文玉军,鞠莉莉
卒中严重威胁人类健康,高发病率、高病死率、高致残率给全球带来沉重的疾病负担[1]。国外研究者在应用运动皮层电刺激的方法治疗卒中后慢性神经疼痛的过程中,发现患者在治疗后,同时伴有的肢体运动功能障碍有了明显的恢复[2]。现研究表明,应用皮层电刺激联合功能锻炼的大鼠脑梗死灶周围皮层运动区的生长相关蛋白-43(growth associated protein-43,GAP-43)明显多于单纯功能锻炼组,这与突触可塑性相关[3-4]。GAP-43是神经组织特异性表达的蛋白,与神经发育、轴突再生、突触重建密切相关,被认为是神经发育和再生的内在决定因子[5-8]。在哺乳动物的前脑中,水平分裂的神经祖细胞中高表达GAP-43[9];它与中心体相关且为中心体定位所必需[10]。由此可知,GAP-43可能是一种与细胞极性和细胞分裂相关的细胞命运决定子。然而,人们至今还不清楚GAP-43在细胞极性和细胞分裂方式调控的过程中究竟行使什么功能。为了阐明这个问题,我们对GAP-43是通过何种方式参与神经细胞分裂方向调控的进行探讨,希望以此对GAP-43在神经发育及卒中等神经损伤修复突触重建中的作用有新的认识。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 实验动物SPF级C57BL/6J GAP-43高表达转基因孕鼠6只,野生型C57BL/6J孕鼠6只,中国医学科学院实验动物中心提供,实验动物许可证号SCXK(京)2009-0007。所有实验用小鼠均在SPF级动物房饲养和繁殖。温度控制在22℃,湿度70%,自动光控(12 h明/12 h暗),自由采食和饮水。
1.1.2 主要试剂 十二烷基硫酸钠、聚氧乙烯单月桂酸酯、丙烯酰胺、N,N’-亚甲双丙烯酰胺以及兔抗小鼠actin抗体、羊抗小鼠GAP-43抗体均购自Sigma公司,山羊抗兔Gαi抗体购自Santa公司;过硫酸氨、N,N,N’,N’-四甲基乙二胺为Gibco公司产品,辣根过氧化物酶标记山羊抗兔或山羊抗小鼠IgG为北京中山生物技术有限公司产品,BCA蛋白定量试剂盒购自Pierce公司,Kodak BioMax MR X-光片来自Kodak公司,封闭用正常山羊血清购自武汉博士德生物技术有限公司,Alexa flour 488/594标记的山羊抗小鼠/抗兔IgG荧光二抗和TritonX-100则分别购自Moleculor Probe公司和Sigma公司。免疫共沉淀试剂盒(Immunoprecipitation Kit)与G蛋白珠子(Protein-G-agarose)均购自瑞士Roche公司。其他常用试剂均属于国产或进口的分析纯试剂。
1.2 实验方法
1.2.1 免疫荧光技术定性明确GAP-43的表达位置 分别取E13.5 d GAP-43转基因阳性胎鼠和对照野生型胎鼠各3只,冷冻切片机脑室区(ventricular zone,VZ)免疫荧光染色连续切片,切片厚度为40 ☒m,全部贴片。切片入0.01 mol/L磷酸缓冲液和吐温-20(phosphate buffer solution and Tween-20,PBST)中浸洗3次(每次5 min)后,入5%正常血清及0.1%牛血清蛋白(bovine serum albumin,BSA)混合封闭液中室温封闭抗原;倾去血清后直接置入用0.01 mol/L PBST按1∶1000稀释的GAP-43的抗体和用0.01 mol/L PBST按1∶500稀释的Gαi的抗体中,4℃过夜;切片再入PBST中浸洗3次(每次5 min),后放入用0.01 mol/L PBST稀释好的荧光二抗(1∶500稀释)中,室温1 h;0.01 mol/L PBS浸洗3次(每次5 min)后,用1∶3000的Hochest33258染核,15 min,室温避光;将切片最后用PBS浸洗2次(每次5 min),70%甘油封片。共聚焦显微镜下观察照相。
1.2.2 Western blot技术检测定量明确GAP-43的表达位置及表达量 4℃条件下,在E13.5 d12只实验组及对照组鼠脑中加入裂解液分别提取膜蛋白和细胞质蛋白,用BCA Protein Assay Kit测定GAP-43样品蛋白含量。每个样本取10 μg蛋白进行十二烷基硫酸钠(sodium dodecyl sulfate,SDS)聚丙烯酰胺凝胶电泳并转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉封闭液,室温下置摇床上封闭1 h,再用Tris-HCl缓冲盐溶液和吐温-20(tris buffered saline and Tween-20,TBST)稀释的羊抗小鼠源重组的GAP-43单克隆抗体(1∶3000稀释),4℃摇床杂交过夜;待恢复室温后,TBST洗3次,每次10 min置入TBST稀释的辣根过氧化物酶标记的羊抗小鼠抗体(1∶5000稀释)室温杂交1 h,洗3次,每次10 min,将膜置于化学发光液中,X线胶片曝光,显影及定影。
1.2.3 免疫共沉淀技术检测GAP-43与Gαi间的相互作用 4℃条件下,在E17.5 d9只实验组及对照组鼠脑中加入裂解液分别提取蛋白,将提取到的蛋白分为3组(实验组、阳性对照组和阴性对照组),4℃离心,12 000×g,45 min;取上清,各加入Protein-G-agarose 25 μl,4℃摇床3 h;4℃离心,12 000×g,5 min;取上清,各加入10 μl兔源Gαi抗体(1∶50稀释),4℃摇床过夜;4℃离心,12 000×g,5 min,去上清后,加入500 μl 洗脱缓冲液1,4℃摇床,20 min,重复1次;4℃离心,12 000×g,5 min,去上清后,加入500 μl 洗脱缓冲液2,4℃摇床,20 min,重复1次;4℃离心,12 000×g,5 min,去上清后,加入500 μl 洗脱缓冲液3,4℃摇床,20 min;4℃离心,12 000×g,5 min,去上清后加入5×蛋白上样缓冲液(1∶4稀释);95℃加热3 min;4℃离心,12 000×g,5 min,取上清。每个样本取10 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至PVDF膜上,5%脱脂奶粉封闭液,室温下置摇床上封闭1 h,再用TBST稀释的羊抗小鼠源重组的GAP-43单克隆抗体(1∶3000稀释),4℃摇床杂交过夜;待恢复室温后,TBST洗3次,每次10 min置入TBST稀释的辣根过氧化物酶标记的羊抗小鼠抗体(1∶5000稀释)室温杂交1 h,洗3次,每次10 min,将膜置于化学发光液中,X线胶片曝光,显影及定影。
1.2.4 细胞分裂的计数 分别取E13.5 d和E17.5 d的9只实验组及对照组胎鼠VZ区脑切片计数转基因胚胎鼠脑中神经前体细胞中沿水平和垂直不同方向分裂的细胞数量。根据细胞分裂平面与VZ面的夹角不同分为3种分裂方式:平行(0°~30°)、中间(30°~60°)、垂直(60°~90°)分裂。沿胚胎鼠脑的VZ面画一条长直线,沿细胞的分裂平面画一条直线,测量两条直线间的夹角,即为神经前体细胞分裂平面与脑室面的夹角。统计分析VZ区各种分裂角度的细胞数量,E13.5 d转基因组和野生型组的分裂细胞数量为168例;E17.5 d转基因组和野生型组的分裂细胞数量为105例。
1.2.5 统计学分析 采用SPSS 13.0对数据进行统计分析,计量资料经检验后符合正态分布,用“均数±标准差”表示。组间比较采用独立样本t检验。转基因组和野生型组细胞分裂方向比较采用卡方检验。P<0.05为差异有显著性。
2 结果
2.1 GAP-43表达在细胞膜上 E13.5 d高表达GAP-43转基因阳性胎鼠和对照野生型胎鼠脑区免疫荧光染色切片,可见GAP-43阳性反应。蛋白免疫印迹检测E13.5 d GAP-43表达的结果显示,GAP-43高表达转基因组的小鼠其GAP-43蛋白的表达量高于对照组的小鼠(P<0.05)(图1),且GAP-43特异性表达于细胞膜上(图2)。
2.2 GAP-43和Gαi间存在相互作用 取E17.5 d高表达GAP-43转基因阳性胎鼠脑组织,经冷冻切片后免疫荧光共染色,共聚焦显微镜观察单层胎鼠脑区免疫荧光染色切片,结果显示GAP-43与Gαi存在免疫荧光共定位(图3D中箭头所示)。为了进一步证明GAP-43与Gαi间是否存在相互作用,取E17.5 d高表达GAP-43转基因阳性胎鼠脑组织进行co-IP作用,结果显示GAP-43和Gαi相互结合(图3E中箭头所示)。
2.3 GAP-43高表达影响细胞的分裂平面 测量E13.5 d及E17.5 d转基因组和野生型组神经前体细胞分裂平面与VZ面的夹角(图4)。统计分析VZ区各种分裂角度的细胞数量。E13.5 d时,转基因组与对照组相比,细胞沿水平、中间和垂直角度分裂的细胞数量差异有显著性(P<0.05)(表1);而E17.5 d时,转基因组与对照组相比,以不同角度(水平、中间、垂直)分裂的细胞数量差异无显著性(P>0.05)(表2)。

图1 转基因组和野生型组GAP-43表达量比较(Volume=像素信号强度总和INT×像素面积mm2)注:GAP-43:生长相关蛋白-43
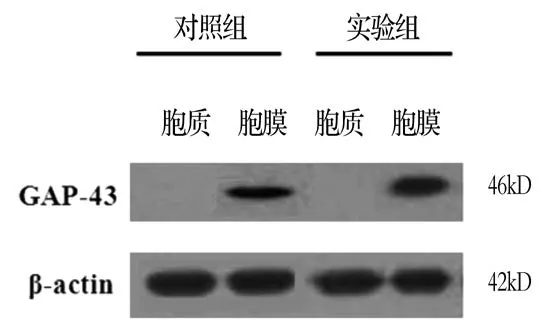
图2 GAP-43表达的检测注:Western blot结果显示GAP-43表达位置在细胞膜上;其中β-actin作为GAP-43的阳性对照;GAP-43:生长相关蛋白-43

图3 检测GAP-43和Gαi间的作用注:图A~D为E17.5 d鼠脑免疫荧光染色切片,共聚焦显微镜下观察照相,其中绿色为GAP-43;红色为Gαi;蓝色为细胞核;黄色为GAP-43和G蛋白免疫荧光共定位,标尺为250 μm。图E示在胎鼠脑蛋白提取液中加入Gαi的一抗与G蛋白,其中Gαi的一抗与G蛋白连接,然后用Western blot的方法检测与Gαi相互作用的GAP-43。在蛋白提取液中加入IgG的一抗与G蛋白,其中IgG的一抗与G蛋白连接作为阴性对照。胎鼠脑蛋白提取液行免疫印迹作为阳性对照。IB:免疫印迹,IP:免疫沉淀;GAP-43:生长相关蛋白-43
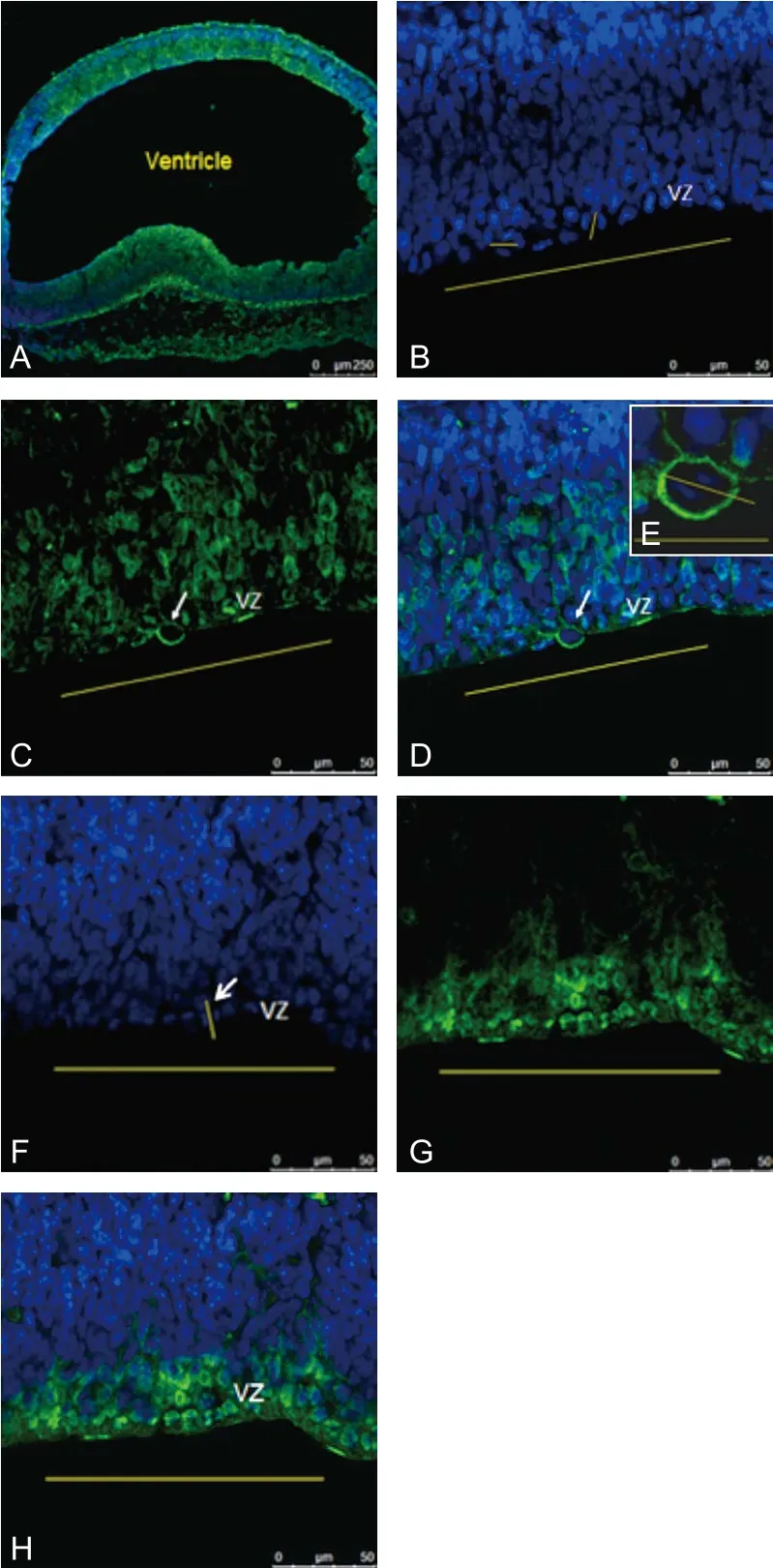
图4 GAP-43高表达影响神经细胞分裂方向注:图A~H为E13.5 d转基因组和野生型组鼠脑免疫荧光染色切片,共聚焦显微镜下观察照相,图中绿色为GAP-43;蓝色为细胞核。图A为胚胎E13.5 d胎鼠全脑染色,标尺为250 μm。图B~E为转基因组,沿脑室区画一条黄色长线,在表达GAP-43的细胞中黄色短线代表细胞分裂平面(细胞分裂后期),白色箭头所示为水平分裂的细胞(细胞分裂平面与脑室区的夹角为25°);图E为图D中箭头所示分裂细胞3倍放大图。图F~H为对照组,沿脑室区画一条黄色长线,黄色短线代表细胞分裂平面(细胞分裂后期);白色箭头所示为竖直分裂的细胞(细胞分裂平面与脑室区的夹角为73°),标尺为50 μm。GAP-43:生长相关蛋白-43

表1 胚胎E13.5 d转基因组与野生型组细胞分裂方向比较
3 讨论
GAP-43是神经发育和再生的内在决定因子[5-8],通过电镜对大鼠脑梗死灶周围皮层突触的超微结构进行观察,发现GAP-43参与了脑梗死灶周围皮层的突触重建[3-4]。目前研究发现GAP-43不仅存在于已分化定型、有轴突生长的神经元中,而且在NPC中就有表达[11-12],参与神经发生过程。且体内研究显示GAP-43与细胞中心体共定位且与中心体定位有关[6],提示GAP-43可能是一种与细胞极性相关的细胞命运决定子。
为了进一步揭示GAP-43参与神经发育的机制,本课题组前期建立了GAP-43高表达的转基因小鼠[13]。通过免疫荧光法和蛋白免疫印迹法测定GAP-43在实验组和对照组细胞内的定位,因为GAP-43是膜相关蛋白,其表达位置是在细胞膜上[14],结果表明转基因组中GAP-43的表达位置并没有改变(图2);而且转基因组的GAP-43蛋白表达量高于野生型组(图1)。Gαi可以和Gβγ组成G蛋白复合体,Gβγ蛋白可以调控纺锤体的旋转,使细胞发生不对称的分裂[15],而GAP-43又与G蛋白有密切关系,即G蛋白与其受体反应位点与GAP-43有交叉性[16]。以往的研究表明GAP-43不仅可以聚集细胞骨架肌动蛋白[17],而且可以招募包括G蛋白家族在内的信号蛋白[18-21]。我们前期的结果已经证明了GAP-43与细胞中心体不存在共定位[22],本研究表明,GAP-43与Gαi共定位(图3)。G0蛋白可以通过作用于GAP-43抑制GAP-43的活性[19],我们免疫共沉淀的结果进一步明确了GAP-43与Gαi间存在作用(图3箭头所示),这与以上的研究结果一致。

表2 胚胎E17.5 d转基因组与野生型组细胞分裂方向比较
近期研究表明,在哺乳动物的前脑中,GAP-43在水平分裂的神经祖细胞中有高表达,并与水平分裂的细胞密切相关[11]。细胞分裂平面与VZ面的夹角不同产生的分裂方式也不同:当夹角是垂直时,发生对称分裂,可以形成两个相同的子代;当夹角是平行时,发生不对称分裂,可以产生两个不同的子代[23]。为了进一步揭示GAP-43在细胞分裂方向中的作用机制,本课题组对转基因组胚胎鼠脑内神经前体细胞沿水平、中间角度和垂直方向分裂的细胞进行计数,并与对照组胎脑进行对照。结果显示E13.5 d时转基因组与对照组相比,细胞沿水平、中间和垂直角度分裂的细胞数量差异有显著性(表1)。抑制GAP-43表达可以改变神经前体细胞分化[11-12],根据神经发生的分裂平面理论[23],GAP-43参与神经前体细胞分化的机制可能是参与调控细胞分裂平面[11-12],并且G蛋白可以调控纺锤体的旋转使细胞发生不对称分裂[15],所以说GAP-43参与神经发生的机制很可能是通过G蛋白改变神经前体细胞的分裂方向来实现的,这与前人的研究成果一致。但是,本研究对于GAP-43与G蛋白作用的分子机制了解非常有限,接下来可以通过对Gαi的N端氨基酸作用位点的点突变及使用相应的蛋白抑制剂来进一步明确二者间作用对纺锤体旋转的影响。另外,GAP-43高表达改变了NPC的分裂方向,这势必会引起分化成神经元的数量改变[24],GAP-43对于神经元数量改变的影响本研究并未涉及有待于进一步的研究。
对于GAP-43通过G蛋白参与细胞分裂平面调控这一问题的探讨,对进一步探索NPC分化的分子机制有重要意义,有助于对GAP-43在神经发育及卒中等神经损伤修复突触重建中的作用有新的认识。
1 张润华, 刘改芬, 潘岳松, 等. 世界卒中流行趋势概况[J].中国卒中杂志, 2014, 9:768-773.
2 Brown JA, Lutsep HL, Weinand M, et al. Motor cortex stimulation for the enhancement of recovery from stroke:A prospective, multicenter safety study[J].Neurosurgery, 2008, 62 Suppl 2:853-862.
3 郑建, 杨力军, 谢瑞禄, 等. 皮层电刺激联合康复锻炼大鼠局灶性脑缺血模型前肢运动功能及运动区突触可塑性相关蛋白表的影响[J]. 中国卒中杂志, 2011, 5:388-394.4 谢瑞禄, 孙异临, 郑健, 等. 皮层电刺激联合康复治疗对大鼠脑缺血皮层运动区突触超微结构及结构参数的影响[J]. 中国卒中杂志, 2011, 6:864-868.
5 Benowitz LI, Routtenberg A. GAP-43:an intrinsic determinant of neuronal development and plasticity[J].Trends Neurosci, 1997, 20:84-91.
6 Esdar C, Oehrlein SA, Reinhardt S, et al. The protein kinase C (PKC) substrate GAP-43 is already expressed in neural precursor cells, colocalizes with PKCeta and binds calmodulin[J]. Eur J Neurosci, 1999, 11:503-516.
7 Nakamura F, Strittmatter P, Strittmatter SM. GAP-43 augmentation of G protein-mediated signal transduction is regulated by both phosphorylation and palmitoylation[J]. J Neurochem, 1998, 70:983-992.
8 Palacios G, Mengod G, Sarasa M, et al.Denovosynthesis of GAP-43:in situ hybridization histochemistry and light and electron microscopy immunocytochemical studies in regenerating motor neurons of cranial nerve nuclei in the rat brain[J]. Brain Res, 1994, 24:107-117.
9 Stricker SH, Meiri K, Gotz M. P-GAP-43 is enriched in horizontal cell divisions throughout rat cortical development[J]. Cereb Cortex, 2006, 16:121-131.
10 Rashmi M, Shailesh KG. GAP-43 is key to mitotic spindle control and centrosome-based polarization in neurons[J]. Cell Cycle, 2008, 7:348-357.
11 Mani S, Shen Y, Schaefer J, et al. Failure to express GAP-43 during neurogenesis affects cell cycle regulation and differentiation of neural precursors and stimulates apoptosis of neurons[J]. Mol Cell Neurosci,2001, 17:54-66.
12 Shen Y, Mani S, Meiri KF. Failure to express GAP-43 leads to disruption of a multipotent precursor and inhibits astrocyte differentiation[J]. Mol Cell Neurosci,2004, 26:390-405.
13 黄蕊, 赵君朋, 文玉军, 等. GAP-43高表达转基因小鼠的建立[J]. 首都医科大学学报, 2013, 34:105-109.
14 Skene JH, Virag I. Posttranslational membrane attachment and dynamic fatty acylation of a neuronal growth cone protein, GAP-43[J]. J Cell Biol, 1989,108:613-624.
15 Sanada K, Tsai LH. G protein beta-gamma subunits and AGS3 control spindle orientation and asymmetric cell fate of cerebral cortical progenitors[J]. Cell, 2005,122:119-131.
16 Strittmatter SM, Vartanian T, Fishman MC. GAP-43 as a plasticity protein in neuronal form and repair[J]. J Neurobiol, 1992, 23:507- 520.
17 Ollom CM, Denny JB. A crosslinking analysis of GAP-43 interactions with other proteins in differentiated N1E-115 cells[J]. Int J Mol Sci, 2008, 9:1753-1771.
18 Denny JB. Molecular mechanisms, biological actions,and neuropharmacology of the growth-associated protein GAP-43[J]. Curr Neuropharmacol, 2006,4:293-304.
19 Yang H, Wan L, Song F, et al. Palmitoylation modification of Galpha(o) depresses its susceptibility to GAP-43 activation[J]. Int J Biochem Cell Biol, 2009,41:1495-1501.
20 Arni S, Keilbaugh SA, Ostermeyer AG, et al.Association of GAP-43 with detergent-resistant membranes requires two palmitoylated cysteine residues[J]. J Biochem, 1998, 273:28478-28485.
21 Chakravarthy B, Rashid A, Brown L, et al. Association of GAP-43 (neuromodulin) with microtubuleassociated protein MAP-2 in neuronal cells[J]. Biochem Biophys Res Commun, 2008, 371:679-683.
22 Zhao J, Yao Y, Xu Q, et al. Expression of GAP-43 in fibroblast cell Lines influences the orientation of cell division[J]. Int J Dev Neurosci, 2011, 29:469-74.
23 Miyata T, KawaguchiA, Okano H, et al. Asymmetric inheritance of radial glial fibers by cortical neurons[J].Neuron, 2001, 31 :727 - 741.
24 Zhong WM, Chia W. Neurogenesis and asymmetric cell division[J]. Curr Opin Cell Biol, 2008, 18 :4211-4231.
【点睛】
在GAP-43高表达的转基因小鼠中,发现GAP-43与G蛋白相互作用,并可以改变细胞分裂平面。

敬请关注!《中国卒中杂志》公共微信平台订阅号:CJStroke(安纽医学)

