慢性脑缺血小鼠脑血管形态学变化的活体动态观察
楠迪,郭淮莲,何其华,宋江曼
慢性脑缺血可导致脑白质疏松、胶质细胞增生等病理改变,与血管性痴呆、阿尔茨海默病、Bingswanger病等紧密相关[1-2]。慢性脑缺血后脑血管形态学改变已引起广泛关注[3]。以往对脑缺血后血管形态学改变的研究多采用免疫组化染色等方法观察血管[3],但该方法不能反映活体血管情况。近年来,有学者通过颅窗观察脑缺血后脑血管的改变[4],该方法可以活体动态观察脑血管变化。利用封闭式颅窗活体动态观察脑缺血后血管变化的研究国内尚未见报道。本研究旨在利用封闭式颅窗对小鼠慢性脑缺血后皮层血管变化进行活体动态观察。
1 材料与方法
1.1 实验动物 雄性STOCK Tg(Tie2-GFP)287Sato/J小鼠,购自美国Jackson实验室。共7只,8~12周龄,体重(25±5)g。本研究获得北京大学人民医院实验动物伦理审查委员会的批准。
1.2 试剂与仪器 自酸蚀粘结剂(Heraeus Kulzer,德国);Luxaflow流动树脂(DMG,德国);2.5%水合氯醛。牙科钻(STRONG 207A,Seashin,韩国);体视显微镜(SZXXTWZI,北京泰克汇光);激光共聚焦显微镜(TCS SP5 Confocol,Leica,德国);体温保持装置(BWT-100A,BRC,日本)。
1.3 颅窗制备 小鼠用2.5%水合氯醛(0.35 g/kg体重)腹腔注射麻醉,置于37℃保温垫上。体视显微镜下剪开小鼠左侧颅骨表面皮肤,用牙科水泥将一金属棒固定在小鼠颅骨上,再借金属棒将小鼠头部固定于自制头架上。用牙科钻在左侧颅骨(冠状缝后2.5 mm,矢状缝左2.5 mm)钻一直径约3 mm的圆孔,保持硬脑膜完整。直径3 mm的圆形玻片覆盖暴露的脑表面,用牙科水泥将圆形玻片与周围颅骨固定,制成封闭式颅窗[5]。小鼠麻醉苏醒后放回鼠笼,常规饲养。
1.4 慢性脑缺血模型的建立 颅窗制成2 d后,利用激光共聚焦显微镜经颅窗进行第1次皮层血管观察,当日开始制作脑缺血模型(D0)。采用左侧颈总动脉永久结扎结合右侧颈总动脉隔日短暂结扎的改良慢性脑缺血模型。
在D0将小鼠用2.5%水合氯醛腹腔注射麻醉,仰卧固定于37℃保温垫上,取颈部正中切口,剪开浅筋膜,钝性分离暴露左侧颈总动脉,用4-0丝线永久结扎左侧颈总动脉,缝合皮肤,苏醒后放回鼠笼常规饲养。3 d后(D3)再次麻醉小鼠,钝性分离右侧颈总动脉,4-0丝线结扎右侧颈总动脉10 min后松解丝线恢复血流,缝合皮肤,苏醒后放回鼠笼饲养。此后2 d(D5)再次右侧颈总动脉结扎10 min后恢复血流,缝合皮肤,苏醒后放回鼠笼饲养。每次术后给予适量庆大霉素。
1.5 激光共聚焦显微镜观察皮层血管 分别于左侧颈总动脉结扎前(D0)及左侧颈总动脉结扎后7 d(D7),利用激光共聚焦显微镜通过颅窗观察皮层血管。
已制备颅窗的小鼠,水合氯醛腹腔注射麻醉,头部固定于自制小鼠头架上。激光共聚焦显微镜获取活体脑血管图像。扫描参数:激发光波长(488 nm),10×物镜,扫描厚度2.0 μm。使用LAS AF操作软件,在Z轴进行连续扫描,扫描深度为皮层表面以下100 μm内。每个小鼠颅窗在10倍镜下扫描后,选取两个感兴趣区域(region of interest,ROI),再40倍镜下分别扫描选定的2个ROI。分别在D0和D7对同一ROI进行激光共聚焦扫描,比较脑缺血前后皮层血管变化。D0或D7颅窗模糊者剔除。
1.5.1 毛细血管密度与直径测量 本研究中毛细血管定义为直径<8 μm的血管[6]。
毛细血管密度定义为每个ROI内毛细血管数目[5]。
毛细血管直径测量:每个ROI随机取3支毛细血管,每支毛细血管取10个不同位点测量直径,取其平均代表该毛细血管直径[7]。3支毛细血管直径的平均值作为该ROI毛细血管直径。
毛细血管又分为分支毛细血管、网状毛细血管、集合毛细血管及细动静脉直通支[8-9],分别对各类毛细血管进行测量。各类毛细血管的划分标准为:网状毛细血管:互相吻合呈网状,走行弯曲,柔软,圆滑;分支毛细血管:位于网状毛细血管上游,细动脉下游,管径细,走行直;集合毛细血管:数个网状毛细血管汇集而成,管径较前粗,弯曲,途径较短;细动静脉直通支:细动脉与细静脉间的直接通路[8]。
1.5.2 细动脉及细静脉直径测量 细动脉为小动脉的进一步分支,直径15~30 μm,管壁较厚,走行较直。细静脉定义为分段汇集多个毛细血管,直径15~50 μm,管壁较薄,走行弯曲[8]。
细动脉和细静脉直径测量:测同一血管上10个不同位点的直径,取其平均值为该血管直径。
1.6 统计学分析 采用Excel软件建立数据库,Graph Pad 5.0软件进行统计学分析。计量资料符合正态分布采用“均数±标准差”表示,两组间比较用配对样本t检验,P<0.05为差异有显著性。使用LAS AF软件进行血管直径测量与计数。
2 结果
2.1 脑缺血后毛细血管直径的改变 缺血前(D0)和缺血后7 d(D7)毛细血管直径分别是(6.62±0.75)μm 和(12.50±3.29)μm。D7毛细血管直径较D0毛细血管直径明显扩大(t=6.415、P<0.001),差异具有显著性(图1)。
2.2 脑缺血后毛细血管密度观察 脑缺血前(D0)和脑缺血后7 d(D7),毛细血管密度分别为每ROI(11.67±1.72)个和每ROI(11.08±2.06)个,差异无显著性(t=1.681、P=0.0583)(图1)。
2.3 脑缺血后不同种类毛细血管直径的改变对分支毛细血管、集合毛细血管、网状毛细血管以及细动静脉直通支直径的测量结果见表1。
2.4 脑缺血后皮层细动脉与细静脉直径变化细动脉直径在D0(缺血前)和D7(缺血后7 d)时分别是(12.71±2.10)μm和(13.20±3.09)μm(t=0.5533、P=0.2947)。与D0相比,D7时细动脉直径增加了3.85%,差异无显著性。D7时未观察到细动脉有新生血管或出芽改变(图2)。
细静脉直径在D0和D7时分别为(19.59±8.74)μm和(24.81±6.25)μm(t=3.060、P=0.0054)。与D0相比,D7时细静脉直径增加了26.65%,差异有显著性。脑缺血后7 d时(D7)观察到细静脉走行迂曲,管壁变薄(图2)。
表1 各类毛细血管直径D0与D7比较(s)(μm)

表1 各类毛细血管直径D0与D7比较(s)(μm)
注:细动静脉直通支、网状毛细血管:n=7,分支毛细血管、集合毛细血管:n=9
D0 D7 t P分支毛细血管 6.33 0.94 12.36 3.20 5.453 0.0003集合毛细血管 6.87 1.10 12.37 2.78 6.203 0.0001网状毛细血管 6.37 0.52 11.41 3.10 4.168 0.0029细动静脉直通支 6.35 0.92 13.91 6.17 3.138 0.0101
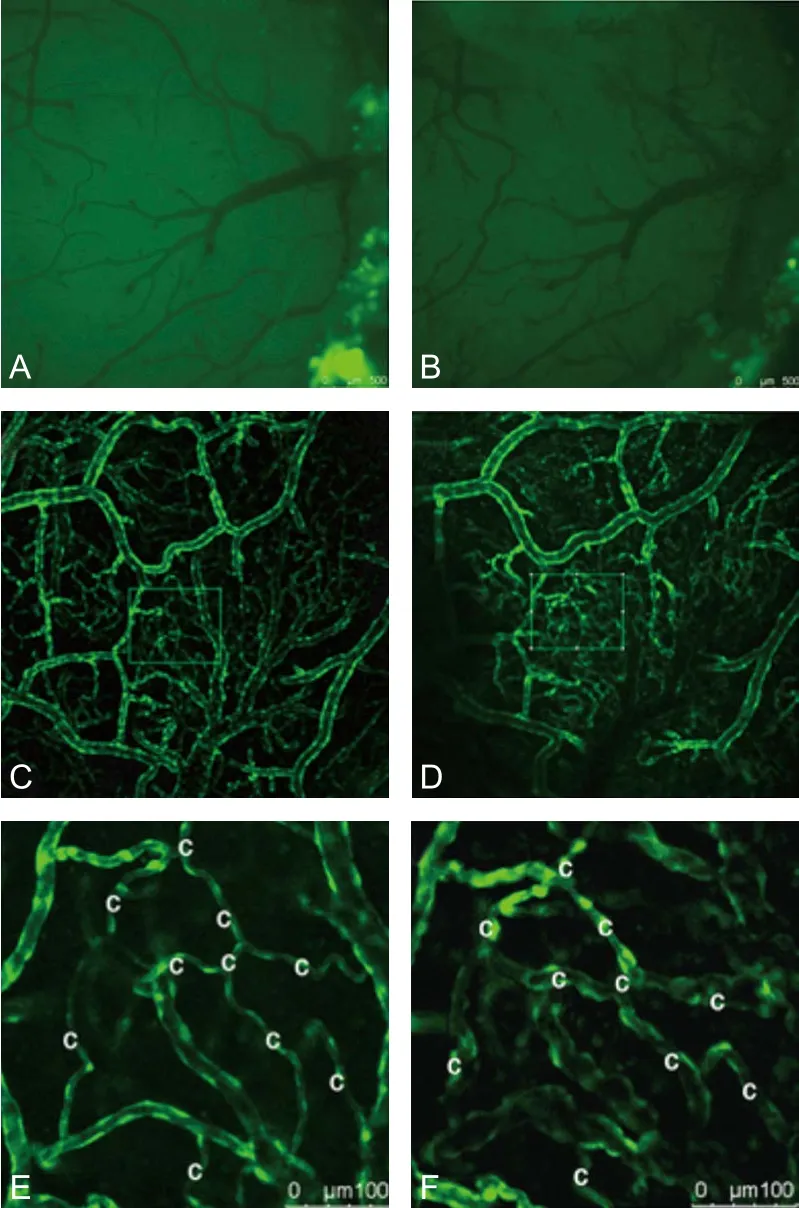
图1 同一小鼠缺血前(D0)和缺血后7 d(D7)同一ROI内血管直径与密度变化注:图A、C、E分别为D0时颅窗影像、10×血管影像及40×血管影像(ROI);B、D、F分别为D7时的颅窗影像、10×血管影像及40×血管影像(ROI)。图示脑缺血后7 d(图F)与缺血前(图E)相比毛细血管直径明显扩张,毛细血管密度无明显变化。c:毛细血管;ROI:感兴趣区域
2.5 血管重构 比较缺血前(D0)和缺血后7 d(D7)相同区域皮层血管,发现缺血7 d后并未见到明显新生血管或血管生芽。但是,在低倍镜下可见小动静脉走行改变,管径扩大,小静脉间吻合支的开放(图3,红色箭头)。在高倍镜下,可见毛细血管走行改变(图3,白色箭头)。
3 讨论
脑缺血后血管形态学研究,以前多采用脑组织切片染色方法显示血管[3],该方法不能反映活体血管情况。近年来,小鼠封闭式颅窗已成为一种活体观察脑血管的独特工具,制备封闭式颅窗的小鼠可长期存活,颅窗内血管可反复观察,适宜于研究血管的动态变化[10-11]。Tomita及Toriumi等应用封闭式颅窗对小鼠大脑皮层血流及血管形态变化进行了长期观察[10,12]。本研究中,我们应用小鼠封闭式颅窗技术观察了脑缺血后皮层血管形态的变化,国内尚未见到相关报道。
双侧颈总动脉结扎和单侧颈总动脉结扎均为较常用的慢性脑缺血模型[13-14]。双侧颈总动脉永久结扎模型多用于大鼠慢性脑缺血研究[13]。因大鼠前循环与后循环交通支发达,双侧颈总动脉结扎后,其脑血流量可经椎动脉与Willis环代偿。小鼠的交通支不发达,小鼠双侧颈总动脉结扎法死亡率高,因此单侧颈总动脉结扎制备小鼠慢性脑缺血模型较普及[14]。在前期的实验中我们发现,双侧颈总动脉结扎后小鼠3 h内死亡率为100%。本研究采用左侧颈总动脉永久结扎结合右侧颈总动脉隔日短暂结扎方法制作小鼠慢性脑缺血模型,脑缺血程度较单侧颈总动脉结扎重,小鼠可存活(结果另文发表)。

图2 脑缺血前后细动脉和细静脉的变化,40×注:图中可见脑缺血后细静脉直径增加,走行迂曲;细动脉直径无明显变化。图A为缺血前(D0),图B为缺血后(D7)。a:细动脉;c:毛细血管;v:细静脉
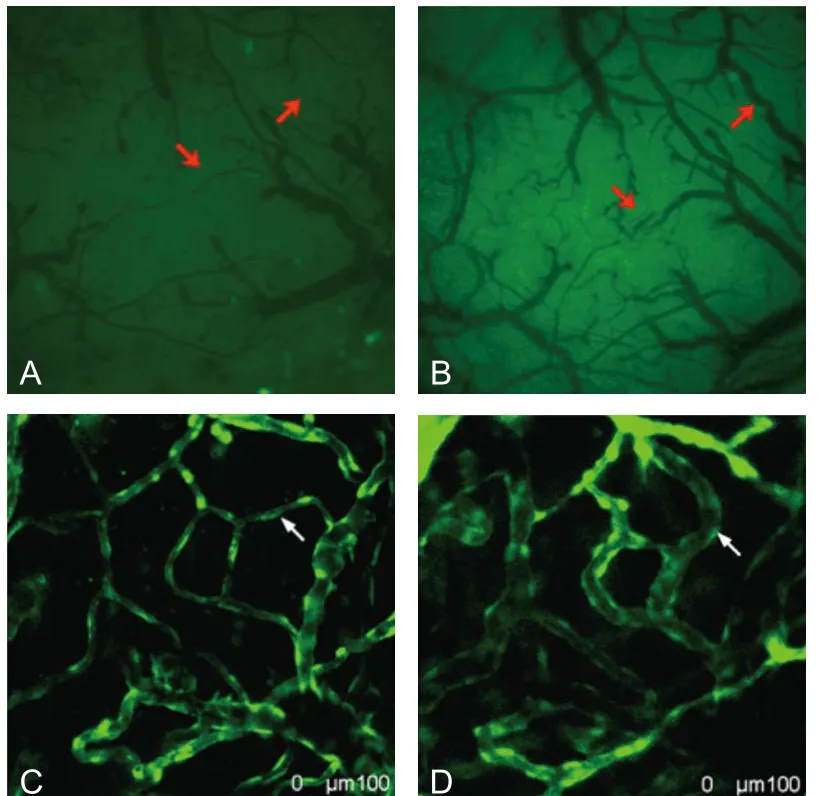
图3 脑缺血后血管重构注:图A、B分别为同一颅窗缺血前及缺血后7 d时颅窗影像,红色箭头示吻合支开放。图C、D分别为同一ROI缺血前及缺血后7 d时血管影像(40×),白色箭头示毛细血管走行改变。ROI:感兴趣区域
利用激光共聚焦显微镜和封闭式颅窗技术,本研究观察到慢性脑缺血7 d后毛细血管直径明显扩张,提示毛细血管扩张可能是慢性脑缺血后脑血流恢复的机制之一。Guo等[5]研究也发现小鼠脑缺血14 d后皮层毛细血管扩张,本研究结果与之一致。
Guo[5]及Tajima等[15]分别观察了小鼠单侧颈总动脉结扎后14 d以及28 d皮层表面以下100 μm以及300 μm血管,未见到血管新生或出芽。Yoshihara等利用光照法制造小鼠局灶性脑缺血模型,观察皮层表面以下300 μm内血管,缺血后7~28 d未发现血管新生或出芽改变[7]。不过,Masamoto等对慢性缺氧小鼠的研究中,观察到皮层毛细血管出芽及新生现象,观察深度为皮层表面以下300~800 μm[16-17]。本研究未观察到脑缺血后血管新生现象,与Guo[5]、Tajima[14]及Yoshihara[7]等的研究结果一致,与Masamoto[16-17]等的研究结果不同。脑缺血后脑内是否发生血管新生各家报道不同,考虑与观察深度及缺血时间不同有关:Guo、Tajima、Yoshihara和Masamoto的缺血时间分别为14 d、28 d、7~28 d及14~28 d,观察深度分别为皮层表面以下100 μm以内、300 μm以内、300 μm以内及300~800 μm[5,7,15-17]。脑缺血后脑内是否发生血管新生仍需进一步研究证实。
在微循环中血液从动脉到静脉的流动有3条通路:①血流从细动脉向分支毛细血管、网状毛细血管、集合毛细血管、细静脉方向流动;②血流从细动脉向分支毛细血管、毛细血管直通支、集合毛细血管、细静脉方向流动;③血流从细动脉向动静脉短路支、细静脉方向流动[8]。本研究观察到脑缺血后连接细动静脉的动静脉直通支较其他种类毛细血管扩张明显,同时部分网状毛细血管分支出现狭窄,变细,甚至消失的现象。这些改变可能为毛细血管单元在脑血流减少时发生血管重构的动态过程。
本研究首次观察了脑缺血后毛细血管前后的细动静脉的直径变化,结果显示,慢性脑缺血7 d后,细动脉与细静脉直径分别增加了3.85%和26.65%,提示脑缺血后细静脉扩张较细动脉明显。
Tajima等[15]发现小鼠慢性脑缺血时细动脉对脑血流以及血压的调节起到主要作用。Joseph等[18]研究发现,大鼠脑血流阻力的改变与血管直径相关,动脉扩张时阻力降低;动脉血流阻力下降时,静脉的顺应性缓慢增高。因此作者推测,当脑灌注压降低时,细动脉发生扩张以减小血管阻力,调节脑血流量,而细静脉在细动脉扩张后顺应性增强,也发生扩张性改变。由于细静脉的管壁较薄,在相同的缺血条件下,扩张较细动脉更显著。
由于本研究存在观察时间偏短,观察皮层深度有限等不足,今后有必要延长脑缺血时间并增加观察深度进一步研究。
1 Shibata M, Ohtani R, Ihara M, et al. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion[J]. Stroke, 2004,35:2598-2603.
2 赵颖, 王苹, 康立源. 慢性脑缺血病理机制与实验研究进展[J]. 中国临床药理学杂志, 2005, 21:384-386.
3 Kanaan A, Farahani R, Douglas RM, et al. Effect of chronic continuous or intermittent hypoxia and reoxygenation on cerebral capillary density and myelination[J]. Am J Physiol Regul Integr Comp Physiol, 2006, 290:R1105-R1114.
4 Tennant KA, Brown CE. Diabetes augments in vivo microvascular blood flow dynamics after stroke[J]. J Neurosci, 2013, 33:19194-19204.
5 Guo H, Itoh Y, Toriumi H, et al. Capillary remodeling and collateral growth without angiogenesis after unilateral common carotid artery occlusion in mice[J].Microcirculation, 2011, 18:221-227.
6 Boero JA, Ascher J, Arregui A, et al. Increased brain capillaries in chronic hypoxia[J]. J Appl Physiol, 1999,86:1211-1219.
7 Yoshihara K, Takuwa H, Kanno I, et al. 3D analysis of intracortical microvasculature during chronic hypoxia in mouse brains[J]. Adv Exp Med Biol, 2013, 765 :357-363.
8 刘育英. 微循环图谱[M]. 北京:人民军医出版社, 2005:3-4.
9 田牛. 微循环[M]. 北京:科学出版社, 1980:16-19.
10 Tomita Y, Pinard E, Tran-Dinh A, et al. Long-term,repeated measurements of mouse cortical microflow at the same region of interest with high spatial resolution[J]. Brain Res, 2011, 1372:59-69.
11 Tomita Y, Kubis N, Calando Y, et al. Long-term in vivo investigation of mouse cerebral microcirculation by fluorescence confocal microscopy in the area of focal ischemia[J]. J Cereb Blood Flow Metab, 2005, 25:858-867.
12 Toriumi H, Tatarishvili J, Tomita M, et al. Dually supplied T-junctions in arteriolo-arteriolar anastomosis in mice:key to local hemodynamic homeostasis in normal and ischemic states?[J]. Stroke, 2009, 40:3378-3383.
13 Farkas E, Luiten PG, Bari F. Permanent, bilateral common carotid artery occlusion in the rat:a model for chronic cerebral hypoperfusion-related neurodegenerative diseases[J]. Brain Res Rev, 2007,54:162-180.
14 Jiwa NS, Garrard P, Hainsworth AH. Experimental models of vascular dementia and vascular cognitive impairment:a systematic review[J]. J Neurochem, 2010,115:814-828.
15 Tajima Y, Takuwa H, Kokuryo D, et al. Changes in cortical microvasculature during misery perfusion measured by two-photon laser scanning microscopy[J].J Cereb Blood Flow Metab, 2014, 34:1363-1372.
16 Masamoto K, Takuwa H, Tomita Y, et al. .Hypoxiainduced cerebral angiogenesis in mouse cortex with two-photon microscopy[J]. Adv Exp Med Biol, 2013,789:15-20.
17 Masamoto K, Takuwa H, Seki C, et al. Microvascular sprouting, extension, and creation of new capillary connections with adaptation of the neighboring astrocytes in adult mouse cortex under chronic hypoxia[J]. J Cereb Blood Flow Metab, 2013, 34:325-331.
18 Mandeville JB, Marota JJ, Ayata C, et al. Evidence of a cerebrovascular postarteriole windkessel with delayed compliance[J]. J Cereb Blood Flow Metab, 1999,19:679-689.
【点睛】
本研究通过慢性脑缺血模型发现慢性脑缺血后皮层血管发生毛细血管扩张(细动静脉直通支扩张最为明显)、细静脉扩张等改变,上述改变可能有助于调节脑血流量。

