延边黄牛SREBP1和SCD1基因表达的发育性变化及与肌间脂肪含量的关联分析
■金世杰 李香子 高青山 周 宁 李庚灿 尹云厚 严昌国
(1.延边大学农学院,吉林延吉133002;2.贵州民族大学,贵州贵阳550000)
延边黄牛是我国的五大地方良种牛之一,肉质风味独特。本研究以延边黄牛为试验动物,以在各组织中都恒量表达的GAPDH基因为内参基因,运用实时荧光定量RT-PCR方法,研究在延边黄牛肌肉组织SREBP1和SCD1基因表达的发育性变化,为进一步阐明延边黄牛肌内脂肪沉积,丰富遗传机制提供理论依据。SREBP基因作为核转录因子(Yokoyama等,1993)[1],目前已经被确定为在酯类合成中,尤其是固醇类和脂肪酸合成中的重要转录调节因子。SREBP1基因作为转录调节因子家族成员之一,在调控脂肪沉积的同时,还可以调节SCD1基因以及其他肌内脂肪生成相关基因的表达水平,从而间接参与脂肪代谢和其生物合成[2]。SCD基因是合成单不饱和脂肪酸MUFA的限速酶,SCD1作为催化饱和脂肪酸去饱和化的关键酶对牛脂肪组织中脂肪酸的组成以及肌肉间脂肪沉积有着重要影响[3-4]。因此,SREBP1及SCD1基因可作为影响肌内脂肪沉积的重要遗传标记,研究其表达水平对改善牛肉品质及选育优良品种提供可借鉴的遗传学资料。
1 材料与方法
1.1 试验动物及样品采集
试验动物选自延边大学农学院牧场,健康无病的12月龄延边黄牛(去势)8头,试验动物被分为2组,每组4个重复,所有个体生活环境一致,接受常规免疫程序。组织样品采用微量微创活体采样枪(韩国忠北大学提供)方法采集,采集部位为臀部肌肉组织。取样后迅速放入液氮保存,以备提取总RNA。
1.2 实时荧光定量PCR分析
1.2.1 实验器皿处理
不同时期肉样所用的采样器具及金属盒玻璃器要分别进行无RNAase处理,不可混用。塑料试管、吸头等用0.1%DEPC水浸泡24 h以上,然后进行高压、烘干待用。
1.2.2 总RNA的提取和纯化
将肉样放入研钵中加入液氮充分研磨,按Trizol Regent Kit说明书提取总RNA。
1.2.3 mRNA实时荧光定量
引物的设计与合成目的基因引物序列根据Gen-Bank上公布的牛LPL序列进行设计以GAPDH作为内参基因(见表1),引物由上海生工生物技术有限公司合成。

表1 用于扩增延边黄牛基因片段的实时荧光定量PCR引物
1.2.4 反转录反应
利用Taraka公司的Prime Script RT-PCR试剂盒进行反转录操作,整个过程全部在冰上完成,根据反转录试剂盒使用说明书,建立20 μl反转录体系。
1.2.5 PCR的扩增反应
试验采用定量的引物来进行常规的PCR扩增,反应体系为20 μl(见表2),整个操作在冰上完成。

表2 PCR扩增反应体系
PCR反应程序为:95℃预变性4 min,95℃变性30 s,引物的复性温度根据所有引物退火温度范围设置梯度,均在55~60℃之间,持续时间为30 s,72℃延伸30 s,40个循环,最后72℃延伸10 min,4℃保存,结束反应。
1.2.6 扩增片段的回收及序列分析
用2%的琼脂糖凝胶电泳将上述产物分离,利用DNA回收试剂盒(Bioteke Corporation)将目的片段回收,通过Blast程序和DNAman软件分析发现测序结果与Genbank中发表的相应序列相同。
1.2.7 实时荧光定量PCR
根据引物退火温度,在实时荧光定量PCR仪上设置55~60℃,5个温度梯度,观察其溶解曲线及扩增曲线,找出3个基因适宜的反应温度。采用SYBR Premix Ex TaqTMⅡ(TaKaRa)对LPL和GAPDH基因进行扩增,反应体系如表3所示。反应条件为预变性95 ℃、15 s;变性95 ℃,5 s;复性60 ℃,30 s,(40个循环);95 ℃,60 s;60℃,60 s。扩增结束后进行溶解曲线及结果分析,60℃,10 s(71个循环)。

表3 荧光定量PCR反应体系
1.2.8 数据处理
根据荧光定量PCR检测出的内参基因和目的基因,利用2-ΔΔCt方法分析基因的相对表达差异量,试验数据一律采用统计软件SAS(V8.0)中的一般线性模型(GLM)模块来进行单因素方差分析。表中结果为“平均数±标准差”,P<0.05为结果差异显著。
1.3 IMF含量的测定
用索氏抽提法测定IMF含量。
2 结果与分析
2.1 RNA及目的基因片段检测结果
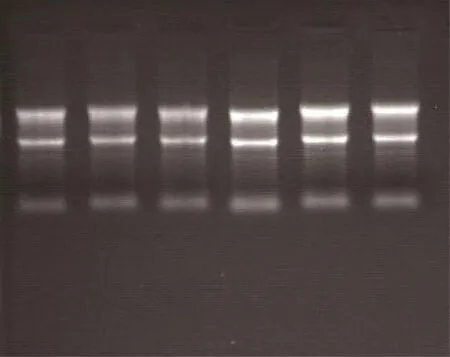
图1 RNA琼脂糖凝胶电泳
由图1可见,将提取的不同部位肌肉组织总RNA进行电泳,将每个阶段不同部位样品总RNA分别经紫外分光光度计分析,所有样本D260/D280均在1.8~2.0。电泳结果表明,RNA分子保持完整RNA质量符合实时荧光定量PCR实验的要求。
常规PCR产物检测,1%的琼脂糖凝胶电泳检测结果如图2所示。泳道1为SREBP1基因,泳道2为SCD1基因,泳道3为GAPDH基因,3个基因的PCR扩增产物条带明亮、清晰无杂带,片段大小均在设计长度范围内,说明本实验设计的引物具有很高的特异性,测序结果与目的序列一致性为100%,为目的基因片段。
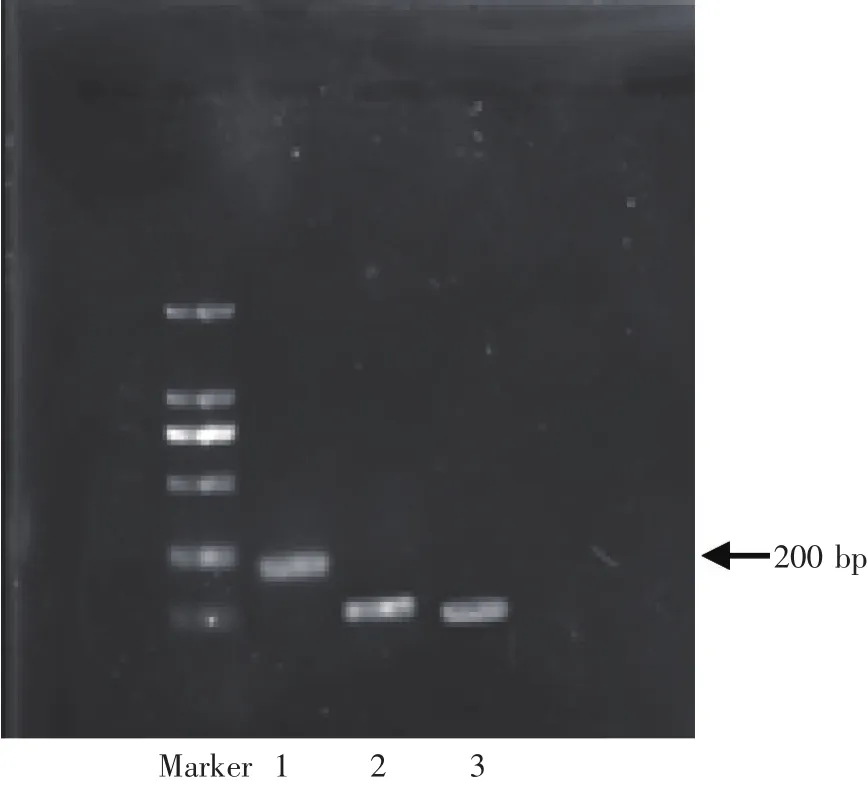
图2 常规PCR产物检测琼脂糖凝胶电泳
2.2 扩增产物特异性
SREBP1、SCD1和GAPDH基因的标准曲线均在模板浓度为10~10-3的范围内构建。SREBP1、SCD1和GAPDH基因的标准曲线如图3~图5所示,从图中可以看出,目的基因和内参基因的阈值循环数(Ct值)与起始模板对数呈线性关系,其相关系数分别为0.998和1.000,线性关系较好,这有利于采用Ct值基因进行准确的定量,同时这也是本试验的重要参数。SREBP1、SCD1和GAPDH基因的熔解曲线如图6~图8所示,从图中可以看出,目的基因的溶解曲线上未见杂峰,内参基因有杂峰信号出现,可能是引物二聚体或者是非特异性扩增产物,但它们的量与扩增子相比显得非常少,所以对定量结果影响不大。SREBP1、SCD1和GAPDH基因的扩增曲线如图9~图11所示,横坐标为待测样品循环数,纵坐标为荧光强度。Ct是在荧光强度有统计学意义上的增加能被检测得到时所对应的循环数。扩大曲线图反映了循环过程中荧光值的变化,即每个循环Ct值与起始模板浓度的对数成反比。
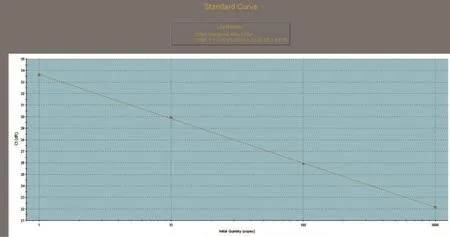
图3 SREBP1标准曲线
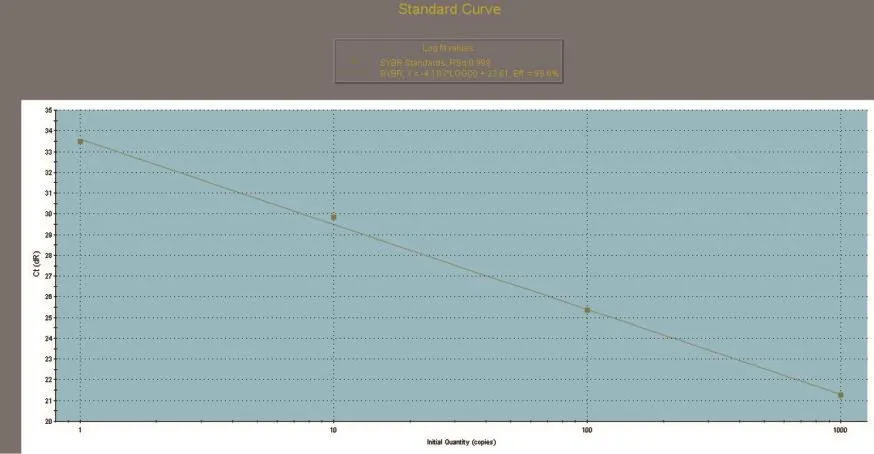
图4 SCD1标准曲线
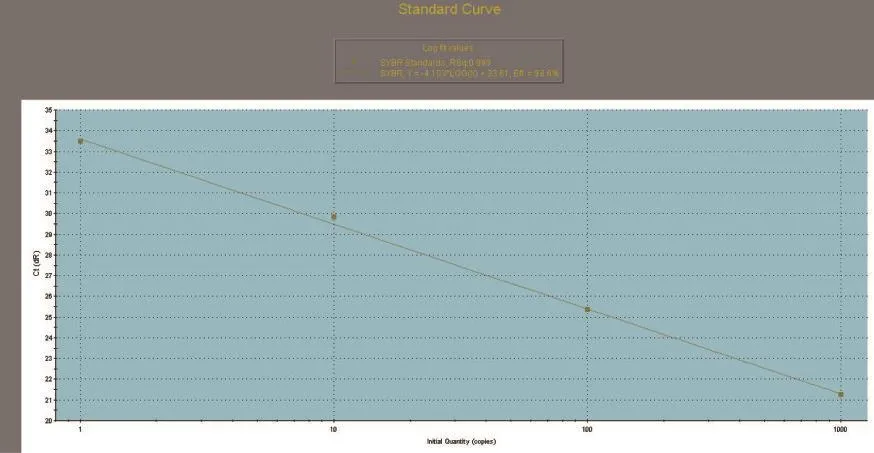
图5 GAPDH标准曲线
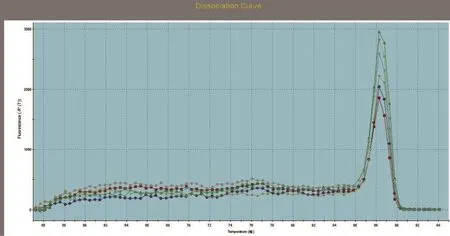
图6 SREBP1溶解曲线
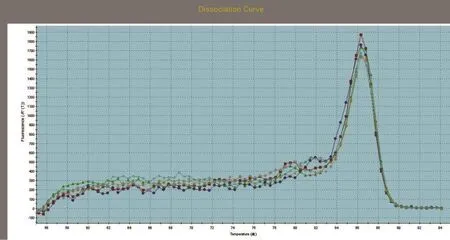
图7 SCD1溶解曲线
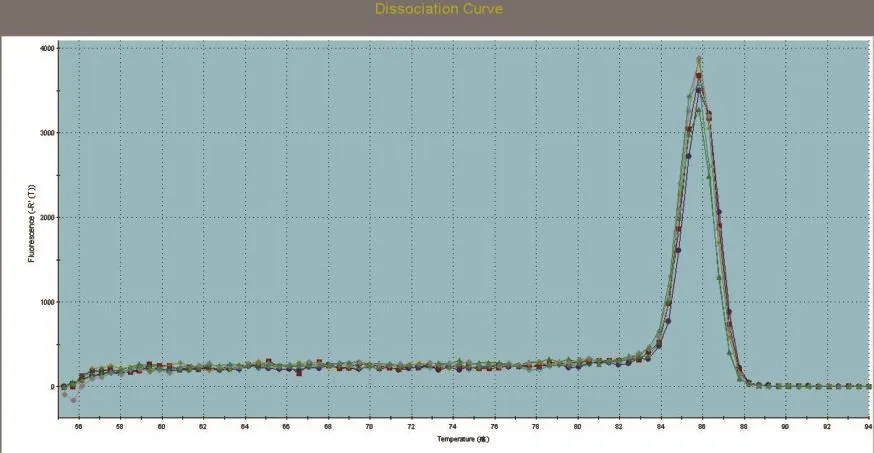
图8 GAPDH溶解曲线
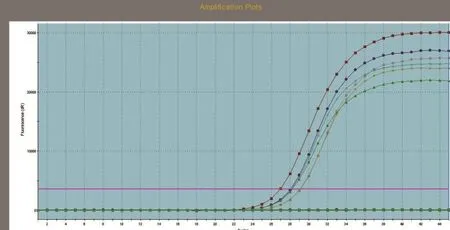
图9 SREBP1扩增曲线
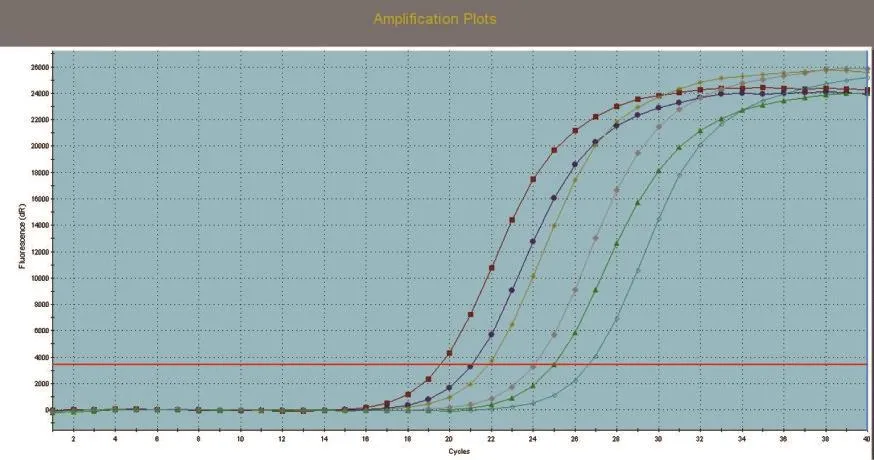
图10 SCD1扩增曲线
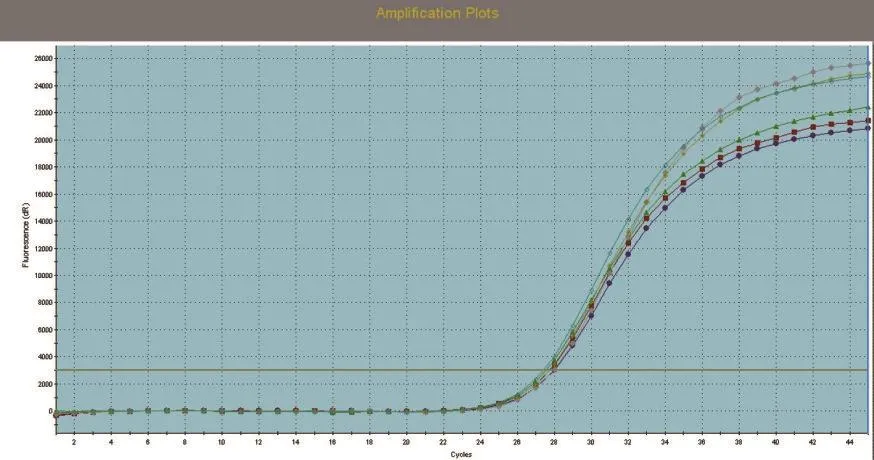
图11 GAPDH扩增曲线
2.3 SREBP1基因相对表达变化(见图12)
从图12可以看出:SREBP1基因相对表达水平在12、16、20月龄具有及其显著差异(P<0.01),其中20月龄时SREBP1基因表达量相对最高。
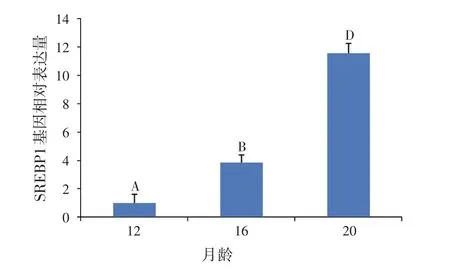
图12 延边黄牛SREBP1基因表达的发育性变化
2.4 SCD1基因相对表达变化(见图13)
从图13可以看出:SCD1基因相对表达水平在12、16、20月龄具有显著差异(P<0.05),其中20月龄时SCD1基因表达量相对最高。
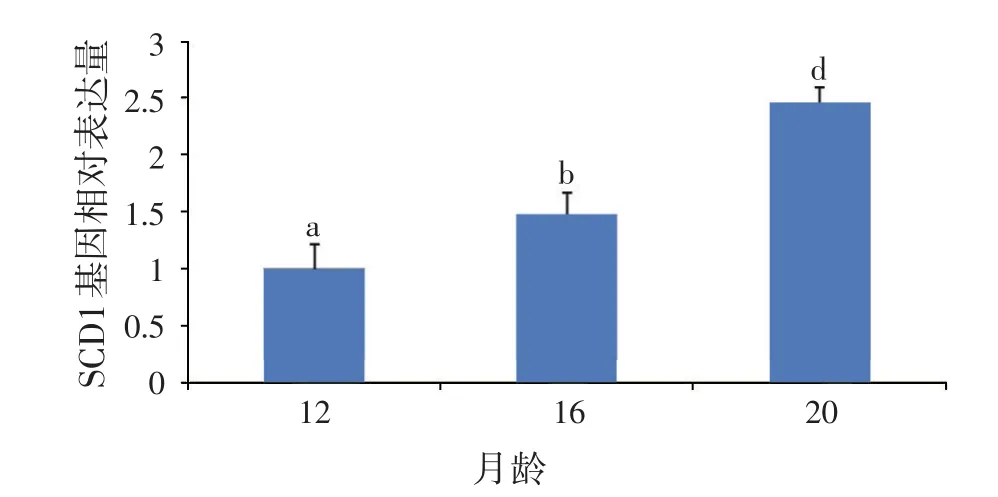
图13 延边黄牛SCD1基因表达的发育性变化
2.5 不同生长阶段相同部位肌肉IMF的变化(见表4)

表4 延边黄牛相同部位不同月龄IMF变化(%)
从表4可以看出,IMF在12、16、20月龄具有显著差异(P<0.05),其中20月龄时IMF相对最高。
2.6 不同生长阶段相同部位肌肉SREBP1和SCD1基因的表达与IFM含量的相关分析
肌肉组织中SREB1基因的表达量在12~20月龄期间与IMF含量具有正向相关性,相关系数为0.910(P<0.05);SCD1基因的表达量在12~20月龄期间与IMF含量具有正向相关性,相关系数为0.934(P<0.05)。
3 讨论
3.1 SREBP1基因的表达以及与IMF含量的关联分析
Sun等(2002)通过蛋白印迹等方法检测转SREBP1基因小鼠肾脏皮质产物发现SREBP1蛋白表达相比对照组上调了大约8倍[10],Horton等(2003)通过对SREBP1基因过表达小鼠研究还发现了SREBP1基因过表达会导致小鼠脂肪组织中脂肪细胞肥大、增加细胞内脂肪酸的分泌并使小鼠患上脂肪肝,进一步证明SREBP-1是直接参与脂肪代谢调控途径的[11]。脂代谢是体内脂肪含量多少及成分差异的重要代谢性因素。郝军等(2010)研究表明,在人肾小管上皮细胞内过表达SREBP1基因后,发现在肾小管上皮细胞内出现了明显的甘油三酯沉积现象,并检测到SREBP1蛋白和其mRNA的高水平表达[5],这一现象说明SREBP1基因是甘油三酯代谢中的重要调控因子,并且SREBP1在转录水平上可能是调控多个脂质代谢的关键因素之一(McPherson等,2004)[6]。Zhao等(2012)研究发现,SREBP1基因还能够通过胰岛素信号通路对脂质代谢进行调节[7]。牛SREBP1基因与人类SREBP/a相似度最高。我们的研究结果表明,延边黄牛SREBP1基因相对表达水平在12、16、20月龄差异极显著,其中20月龄时SREBP1基因表达量达到最高,说明延边黄牛不同生长阶段SREBP1基因相对表达水平是不同的。本试验中SREBP1基因的表达量在12~20月龄期间与IMF含量具有正向相关性,这与徐丽等(2013)对SREBP1基因过表达可增加牛胎儿骨骼肌成纤维细胞内脂肪的合成的结果相近[9]。我们的试验结果表明SREBP1基因表达与延边黄牛脂肪代谢之间存在一定关系。
3.2 SCD1基因的表达及其与IMF含量的关联分析
硬脂酰辅酶A去饱和酶1对酶的催化活性至关重要[13],是饱和脂肪酸生成单不饱和脂肪酸过程中的限速酶,单不饱和脂肪酸的含量对牛肉的质量至关重要,影响牛肉大理石花纹等级,深加工性能脂肪柔软度以及肉的风味等[12]。Taniguchi等(2004)研究表明SCD1基因的表达对日本黑牛胴体IMF组成和含量影响显著[14]。Barton等认为捷克西门塔尔公牛SCD1基因的表达与C14∶1和C18∶1脂肪酸的含量以及肌间脂肪含量关系显著[17]。Jiang等在Wagyu牛和Limousin牛杂交群体中发现,SCD1基因3个SNP都与SCD酶活性参数显著相关,与骨骼肌中6个脂肪沉积、脂肪酸组成的性状也显著相关[18]。我们的研究结果表明,延边黄牛SCD1基因相对表达水平在12、16、20月龄差异显著,其中20月龄时SREBP1基因表达量达到最高,说明延边黄牛不同生长阶段SCD1基因相对表达水平是不同的。从本次研究的结果还可以看出SCD1基因的表达量在12~20月龄期间与IMF含量具有正向相关性,这与武秀香等(2011)报道的相近[8],说明SCD1基因表达对肌间脂肪性状而言是有利基因。
3.3 SREBP1与SCD1的协同表达
REBP-1是目前在哺乳动物体内发现的SREBPs的3个亚型之一,主要负责调节脂肪酸和甘油三酯的代谢[20]。SREBP-1可激活下游多种参与脂肪酸和甘油三酯合成酶的转录,包括SCD-1脂肪酸合成酶乙酰辅酶A羧化酶等,导致脂肪酸合成增加,造成肝脏脂质蓄积[21],而抑制SREBP-1可以逆转肝脏脂肪变性[22]。SCD-1作为SREBP-1调控的下游基因,当SREBP-1c转录因子与SCD-1的启动子结合后,可上调SCD-1基因转录,最终导致脂质合成增加[26]。本实验中SREBP1和SCD1在延边黄牛肌肉中表达存在显著正相关,这一结果验证了徐拥建等(2014)通过抑制NAFLD大鼠肝细胞SREBP-1/SCD-1信号通路激活,使TC、TG合成减少的相关报道[27],说明SREBP-1/SCD-1的协同表达对延边黄牛肌间脂肪沉积具有一定影响,不过这也可能是多途径多层次多环节不同机理作用交汇调控的结果,所以有关详细机制仍有必要作进一步的研究和探讨。
4 结论
①SREBP1和SCD1基因相对表达量在延边黄牛不同生长阶段存在显著或极显著差异。
②SREBP1和SCD1基因的协同表达对延边黄牛不同生长阶段肌内脂肪的沉积有一定的正向调控作用。

