菌丝霉素NZ2114基因在毕赤酵母中表达及中试发酵研究
■ 叶 滔 杨静美 闫 凯 冯 蓓 逯佩凤 孙丹丹 周玉岩
(1.广东海纳川生物科技股份有限公司,广东佛山528515;2.广东省兽药与饲料添加剂工程技术研发中心,广东佛山528515;3.仲恺农业工程学院,广东广州 510225)
防御素(defensin)是广泛存在于生物体中的一类内源性抗菌肽(antibacterial peptide),在一定诱导条件下,由宿主细胞特定编码基因产生的对抗外源性病原微生物的小分子肽类活性物质。它具有广泛的杀菌活性、细胞毒性和免疫趋化活性,是机体天然免疫系统的重要组成部分[1]。防御素作用机理独特,它主要作用于病原菌的细胞膜,因此不易产生耐药性。另外,研究发现,防御素还可以作为一种效应分子,激活和调节免疫系统,参与胞内信号转导,具有抗细菌、抗真菌、抗病毒、抗肿瘤功能,有望在抵御病原菌感染中显示巨大的潜力和广阔的应用前景[2]。
菌丝霉素(Plectasin)是Mygind等(2005)研究小组通过筛查腐生子囊菌(the saprophytic ascomycete Pseudoplectania nigrella)分泌蛋白的cDNA库,从中找出一些与无脊柱动物防御素序列高度相似的片段,并筛选分离出来的首例真菌防御素[3]。防御素新药研发工作一直进展缓慢,主要障碍就是它们在大规模生产时成本过高。Plectasin的发现打破了一直局限在高等生物,如哺乳动物、昆虫和植物中分离防御素的现状,将防御素的来源拓展到具有广阔开发前景的低等生物真菌中,从真菌中提取防御素获得成功,必将大幅降低防御素类抗菌药物的研究和生产成本,从而加速这类新型抗菌药物的开发和应用,具有重要意义[2]。
图1 Plectasin与几种无脊椎动物防御素的相似性
目前制备大量的防御素是研究和应用的前提,其主要途径有三个:①天然提取;②化学合成;③基因工程表达技术。前两种方法工艺复杂、成本高,只能满足研究所需要的样品量,难以工业化生产。基因工程表达技术可以用于表达重组肽,且具有低成本、表达产物活性高的优势,是目前获取大量外源蛋白的有效方法。因此,本研究采用基因工程技术,尝试在毕赤酵母中通过组成型分泌到胞外的方式表达重组肽菌丝霉素NZ2114,并进行重组肽菌丝霉素NZ2114表达的50 L发酵罐规模中试研究,研究其体外抗菌活性鉴定,为其在规模化生产和应用提供前期基础和依据。
1 材料与方法
1.1 试验材料
菌丝霉素NZ2114基因,由上海捷瑞生物工程有限公司合成。
载体pPicZα,由暨南大学医药生物技术研究开发中心惠赠。
毕赤酵母GS115,由暨南大学医药生物技术研究开发中心惠赠。
受试菌:金黄色葡萄球菌CMCC26003,由华中农业大学兽医药理实验室惠赠。
MHB培养基:MHB肉汤培养基21 g溶于1 L蒸馏水中,充分溶解后,121℃高压蒸汽灭菌20 min。
LB琼脂培养基:酵母提取物5 g、胰蛋白胨10 g、NaCl 10 g,定容至1 L,121℃高压蒸汽灭菌20 min。配置LB固体培养基时,加入1.5%的琼脂粉,121℃高压蒸汽灭菌20 min。
BMGY培养基:酵母提取物10 g、蛋白胨20 g,定容至700 ml,121℃高压蒸汽灭菌20 min后,添加灭菌的10%甘油100 ml,13.4%无氨基酸酵母氮源(YNB)100 ml,0.02%生物素2 ml,1 mol/l磷酸缓冲液pH值6.0 100 ml。
BMMY培养基:酵母提取物10 g、蛋白胨20 g,定容至700 ml,121℃高压蒸汽灭菌20 min后,添加灭菌的5%甲醇100 ml,13.4%无氨基酸酵母氮源YNB 100 ml,0.02%生物素2 ml,1 mol/l pH值6.0磷酸缓冲液100 ml。
YPD培养基:酵母提取物10 g、蛋白胨20 g,定容至900 ml,121℃高压蒸汽灭菌20 min后添加过滤灭菌的20%葡萄糖100 ml。
考马斯亮蓝试剂:考马斯亮蓝G-250 100 mg溶于50 ml 95%乙醇中,加入100 ml 85%磷酸,用蒸馏水稀释至1 000 ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G-250,4.7%(W/V)乙醇,8.5%(W/V)磷酸。
电泳系统:XCell SureLock®Mini-Cell蛋白垂直电泳槽(美国生产)。
1.2 方法
1.2.1 重组表达载体的构建
NZ2114蛋白序列如下:
抗菌肽Plectasin:GFGCNGPWDEDDMQCHNHCKSIKGYKGGYCAKGGFVCKCY
菌丝霉素NZ2114:GFGCNGPWNEDDLRCHNHCKSIKGYKGGYCAKGGFVCKCY
根据蛋白编码序列,设计相对应毕赤酵母的酵母偏爱性密码子,提交生物公司合成。将合成的NZ2114基因克隆到pUC57中,用XhoI、AvrII双酶切后,将NZ2114基因插入毕赤酵母表达载体pPicZα,位于α因子信号肽突变体序列的下游,得到重组质粒pPicZα-NZ2114,并对该质粒进行限制性酶切及测序鉴定。将重组质粒pPicZα-NZ2114经PmeI酶切后,电转到毕赤酵母 GS115 中,用含 500~1 000 μg/ml Zeocin(博莱霉素)的YPD培养基筛选,30 ℃培养2~3 d,PCR鉴定筛选多拷贝阳性转化子[4]。
1.2.2 菌丝霉素NZ2114基因在毕赤酵母中表达
将阳性转化子接种于含20 ml BMGY(含Zeocin 500 μg/ml)培养基的试管中,30 ℃、220 r/min摇床培养24 h。将20 ml菌液转移至200 ml BMMY诱导培养基中,30℃、220 r/min继续培养,每24 h补加1%的含量100%甲醇,共培养120 h。
1.2.3 菌丝霉素NZ2114组成型表达菌株的中试发酵
一级种子:上述筛选得到的抗菌活性最强的重组菌株斜面菌种,用接菌针将其接入含YPD培养基100 ml的500 ml锥形瓶中,30 ℃、220 r/min培养17 h;二级种子:按10%的接种量接入含有YPD培养基9 L的20 L发酵罐,同样条件下培养约24 h。
50 L罐发酵:培养在50 L发酵罐中进行,发酵罐基础培养基为25 L的YPD培养基,接种前校正pH值电极和溶氧电极,培养过程中保持通气量大于60 L/min,发酵过程中菌体利用葡萄糖产酸,用氨水溶液调节pH值5.0,培养温度设定为30.0℃,起始转速为250 r/min,随着菌体的生长不断提高转速,发酵过程中控制溶氧大于20%,培养96 h后放罐。每24 h取少量发酵液,测定其菌体湿重、葡萄糖残糖量、蛋白含量、抑菌活性以及MIC值。转速、温度、pH值和溶氧等参数由发酵罐自动检测,记录数据。
1.2.4 菌丝霉素NZ2114组成型表达菌株的中试发酵产物测定
发酵液蛋白浓度测定:取100 μl的发酵液溶液于小试管中,用双蒸水调整体积到1 ml,然后加入5 ml考马斯亮蓝试剂,充分振荡混合,5 min后于595 nm测定光吸收值。以1 ml双蒸水及加5 ml考马斯亮蓝试剂作为空白对照。
发酵液抑菌活性测定:以金黄色葡萄球菌CMCC26003为实验菌株,将金黄色葡萄球菌悬浮液(OD600nm=0.5~0.6)50 μl与 46 ℃的 LB 固体培养基100 ml混匀后铺平板,待其凝固后4℃保存,用无菌打孔器打孔,每孔中滴加待测培养发酵液上清(诱导0、24、48、72、96 h)5 μl,待孔中液体被培养基吸收完全后,上述平板37℃倒置培养过夜(10~12 h)。以同体积的无菌水培养上清为阴性对照,氨苄青霉素(Amp)为阳性对照。
发酵液MIC测定:将受试菌CMCC26003在平板划线,再转接到相应的液体培养基中,至对数生长期,用生理盐水调节受试菌液,使之在OD625nm=0.09~0.1,然后按1∶100稀释,摇匀。发酵液菌丝霉素蛋白用微孔滤膜过滤,加入受试菌中,并使终浓度稀释为1 200、1 500、2 000倍。然后置于37℃条件下,培养12 h。空白对照为未加发酵液和氨苄青霉素。阳性对照为氨苄青霉素(100 μg/ml)。
2 结果
2.1 重组载体的构建与鉴定
以pUC57为模板,利用上下游特异性引物F和R,通过PCR方法获得编码菌丝霉素NZ2114蛋白的DNA片段。扩增产物经1.5%琼脂糖凝胶电泳,在500 bps附近得到目的条带,与预期大小相符(见图2)。PCR扩增得到的基因片段经限制性内切酶(Xho I和AvrII)双酶切后将NZ2114基因连接到毕赤酵母表达载体pGAPZα上,位于α因子信号肽突变体序列的下游,得到重组质粒pPicZα-NZ2114,Zeocin抗性筛选重组转化子并送生物技术有限公司进行DNA序列测定。挑取抗性平板上的多拷贝转化子,30℃、220 r/min,振荡培养过夜,离心收集菌体进行PCR鉴定,结果(见图2)显示:NZ2114基因位于α-factor突变体基因下游,二者总共约500 bps,PCR鉴定所得到编码重组蛋白菌丝霉素NZ2114的DNA序列与预期一致,即所挑取重组子呈阳性转化子。

图2 PCR扩增产物
2.2 菌丝霉素NZ2114基因在毕赤酵母中表达
将上述PCR鉴定呈阳性的重组转化子接种于含20 ml BMGY(含Zeocin 500 μg/ml)培养基中的试管中,30℃、220 r/min摇床培养24 h。将20 ml菌液转移至200 ml BMMY诱导培养基中,30℃、220 r/min继续培养,每24 h补加1%的含量100%甲醇,共培养120 h后,离心收集发酵液上清。发酵液上清的Tricine-SDS-PAGE结果表明,重组转化子培养上清在4.4 kDa处均有一明显的蛋白条带(见图3),与菌丝霉素NZ2114蛋白的理论分子量一致。琼脂孔穴扩散法测定甲醇诱导重组转化子的抗菌活性结果也显示(见图4),重组转化子甲醇诱导发酵液上清对金黄色葡萄球菌CMCC26003具有明显的抑制作用。
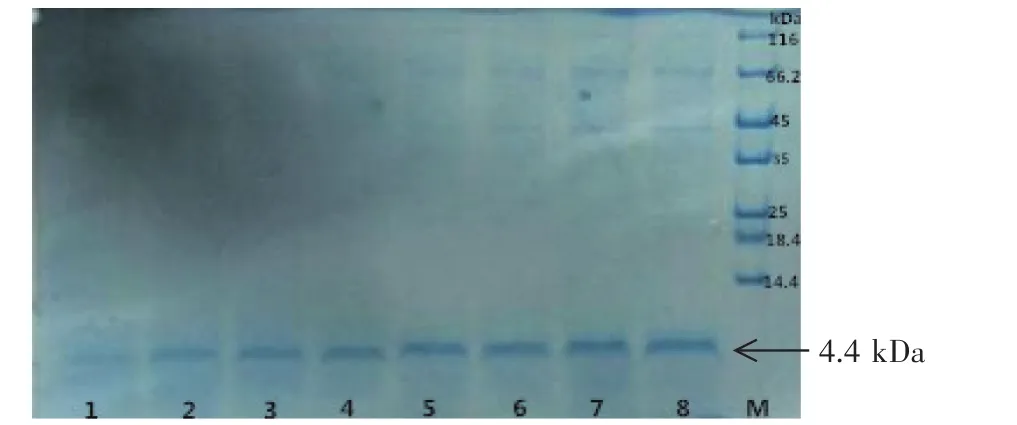
图3 甲醇诱导毕赤酵母重组表达菌丝霉素的发酵液电泳分析
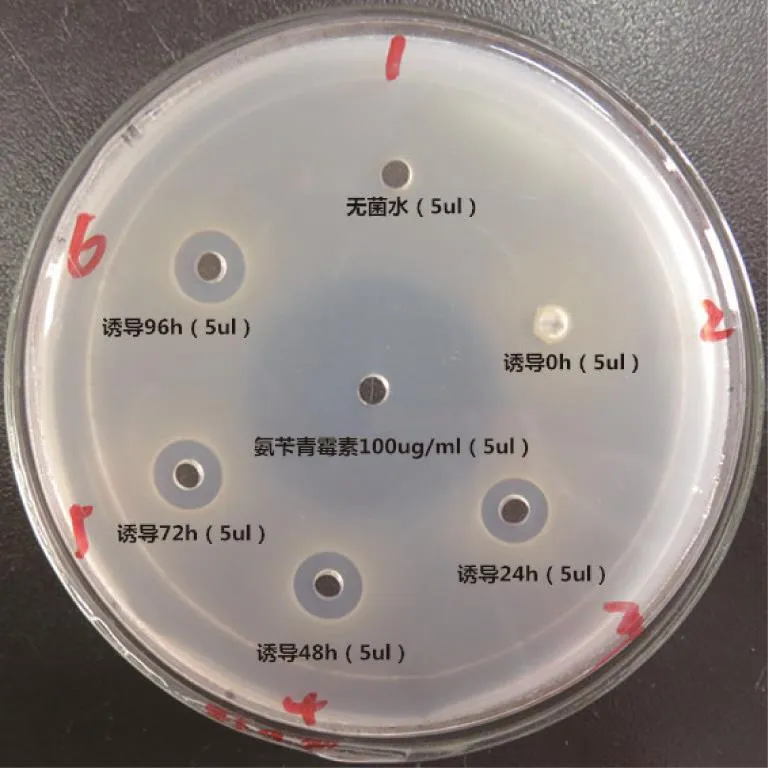
图4 诱导毕赤酵母重组表达菌丝霉素的发酵液抑菌活性
2.3 菌丝霉素NZ2114组成型表达菌株的中试发酵
经电泳系统筛选得到工程菌毕赤酵母pPicZα-NZ2114,通过种子活化和二级种子扩增后,转入50 L发酵罐进行中试发酵研究。如图5所示,工程菌毕赤酵母pPicZα-NZ2114接种后0~4 h,菌体湿重缓慢增加,处于适应期,4 h后,菌体开始快速生长进入指数生长期,利用葡萄糖产酸导致pH值下降,缓慢流加氨水维持pH值在5.0左右。至发酵24 h后,加入甲醇诱导,随着发酵诱导时间的延长,抗菌活性增强,甲醇诱导48 h后,菌丝霉素NZ2114在毕赤酵母表达开始进入平台期,抗菌活性增长缓慢,至甲醇诱导96 h,抗菌活性达到最大,停止发酵,取发酵液离心保存上清。结果显示:培养0~24 h阶段,细胞湿重达到151.23 g/l,菌体细胞数最大值达到37亿个/ml,8 h后的残糖量维持0.05%;甲醇诱导0~96 h阶段,发酵液菌体湿重保持不变,菌体细胞数略有下降,蛋白浓度达到606 μg/ml。

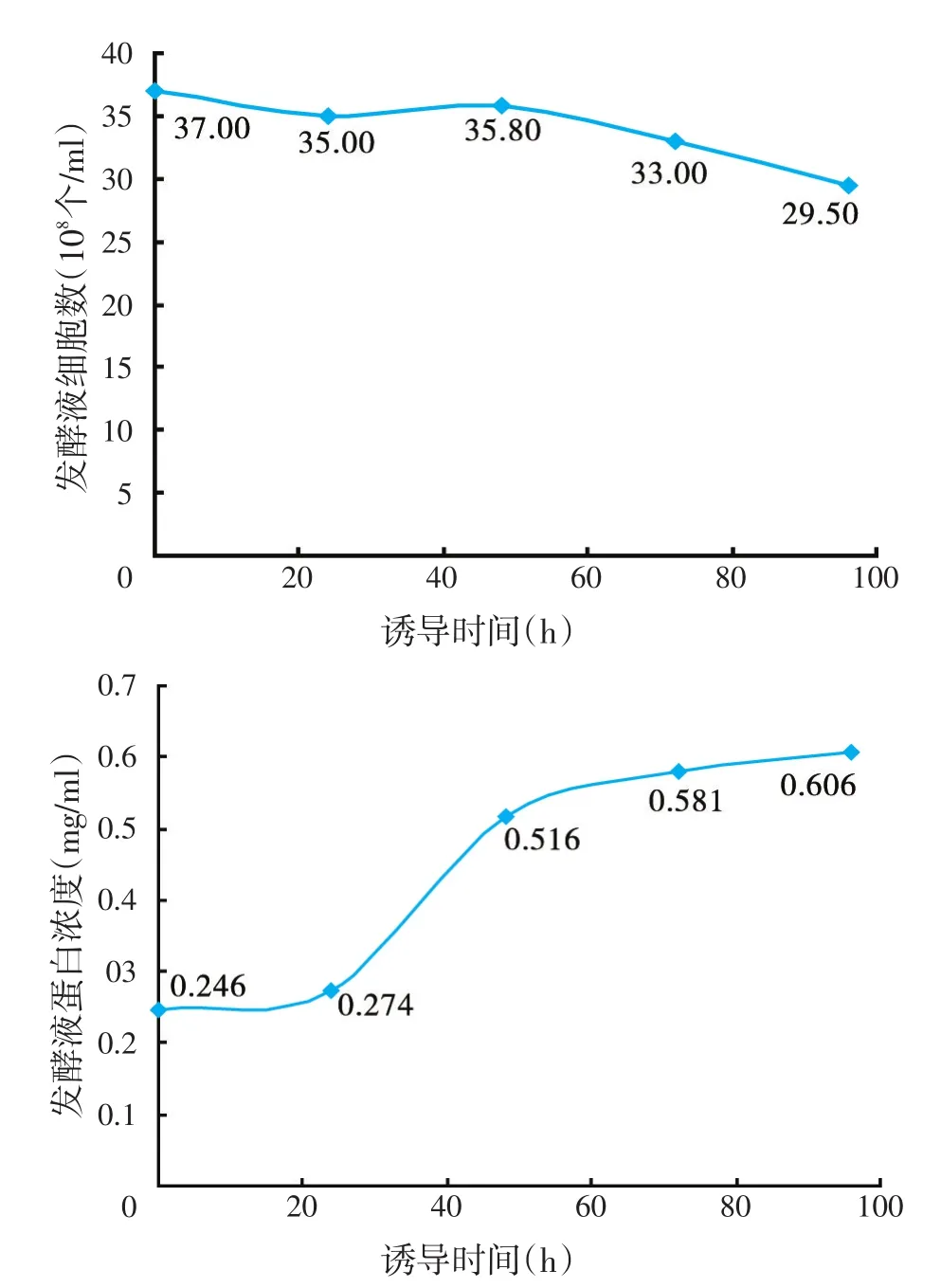
图5 50 L发酵罐种子在不同时间段的生长情况
2.4 菌丝霉素NZ2114组成型表达菌株中试发酵产物的检测
取发酵液离心的上清,经XCell SureLock®Mini-Cell蛋白垂直电泳系统检测结果显示,培养上清在4.4 kDa处均有一明显的蛋白条带(见图6),与菌丝霉素NZ2114蛋白的理论分子量一致。琼脂孔穴扩散法测定甲醇诱导菌丝霉素NZ2114蛋白的抗菌活性结果也显示(见图7),重组转化子甲醇诱导发酵液上清对金黄色葡萄球菌CMCC26003具有明显的抑制作用。
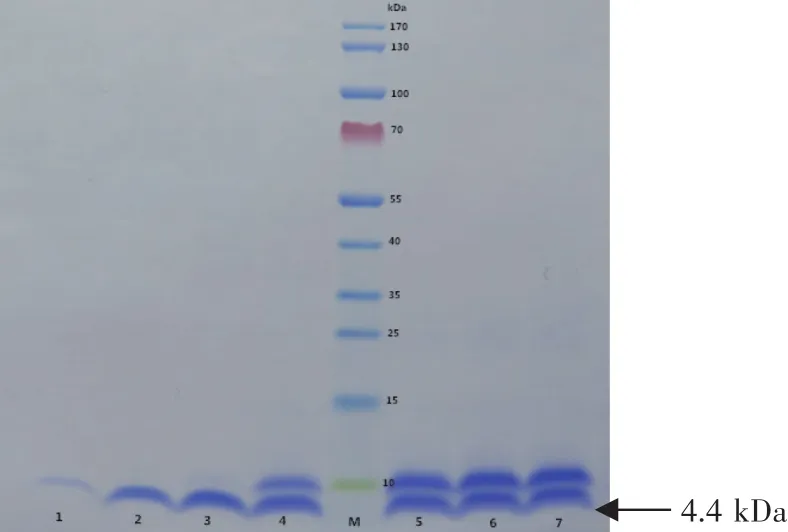
图6 不同时间段毕赤酵母重组表达菌丝霉素的Tricine-SDS-PAGE分析

图7 诱导毕赤酵母重组表达菌丝霉素的发酵液抑菌活性
50 L发酵罐诱导96 h获取发酵液上清,将上清用微孔滤膜过滤,加入受试菌中,并使终浓度稀释为1 200、1 500、2 000倍。然后置于37℃条件下,培养12 h。空白对照为未加发酵液和氨苄青霉素。阳性对照为氨苄青霉素(100 μg/ml)。结果显示:氨苄青霉素对金黄色葡萄球菌CMCC26003的MIC为0.028 6 μg/ml,菌丝霉素发酵液诱导96 h对金黄色葡萄球菌CMCC26003的MIC等效于氨苄青霉素0.012 3~0.016 3 μg/ml。

图8 诱导96 h时毕赤酵母重组表达菌丝霉素发酵液的MIC
3 讨论
目前,全球抗生素滥用情况日益严重,导致越来越多传统抗生素耐药致病菌株的产生,使人们重新审视抗生素的定位和作用。越来越多的国家对抗生素在农产品中的添加予以限制和禁止,因此,迫切需要开发能够取代传统抗生素的新型添加剂[5]。防御素具有独特的抗菌机理、不易产生耐药性和杀菌高效性的优势,并且具有多靶向性和多作用途径的免疫保护促进作用,有望成为新一代的抗感染药物,具有广阔的发展前景[2]。
体外实验研究报道[6],菌丝霉素对G-和真菌抑菌效果不理想,而对G+的几个种类(包括链球菌属、葡萄状球菌属、肠球菌属、棒状杆菌属和杆状菌属)具有杀伤作用,尤其是菌丝霉素对肺炎链球菌(S.pneumoniae)的MIC仅为0.125 mg/l[2],与万古霉素和青霉素的杀菌速率相当[7]。菌丝霉素具有良好的盐离子耐受能力,在生理盐离子浓度下同样具有杀菌活性。此外,它还具有良好的pH值稳定性和热稳定性,在pH值2.0~10.0范围内,菌丝霉素对金黄色葡萄球菌均有抑菌活性;100℃热处理1 h后,亦能抵抗木瓜蛋白酶和胃蛋白酶的降解[8]。此外,菌丝霉素对鼠类L929成纤维细胞、正常的人角质化表皮细胞(NHEK)、肺成纤维细胞和人支气管上皮细胞都没有细胞毒性,对人血红细胞、兔血红细胞也没有溶血性[6]。
研究开发防御素的主要任务是寻求低成本且获得大量高活性抗菌肽的工艺。天然提取的防御素非常有限,化学合成成本高,且其分子中含有3~4对二硫键,化学合成也比较困难,不足以满足临床需要。通过基因工程表达技术以其低成本、重组肽活性高和可以对基因进行改造等优势,在防御素表达中得到迅速发展和应用。毕赤酵母表达系统是真核表达系统,已有多种外源蛋白在酵母表达系统中成功表达并得以应用。它具有完备的基因表达调控机制、蛋白质加工修饰及分泌能力,而且不会产生内毒素[9]。此方法获得的菌丝霉素方便快捷,不会因内毒素而导致动物机体中毒和腹泻;同时,组成型区别于甲醇诱导型的酵母表达方式,培养简单,无需更换碳源,也可以避免挥发性的毒性物质甲醇污染动物机体和环境[5]。
4 结语
本研究基于菌丝霉素具有良好的稳定性,通过毕赤酵母表达系统表达菌丝霉素NZ2114基因,通过信号肽将其分泌到细胞外,并进行了50 L发酵罐的中试研究。结果显示:菌体湿重后期增长缓慢,其主要原因是菌丝霉素NZ2114在表达的过程中,随着菌丝霉素NZ2114蛋白浓度不断上升,其表现出对酵母宿主菌的毒性作用,当表达的菌丝霉素NZ2114蛋白浓度达到一定浓度后,宿主菌停止生长,菌丝霉素NZ2114表达进入平台期后结束发酵;菌丝霉素NZ2114发酵液稀释1 500~2 000倍对金黄色葡萄球菌CMCC26003具有抑制作用;该发酵周期短,培养简单方便,成本低。后期主要提高菌丝霉素NZ2114基因工程菌的生物量及其表达量,通过优化发酵培养基的碳氮比,进一步降低生产成本,为日后的规模化大生产和应用奠定基础;同时促进抗菌肽菌丝霉素在兽药、医药、生物农药、生物饲料添加剂、天然食品防腐剂、动植物抗病基因工程方面等领域上的发展。

