深松与包膜尿素对玉米田土壤氮素转化及利用的影响
李 娜, 宁堂原,3,*, 崔正勇, 田慎重, 郭利伟, 李增嘉, 韩惠芳, 刘 轶
1 山东农业大学作物生物学国家重点实验室,山东省作物生物学重点实验室, 泰安 271018 2 山东农业大学农业部作物水分生理与抗旱种质改良重点实验室, 泰安 271018 3 山东农业大学国家缓控释肥工程技术研究中心, 泰安 271018
深松与包膜尿素对玉米田土壤氮素转化及利用的影响
李 娜1,2, 宁堂原1,2,3,*, 崔正勇1, 2, 田慎重1,2, 郭利伟1,2, 李增嘉1,2, 韩惠芳1,2, 刘 轶1,2
1 山东农业大学作物生物学国家重点实验室,山东省作物生物学重点实验室, 泰安 271018 2 山东农业大学农业部作物水分生理与抗旱种质改良重点实验室, 泰安 271018 3 山东农业大学国家缓控释肥工程技术研究中心, 泰安 271018
耕作方式和氮肥施用是影响土壤中氮肥转化、利用效率和作物产量的重要因素。通过夏玉米田的2a(2011—2012)定位试验,研究了两种耕作方式(深松、旋耕)配合不同尿素类型(包膜尿素、普通尿素)的施用对玉米田土壤硝态氮和铵态氮含量、脲酶活性、硝化细菌和反硝化细菌数量、玉米产量以及氮肥农学效率的影响。研究结果表明:相同耕作方式下,包膜尿素处理土壤中脲酶活性较稳定,且增加了旱田土壤亚硝酸细菌数量而降低了反硝化细菌数量,有利于土壤硝态氮含量的提高,尤其是作物生长的中后期;包膜尿素处理的产量比普通尿素提高7.25%—10.82%,同时提高氮肥农学效率。深松处理增加了土壤中的反硝化细菌数量,配合施用包膜尿素进一步提高了土壤脲酶活性,增加了亚硝酸细菌数量;旋耕与包膜尿素配合施用在一段时期内能显著增加土壤硝态氮含量,减少反硝化细菌数量。深松配合包膜尿素处理能够显著的增加玉米产量,2a分别比旋耕配合包膜尿素增加1.41%和10.62%。因此,深松措施配合施用包膜尿素能够增强土壤脲酶活性,增加亚硝酸细菌数量,提高氮素转化速率,增加作物产量和氮肥农学效率,其稳产效果在干旱年份尤为显著。
玉米; 包膜尿素; 深松; 氮素转化; 产量
我国是粮食大国,也是人口大国,粮食安全问题一直备受关注。氮肥为粮食产量的提高提供了巨大动力,但氮肥施用过量或施用方式不当,不仅会降低氮肥的利用效率,还会降低作物的产量和品质,并导致环境污染。Zhu等[1]研究认为,中国干旱、半干旱地区,通过淋溶和径流损失的氮素约占施氮量的2%—5%,以气态形式损失的氮素占总损失量的30%—50%。土壤氮素转化不仅是作物生产的关键因素之一,也是评价土壤质量的重要指标,微生物在其转化过程中起主导作用,其中硝化作用和反硝化作用是造成氮素损失的重要途径[2],其产物N2O还是一种重要温室气体[3-4]。
施用肥料不仅影响土壤细菌的数量,也影响其活性、群体结构和多样性[5]。肥力水平高低将影响硝化作用[6]和反硝化作用[7]的强弱。酰胺态氮可以促进根际氨化细菌、反硝化细菌和脲酶等活性[8]。施用控释尿素是提高氮肥利用效率和作物产量的重要途径[9],可以提高土壤中硝态氮、铵态氮含量和多种土壤酶活性[10],同时能降低水田土壤的硝化-反硝化作用和土壤氨氧化[11]。同时,深松也是提高作物产量[12-13]的一项有效措施,可以打破犁底层,改变土壤通气性,提高土壤蓄水能力[12,14],增加作物根深[15],提高根系活性[16],从而影响微生物活性[17]和有机质氧化分解。可见,前人研究主要集中于氮肥对土壤氮素转化的整体作用,而对于包膜尿素、深松及其相互作用对旱田土壤氮素转化动态变化和作物产量的影响尚缺乏关注。本文通过田间试验,研究深松配合包膜尿素施用条件下旱田土壤无机氮含量、脲酶活性、反硝化细菌和亚硝酸细菌数量等氮素转化过程的动态变化,分析深松配合包膜尿素对玉米氮素利用的影响,为提高玉米产量和氮肥利用率提供理论依据。
1 材料与方法
1.1 试验材料与试验设计
试验于2011—2012年在山东农业大学农学实验站(36.16° N,117.15° E)进行,试验地点属于温带大陆性季风气候。2011年夏玉米生育期降水总量为606.2 mm,平均气温23.3 ℃;2012年夏玉米生育期降水总量为337.1 mm,平均温度为24.1 ℃。供试材料为郑单958。试验田土壤为棕壤土,0—20 cm土壤养分含量为:有机质12.9 g/kg,全氮1.0 g/kg,碱解氮89.8 mg/kg,速效磷52.6 mg/kg,速效钾88.9 mg/kg。
试验设两种耕作方式,分别为深松(S)和旋耕(R),深松耕作深度约为35—40 cm,旋耕耕作深度约为10—15 cm;每个耕作方式下设3个尿素处理,分别为基施普通尿素(U)225 kg N/hm2,基施包膜尿素(C)225 kg N/hm2和氮素空白处理(N0)。包膜尿素为树脂包膜尿素,含氮量43.5%,由山东农业大学研制、山东金正大生态工程股份有限公司生产,60 d肥料释放率为80%左右;普通尿素N质量分数为46.6%。
小区面积4 m×25 m,随机排列。前茬作物为冬小麦,收获后秸秆全部灭茬还田。夏玉米分别于2011年6月21日和2012年于6月19日播种,种植密度为67500株/hm2。各处理均按P2O5150 kg/hm2和 K2O 150 kg/hm2施磷钾肥,全部在旋耕前撒施。氮肥于播种时沟施,种距5 cm,施肥深度5—7 cm,其余管理同一般高产田。玉米两年均于10月初收获。
1.2 样品采集与测定
1.2.1 土壤无机氮含量及脲酶活性的测定
2011年样品采集工作从8月中旬玉米开花期开始,平均每10 d一次至收获期,主要针对夏玉米生育后期。2012年样品采集工作从玉米苗期至收获期,分别为:苗期(三叶期)、拔节期、小口期、大口期、开花期、灌浆期和收获期。用土钻分别取0—10、10—20、20—30和30—40 cm土层土样;每处理选取4个位点采集土样,其中两钻取自于肥料行,另两钻取自于非肥料行。取土后立即过2 mm筛,以去除土中杂质及包膜尿素。所取土样用以测定土壤硝态氮、铵态氮含量和脲酶活性,分别采用紫外分光光度法、靛酚蓝比色法[18]和靛酚比色法。
1.2.2 0—20 cm土层反硝化细菌数量与亚硝酸细菌数量的测定与计数
样品采集时间分别为2012年玉米苗期(三叶期)、小口期、开花期、花后30 d和收获期。用土钻取0—20 cm土层土样,去除杂质和包膜尿素后,参照MPN稀释法[19]进行室内培养:亚硝酸细菌设10-2—10-54个土壤溶液稀释度,反硝化细菌设10-4—10-85个溶液稀释度,每个浓度均设4次重复,并于28 ℃恒温培养箱中培养10 d后,亚硝酸细菌用格林试剂鉴定,反硝化细菌用二苯胺、格林试剂和萘氏试剂鉴定,最后用最大或然计数法计算细菌数量。
1.2.3 氮肥农学效率(AEN)的计算公式为:
AEN=(Y-Y0)/F
式中,Y为施氮肥后作物产量(kg/hm2);Y0为没有施氮肥的作物产量(kg/hm2);F为氮肥的投入量(kg/hm2)。
1.3 数据处理
试验所得数据采用Microsoft Excel 2007和PASW Statistics 18.0数据分析系统对数据进行处理和差异显著性分析(Duncan),利用Microsoft Excel 2007和SigmaPlot 10.0作图。
2 结果与分析
2.1 不同处理0—40 cm土壤氮素转化过程的变化动态
2.1.1 不同处理0—40 cm土壤铵态氮含量的变化动态
由图1所示,2011年夏玉米开花期至收获期,各处理土壤铵态氮含量较低。相同耕作方式下不同尿素处理铵态氮含量为C﹥U﹥N0;相同尿素处理不同耕作方式处理间比较,表现为S﹥R(C处理开花期除外)。2012年夏玉米苗期至收获期,不同处理之间土壤铵态氮含量差异较大:在相同耕作方式下,施用尿素会增加土壤中的铵态氮含量,但其含量随玉米生育时期的推进而下降,其中C处理下的铵态氮含量高于U(R处理苗期除外)。C处理的铵态氮含量在不同耕作方式下有较大的差异,除花后30 d外,CR均显著高于CS处理。表1示出,除耕作方式在2011年花后10 d和尿素因素在2012年花后30 d分别对土壤铵态氮含量影响显著外,其它时期均没有达到显著水平,但二者的交互作用对土壤铵态氮的影响在各时期均达到显著或极显著水平。
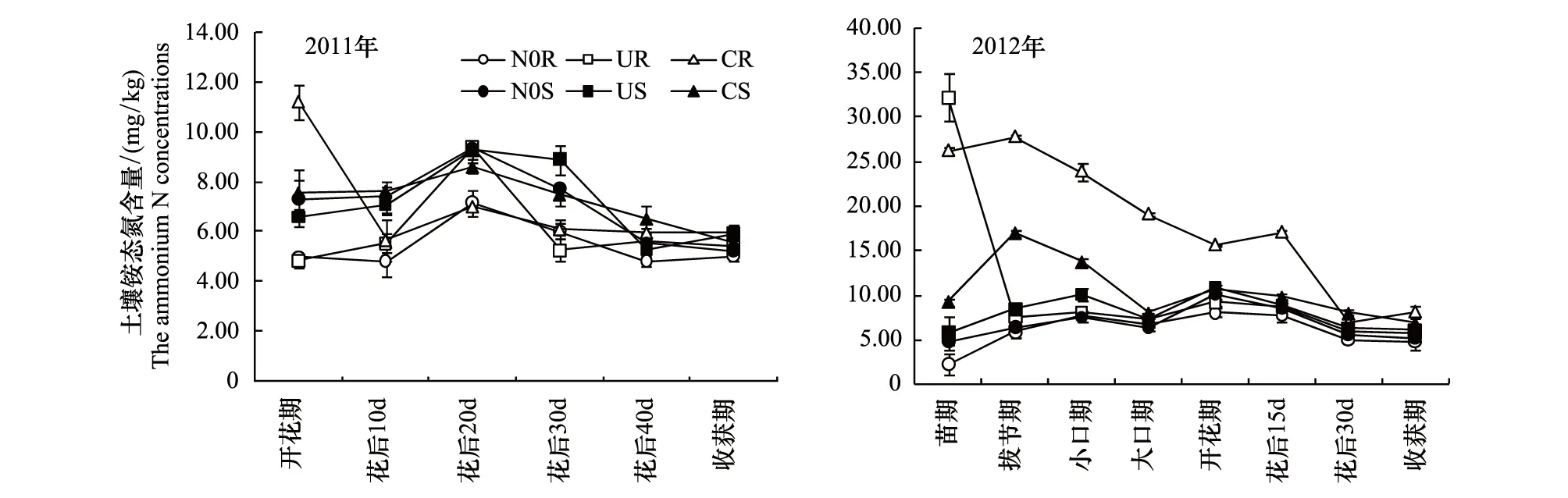
图1 不同处理0—40 cm土层铵态氮含量Fig.N0R: 旋耕+氮素空白 Rotary tillage and zero N treatment; UR: 旋耕+普通尿素 Rotary tillage and conventional urea treatment; CR: 旋耕+包膜尿素 Rotary tillage and polycoated urea treatment; N0S: 深松+氮素空白 Subsoiling and zero N treatment; US: 深松+普通尿素 Subsoiling and conventional urea treatment;CS: 深松+包膜尿素 Subsoiling and polycoated urea treatment
2.1.2 不同处理0—40 cm土壤硝态氮含量的变化动态
由图2可以看出,相同耕作方式下,2011年夏玉米生长后期U处理的硝态氮含量略高于N0处理,而C处理高于U和N0处理(S处理花后40 d除外),尤其在开花期和花后10 d,CR处理显著高于其他处理。2012年,N0处理的硝态氮含量以苗期最高,然后迅速下降,小口期之后基本稳定;U处理的硝态氮含量亦在苗期达到最高值,但持续时间较短,至玉米开花期时,US与UR处理的硝态氮分别降至8.34和7.69 mg/kg;C处理的土壤硝态氮除苗期以外,均高于U处理。相同尿素类型条件下,玉米拔节期至花后15 d土壤中硝态氮含量以R处理较高,但花后15 d之后以S处理的含量较高。2012年玉米小口期和开花期,尿素因素对土壤硝态氮含量的影响达到显著水平,耕作方式与尿素的交互作用在玉米各时期均达到显著或极显著水平(表1)。

图2 不同处理0—40 cm土层硝态氮含量Fig.
2.1.3 不同处理0—40 cm土壤脲酶活性的变化动态


表1 氮肥不同耕作方式与氮肥因素对土壤硝态氮、铵态氮含量、脲酶活性及亚硝酸细菌和反硝化细菌数量的方差分析(P)

图3 不同处理0—40 cm土层土壤脲酶活性Fig.3 Soil urease activity in the 0—40 cm layers under different treatments
2.1.4 不同耕作方式和尿素处理对0—20 cm土层反硝化细菌数量的影响
不同生育时期耕作方式和尿素因素的交互作用对0—20 cm土层反硝化细菌数量的影响均达到显著水平(表1)。不同耕作方式之间的比较(图4),N0R处理的反硝化细菌数量随生育时期的推进逐渐增加,于灌浆期达到最大值,收获期下降;N0S处理则在苗期即有较高的数量水平,但拔节期较低,之后逐渐升高至收获期;且N0S处理的反硝化细菌数量均显著高于N0R处理(P﹤0.05)。UR处理的反硝化细菌数量的高峰出现在小口期,之后逐渐降低,但数量在收获期又明显增加;而US处理的反硝化细菌数量高峰出现在苗期,之后逐渐降低;C处理,反硝化细菌数量在两种耕作方式中的变化均呈“V”型,但变化的转折点所出现的时间不同:CR处理反硝化细菌数量在小口期下降至最低水平,而CS处理的最低值出现在开花期。

图4 不同取样时间0—20 cm土层土壤反硝化细菌数量的变化趋势Fig.4 Soil denitrifying bacteria numbers with 0—20 cm layers at different sampling time小写字母不同表示差异达到5%的显著水平
施用尿素与否以及尿素的类型对反硝化细菌数量均有影响(图4)。相同耕作方式下,N0处理的反硝化细菌数量虽然在苗期和小口期显著低于U处理,但在个别时期的数量甚至超过了U或C处理。除花后30 d CR﹥UR和成熟期CS﹥US、CR≈UR外,其余各取样时期U处理土壤中的反硝化细菌数量均显著高于C处理(P﹤0.05)。
2.1.5 不同耕作方式和尿素类型对土壤0—20 cm亚硝酸细菌数量的影响
参与土壤硝化作用的细菌一般分为亚硝酸细菌和硝酸细菌,两种细菌参与的两个过程是连续进行的,由于土壤中很少有亚硝酸盐的积累,所以测定亚硝酸细菌的数量即能说明硝化细菌数量的多少[19]。
不同生育时期耕作方式和尿素因素的交互作用对0—20 cm土层亚硝酸细菌数量的影响也均达到显著水平(表1)。由图5可以看出,从苗期至收获期,N0处理在两种耕作方式下土壤亚硝酸细菌数量总体趋势均为:高-低-高,苗期的数量值最高,然后逐渐下降,0R和0S处理分别于开花期和灌浆期达到最低值,之后小幅上升。U处理的亚硝酸细菌数量与N0处理的变化趋势基本一致,但数量显著高于后者(S处理收获期除外)。C处理的亚硝酸细菌随生育期的推进波动较大:CR处理亚硝酸细菌数量在小口期迅速上升并达到峰值,之后下降且变化趋势及数量同UR处理基本一致;而CS处理的亚硝酸细菌数量从苗期逐渐上升至开花期,花后30 d迅速下降,之后略有上升。CS和CR两处理土壤中亚硝酸细菌数量整体上表现为CS﹥CR(平均值分别为7693.1和5636.6 cfu/g)。S条件下,除苗期外,土壤亚硝酸细菌数量均表现为C﹥U(P﹤0.05);而R条件下则无此趋势,说明CS处理有利于亚硝酸细菌的生长和繁殖。

图5 不同取样时间0—20 cm土层亚硝酸细菌数量的变化趋势 Fig.5 Soil nitrite bacteria numbers with 0—20 cm layers at different sampling time
2.2 年际间不同耕作方式和尿素类型对夏玉米产量和氮肥利用效率的影响
2.2.1 不同耕作方式和尿素类型对夏玉米产量和氮肥利用效率的影响
由表2可以看出,年际间产量表现为2011﹥2012,2011年玉米产量表现为CS≈CR﹥US﹥UR≈0S﹥0R,而2012年为CS﹥CR≈US﹥UR≈0S≈0R。尽管不同处理在年际间略有差异,但不同尿素类型对产量的影响表现为C﹥U﹥N0;不同耕作方式对产量的影响表现为S﹥R;CS处理能显著提高玉米产量。与产量相似的是,AEN在2011年表现为CS≈CR﹥US﹥UR,2012年表现为CS﹥CR≈US﹥UR;相同耕作方式的条件下C处理的AEN值均显著高于U处理,尤其是CS处理,说明包膜尿素配合适宜的耕作方式不仅能提高氮肥的农学效率,更能加强作物的增产效果。

表2 夏玉米玉米产量和氮肥农学效率
2.2.2 耕作方式与氮肥因素及其交互作用对玉米产量的方差分析
由表3所示,2011年尿素因素对玉米的产量的影响达到极显著水平(P﹤0.01),而耕作方式及其与尿素因素的交互作用对产量的影响不显著;2012年耕作方式和尿素因素对玉米产量的影响均没有达到显著水平,但二者的交互作用对玉米产量有显著影响(P﹤0.05)。

表3 不同耕作方式与氮肥因素对玉米产量的方差分析
3 讨论
本研究认为深松或旋耕等耕作方式由于加速了土壤氮素矿化[20],使不施氮处理的土壤硝态氮含量有短暂升高(图2)。相同尿素处理条件下,玉米苗期深松处理的铵态氮含量和脲酶活性均比旋耕处理低(图1,图3),可能有由于深松打破了土壤犁底层,尿素分子分布相对分散,其水解速率比尿素分子相对集中的旋耕处理慢得多[21]。由于耕层土壤微生物数量最多,土壤20 cm以下,土壤微生物数量随土层深度的增加而减少[22],故本研究只针对0—20 cm土层进行硝化细菌和反硝化细菌数量的研究。本研究认为深松提高了土壤蓄水能力,改变了土壤通气性,有利于玉米根系的下扎,增加了反硝化细菌的数量(图4)。相同尿素处理条件下,深松处理的土壤中硝态氮含量在玉米苗期至花后15 d低于旋耕处理(图2),可能有3方面的原因:一是深松有利于作物根系生长,氮素吸收能力强,土壤中无机氮含量相对较低;二是深松打破了土壤犁底层,有增加氮素淋溶损失的风险;三是深松条件下的反硝化细菌数量高于旋耕处理,造成较多的反硝化损失(图4)。但2012年花后15 d之后,深松处理的硝态氮含量相对于旋耕处理均有升高,可能是由于深松相较于旋耕更有利于根系的下扎和氮肥下移,加之2012年玉米生育期降水量比2011年减少44.39%,根系由于向水肥性会向土壤更深层延伸,其主要吸收活跃层的下移[23]造成耕层土壤的硝态氮含量相对偏高。
玉米小口期和开花期尿素因素对土壤硝态氮含量的影响达到显著水平,长期施肥也可以改变细菌的活性和群落结构[5]。本研究认为旱田施用尿素不仅增加土壤硝态氮和铵态氮含量,而且增加土壤中亚硝酸细菌的数量(图5),短期内也能增加反硝化细菌的数量,但施肥一段时间(R处理开花期,S处理花后30 d)后,反硝化细菌数量下降甚至低于N0处理(图4);可能是由于施肥对反硝化细菌的影响因基因型而异[24],随土壤中无机氮含量的变化,导致优势菌的改变;也可能是因为土壤中硝态氮含量、pH值、容重等土壤环境因子与土壤反硝化细菌联系紧密[25],且其对反硝化细菌的影响取决于各因子的相对强弱。相同耕作方式下,与普通尿素处理相比,包膜尿素处理的脲酶活性更稳定,增加亚硝酸细菌数量,而显著降低了土壤中反硝化细菌数量,从而使土壤中硝态氮和铵态氮含量在较长时间内保持较高水平,尤其是作物生长的中后期。这与有关研究认为包膜尿素能降低反硝化损失[26]的结果是一致的,包膜尿素由于膜层的存在,不仅使土壤无机氮含量升高,也影响根际土壤的水分[27]、pH值、以及通气性等,造成根际微环境的变化。深松与包膜尿素的交互作用对土壤硝态氮和铵态氮含量、脲酶活性、以及硝化细菌和反硝化细菌数量均产生了显著影响,包膜尿素配合深松比其配合旋耕,其反硝化细菌数量和亚硝酸细菌数量均高于后者。
施用包膜尿素比普通尿素能增加土壤氮素转化效率,同时减少反硝化损失,提高土壤硝态氮和铵态氮含量,同时还显著提高了玉米产量和氮肥农学效率。同样,深松也是提高夏玉米产量的重要因素,深松能打破长期浅耕而形成的犁底层,增加土壤蓄水能力,提高根系活性,同时提高氮肥农学效率,这与已有研究结果是一致的[13,15]。深松配合包膜尿素施用后,表现出显著的增产潜力,玉米产量在2011年和2012年较旋耕处理分别提高1.41%和10.62%,并且显著提高了氮肥农学效率(表2)。说明干旱年份,深松配合包膜尿素比旋耕配合包膜尿素的增产效果更显著。
[1] Zhu Z L, Chen D L. Nitrogen fertilizer use in China-Contributions to food production, impacts on the environment and best management strategies. Nutrient Cycling in Agroecosystems, 2002, 63(2/3): 117-127.
[2] Schloter M, Dilly O, Munch J C. Indicators for evaluating soil quality. Agriculture, Ecosystems and Environment, 2003, 98(1/3): 255-262.
[3] Mathieu O, Hénault C, Lévêque J, Baujard E, Milloux M J, Andreux F. Quantifying the contribution of nitrification and denitrification to the nitrous oxide flux using15N tracers. Environmental Pollution, 2006, 144(3): 933-940.
[4] 秦晓波, 李玉娥, 石生伟, 万运帆, 纪雄辉, 廖育林, Wang H, 刘运通, 李勇. 稻田温室气体排放与土壤微生物菌群的多元回归分析. 生态学报, 2012, 32(6): 1811-1819.
[5] Enwall K, Philippot L, Hallin S. Activity and composition of the denitrifying bacterial community respond differently to long-term fertilization. Applied and Environmental Microbiology, 2005, 71(12): 8335-8343.
[6] 李良谟, 潘映华, 周秀如, 伍期途, 李振高. 太湖地区主要类型土壤的硝化作用及其影响因素. 土壤, 1987, 19(6): 289-293.
[7] 俞慎, 李振高. 稻田生态系统生物硝化-反硝化作用与氮素损失. 应用生态学报, 1999, 10(5): 630-634.
[8] 熊淑萍, 车芳芳, 马新明, 王小纯, 安帅, 李燕强. 氮肥形态对冬小麦根际土壤氮素生理群活性及无机氮含量的影响. 生态学报, 2012, 32(16): 5138-5145.
[9] 王素萍, 李小坤, 鲁剑巍, 李慧, 吴庆丰, 汪航, 王寅, 肖国滨, 薛欣欣, 徐正伟. 施用控释尿素对油菜籽产量、氮肥利用率及土壤无机氮含量的影响. 植物营养与肥料学报, 2012, 18(6): 1451-1458.
[10] 王鑫, 徐秋明, 曹兵, 张占军, 马生发. 包膜控释尿素对保护地菜地土壤肥力及酶活性的影响. 水土保持学报, 2005, 19(5): 77-84.
[11] Akiyama H, Morimoto S, Hayatsu M, Hayakawa A, Sudo S, Yagi K. Nitrification, ammonia-oxidizing communities, and N2O and CH4fluxes in an imperfectly drained agricultural field fertilized with coated urea with and without dicyandiamide. Biology and Fertility of Soils, 2013, 49(2): 213-223.
[12] 刘巽浩. 耕作学. 北京: 中国农业出版社, 1994.
[13] 郑成岩, 于振文, 张永丽, 王东, 石玉, 许振柱. 土壤深松和补灌对小麦干物质生产及水分利用率的影响. 生态学报, 2013, 33(7): 2260-2271.
[14] 韩宾, 李增嘉, 王芸, 宁堂原, 郑延海, 史忠强. 土壤耕作及秸秆还田对冬小麦生长状况及产量的影响. 农业工程学报, 2007, 23(2): 48-53.
[15] 丁昆仑, Hann M J. 耕作措施对土壤特性及作物产量的影响. 农业工程学报, 2000, 16(3): 28-31.
[16] 王法宏, 王旭清, 任德昌, 于振文, 余松烈. 土壤深松对小麦根系活性的垂直分布及旗叶衰老的影响. 核农学报, 2003, 17(1): 56-61.
[17] Trevors J T. Bacterial biodiversity in soil with an emphasis on chemically-contaminated soils. Water, Air, and Soil Pollution, 1998, 101(1/4): 45-67.
[18] Markus D K, McKinnon J P, Buccafuri A F. Automated analysis of nitrite, nitrate, and ammonium nitrogen in soils. Soil Science Society of America Journal, 1985, 49(5): 1208-1215.
[19] 李振高, 骆永明, 腾应. 土壤与环境微生物研究法. 北京: 科学出版社, 2008.
[20] Balesdent J, Mariotti A, Boisgontier D. Effect of tillage on soil organic carbon mineralization estimated from13C abundance in maize fields. Journal of Soil Science, 1990, 41(4): 587-596.
[21] Gould W D, Cook F D, Webster G R. Factors affecting urea hydrolysis in several Alberta soils. Plant and Soil, 1973, 38(2): 393-401.
[22] 刁治民, 周富强, 高晓杰, 朱锦富, 张艳. 农业微生物生态学. 成都: 西南交通大学出版社, 2008.
[23] 于振文. 作物栽培学各论(北方本). 北京: 中国农业出版社, 2003.
[24] 陈哲, 陈春兰, 秦红灵, 王霞, 吴敏娜, 魏文学. 化肥对稻田土壤细菌多样性及硝化、反硝化功能菌组成的影响. 生态学报, 2009, 29(11): 6142-6147.
[25] 邢肖毅, 黄懿梅, 安韶山, 闫浩. 黄土丘陵区不同植被土壤氮素转化微生物生理群特征及差异. 生态学报, 2013, 33(18): 5608-5614.
[26] 刘德林, 聂军, 肖剑.15N标记水稻控释氮肥对提高氮素利用效率的研究. 激光生物学报, 2002, 11(2): 87-92.
[27] 胡恒宇, 李增嘉, 宁堂原, 王瑜, 田慎重, 仲惟磊, 张总正. 深松和尿素类型对不同玉米品种水分利用效率的影响. 中国农业科学, 2011, 44(9): 1963-1972.
Effects of polycoated urea and subsoiling on nitrogen transformation and utilization in a maize field
LI Na1,2, NING Tangyuan1,2,3,*, CUI Zhengyong1,2, TIAN Shenzhong1,2, GUO Liwei1,2, LI Zengjia1,2, HAN Huifang1,2, LIU Yi1,2
1StateKeyLaboratoryofCropBiology,ShandongKeyLaboratoryofCropBiology,ShandongAgriculturalUniversity,Tai′an271018,China2KeyLaboratoryofCropWaterPhysiologyandDrought-toleranceGermplasmImprovementofMinistryofAgriculture,ShandongAgriculturalUniversity,Tai′an271018,China3ChineseNationalEngineeringResearchCenterforSlow-ControlledReleaseFertilizers,ShandongAgriculturalUniversity,Tai′an271018,China
Tillage practices and fertilizer application play important roles in nitrogen transformation and utilization and grain yield. The objective of this study was to determine the effects of urea types and tillage modes on soil nitrate and ammonium N content, urease activity, abundance of denitrifying bacteria and nitrite bacteria, and grain yield and nitrogen use efficiency in a maize (ZeamaysL.) field. The treatments included two urea types (conventional urea and polycoated urea) applied at a rate of 225 kg N/hm2as a basal fertilizer; additionally, zero N treatments were set as the control under subsoiling and rotary tillage modes. Throughout the experiments in 2011 and 2012, the results showed that both the numbers of nitrite bacteria and denitrifying bacteria increased with the application of urea but then later would decrease to even fewer than in the zero N treatment. Compared with conventional urea, polycoated urea could stabilize soil urease activity and increase upland soil nitrite bacteria numbers but decrease the abundance of denitrifying bacteria. Also, polycoated urea was beneficial for accelerating nitrogen transformation into nitrate and reducing nitrogen losses from denitrification while keeping soil ammonium and nitrate N concentrations in the 0—40 cm layers at a high level for a long time, especially in the middle and later periods of maize growing season. Polycoated urea generally increased grain yield and agronomic efficiency of applied N by 7.25%—10.82% and 56.37%—84.54%, respectively, compared to those with conventional urea regardless of tillage practices. Rotary and subsoiling tillage could temporarily stimulate soil nitrate N concentration. Compared with rotary tillage, subsoiling tillage increased the numbers of denitrifying bacteria. Moreover, the interaction of polycoated urea and subsoiling tillage could not only increase the urease activity but also the abundance of nitrite bacteria. It would keep the nitrate N concentration at a high level in the later maize growing stage. However, nitrogen loss through denitrification and leaching in the early stage of the maize growing season may increase. Polycoated urea in rotary soils could significantly increase soil nitrate nitrogen concentration while reducing the number of denitrifying bacteria within a period of time. The application of polycoated urea in subsoil produced higher grain yield, with increases of approximately 1.41% and 10.62%, compared to those in rotary soil, in 2011 and 2012, respectively. So in a drought year, the effect of subsoiling tillage combined with polycoated urea may be more significant in increasing grain yield. In conclusion, subsoiling tillage coupled with polycoated urea increases urease activity and nitrous bacteria abundance, and stimulates nitrogen transformation, grain yield, and nitrogen use efficiency.
maize; polycoated urea; subsoiling; nitrogen transformation; yield
国家“十二五”科技支撑项目(2012BAD14B07, 2011BAD11B01); 公益性行业(农业)科研专项经费资助(201103001); 国家自然科学基金(30900876)
2014-01-16;
日期:2014-11-19
10.5846/stxb201401160132
*通讯作者Corresponding author.E-mail: ningty@163.com
李娜, 宁堂原, 崔正勇, 田慎重, 郭利伟, 李增嘉, 韩惠芳, 刘轶.深松与包膜尿素对玉米田土壤氮素转化及利用的影响.生态学报,2015,35(18):6129-6137.
Li N, Ning T Y, Cui Z Y, Tian S Z, Guo L W, Li Z J, Han H F, Liu Y.Effects of polycoated urea and subsoiling on nitrogen transformation and utilization in a maize field.Acta Ecologica Sinica,2015,35(18):6129-6137.

